細粒棘球絳蟲多價EgA31-EgG1Y162抗原序列優化分析①
張 杰 李玉嬌 張峰波 孔慧芳 周曉濤 王紅英 丁劍冰
(新疆醫科大學基礎醫學院,烏魯木齊 830011)
包蟲病(hydatid disease)又稱棘球蚴病,為自然疫源性疾病,是一種嚴重危害健康的人獸共患寄生蟲病,呈世界性分布和流行[1,2]。以細粒棘球絳蟲(echinococcus granulosus,Eg)的幼蟲引起的稱囊性包蟲病(cystic echinococcosis,CE)或稱囊性棘球蚴病,以多房棘球絳蟲幼蟲(echinococeosis multilo-cularis,Em)感染所引起的稱泡型包蟲病(alveolar echinococcosis,AE)[2,3]。我國包蟲病的高發區主要以青海、新疆、西藏、寧夏、內蒙古、四川、甘肅等地,其主要寄生在肝肺等重要器官,嚴重危害人體健康和畜牧業發展[4,5]。目前針對包蟲病的治療以手術輔以藥物治療為主,但控制的仍不理想,因此采取免疫預防是較為經濟有效的方法,但我們如何找到有效的疫苗是現在科學界迫在眉睫問題。近幾年多價疫苗的研究已是許多感染性疾病如包蟲疫苗的熱點課題[6,7]。傅玉才等[8]研究發現EgA31抗原在動物模型試驗中刺激機體產生體液免疫和細胞免疫反應,可作為理想的包蟲疫苗候選分子。為研究出更加經濟有效的包蟲病疫苗,曹春寶等[9]在細粒棘球蚴中發現了新基因—EgG1Y162抗原基因,研究發現 EgG1Y162蛋白能刺激宿主體內的免疫反應,因此EgG1Y162抗原被認為是一種理想的疫苗候選分子[10,11]。為了提高疫苗的有效性,將多個抗原進行聯合構成多價疫苗,較單價疫苗能更好的誘導宿主的免疫保護作用[12]。
本研究將EgA31抗原基因與EgG1y162抗原基因通過linker序列鏈接,將其融合抗原序列進行優化,構建原核表達系統,提高體外融合蛋白的表達。通過生物信息學方法分析優化抗原基因序列、密碼子、抗原表位等,為后期構建理想的蛋白疫苗和DNA疫苗奠定基礎。
1 材料與方法
1.1材料
1.1.1EgG1Y162蛋白基因序列的獲取 根據曹春寶等[9]構建的 EgG1Y162 重組蛋白,去除信號肽的基因cds序列為360 bp(GeneBank登錄號:AB458259)。
1.1.2EgA31蛋白基因序列的獲取 (GeneBank登記號為:AF067807),其氨基酸序列(GenBank登記號為:AAC21558.1)全長序列1 836 bp,編碼氨基酸為601個。根據課題組成員前期分析預測的該抗原表位預測結果,選擇優勢的易形成抗原表位的氨基酸序列為201~534,全長1 002 bp,編碼334個氨基酸。
1.1.3EgA31-EgG1Y162氨基酸獲取 通過登錄GeneBank得到蛋白氨基酸序列。
1.1.4EaA31-EgG1Y162抗原密碼分析 運用E.coli Codon Usage Analyzer 2.1在線軟件分析EgA31-EgG1Y162序列 優化前后密碼子使用度。
1.1.5試劑 構建成功的Pet30a-EgG1Y162-EgA31 原核表達質粒,IPTG誘導劑,大腸桿菌(Escherichia coli)BL21(DE3)感受態細胞,卡那霉素,LB培養基(胰蛋白胨,酵母提取物,氯化鈉 ),SDS-PAGE蛋白凝膠試劑盒,蛋白marker,考馬斯亮藍染色液,脫色液,凝膠成像儀,37℃恒溫培養箱,搖床。
1.2方法
1.2.1重組抗原基因 抗原基因cds序列EgA31-EgG1Y162進行重組構建,為后期蛋白的有效的表達。
1.2.2EgA31-EgG1Y162蛋白的理化性質分析 使用Expasy在線軟件ProtParam[13](http://web.expasy.org/protparam/)分析EgA31-EgG1Y162 蛋白的理化性質特點。
1.2.3EgA31-EgG1Y162蛋白二級結構 使用DNAstar軟件的protean的模塊對截短序列EGA31蛋白,EgG1Y162蛋白及聯合蛋白EgA31-EgG1Y162蛋白進行二級結構分析,比較單獨的兩個序列用link連接后結構有無發生改變。
1.2.4EgA31-EgG1Y162蛋白二級結構分析 運用在線軟件SOMPA[14](https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析EgA31-EgG1Y162蛋白的二級結構:α-螺旋,β-折疊,β-轉角和無規則卷曲進行分析。
1.2.5EgA31-EgG1Y162抗原DNA序列對比 運用DNAStar軟件的Blast模塊將優化前后的序列進行DNA序列比對,比較兩者序列中堿基的變化情況。
1.2.6EgA31-EgG1Y162蛋白的密碼分析 運用在線軟件E.coli Codon Usage Analyzer 2.1[15]分析序列優化前后密碼子的適應指數。
1.2.7EgA31-EgG1Y162蛋白T細胞表位分析運用在線軟SYFPEITHI[16](http://www.syfpeithi.de/bin/mhcserver.dll/epitopeprediction.htm)、運用在線軟件 IEDB[16](http://tools.iedb.org/mhcii/)參數選擇HLA-DRB1*0701,分析聯合抗原EgA31-eGgay162的T細胞優勢抗原表位。
1.2.8EgA31-EgG1Y162蛋白B細胞表位分析 運用在線軟件ABCpred[17](http://crdd.osdd.net/raghava/abcpred/ABC_submission.html)、BepiPred-1.0[18](http://www.cbs.dtu.dk/services/BepiPred-1.0/)分析融合蛋白EgA31-EgG1Y162的B細胞優勢抗原表位。
1.2.9EgA31-EgG1Y162蛋白誘導表達 原核表達質粒轉化BL21感受態細胞培養過夜,挑陽性單菌落搖菌培養過夜,按1∶100接種種子菌液至液體培養基中,220 r/min 37℃ 搖床培養至OD值為0.6~0.8時,經IPTG體外誘導蛋白表達,3 000 r/min離心15 min 4℃收集菌體沉淀,-80℃保存備用。
1.2.10EgA31-EgG1Y162蛋白樣品的制備 蛋白樣品的獲取:1%的SDS溶解菌體沉淀,4℃ 300 W,間隔5 s、超聲5 s、超聲2 min,12 000 r/min離心5 min 4℃,收集上清。按1∶3加入4×蛋白上樣緩沖液,沸水煮10 min,使蛋白質變性,備用。
1.2.11SDS-PAGE電泳 配置12%的分離膠,5%的濃縮膠制備蛋白電泳凝膠,蛋白上樣10 μl,80 V 20 min濃縮膠,100 V 90 min分離膠條件下電泳,電泳結束后用考馬斯亮藍色液室溫染色4 h,脫色3次,每次60 min,凝膠成像儀拍照看蛋白誘導表達結果。
2 結果
2.1EgA31-EgG1Y162蛋白誘導表達 重組pET30a-EgA31-EgG1Y162原核表達質粒在大腸桿菌BL21感受態細胞中,經IPTG體外誘導蛋白表達,理論蛋白大小58 kD,圖1與預期理論結果一致,得出1~4,條件下誘導出的蛋白表達量均高。在IPTG 0.5 mmol/L 28℃ 2 h 37℃ 3 h的條件下,誘導的蛋白濃度與其他條件相比最高。
2.2EgA31-EgG1Y162蛋白的理化性質的分析結果 使用ProtParam在線軟件分析EgA31- EgG1Y162蛋白有462個氨基酸組成,蛋白分子質量為52 926.58 Daltons;理論pI值為6.51;含有78強堿性(+)氨基酸(K,R);81 強酸性(-)氨基酸(D,E);原子組C4072 h6757N1389O1638S335,不穩定系數為40.17,歸類為不穩定蛋白(大于40時,預測蛋白不穩定);平均親水系數GRAVY:-0.774(GRAVY值的范圍在-2到2之間,負值表明為親水性蛋白)歸類為親水性蛋白。
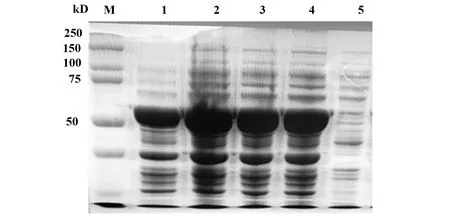
圖1 蛋白誘導表達 SDS-PAGE 結果Fig.1 Protein-induced expression SDS-PAGE resultsNote:M.Protein marker;1.IPTG 0.5mmol/L 28℃ 2 h 37℃ 2 h;2.IPTG 0.5 mmol/L 28℃ 2 h 37℃ 3 h;3.IPTG 0.5 mmol/L 28℃ 2 h 37℃ 4 h;4.IPTG 0.2 mmol/L 28℃ 2 h 37℃ 2 h;5.Uninduced.
2.3EgA31-EgG1Y162抗原的蛋白質二級結構分析 使用在線軟件SOPMA對EgA31-EgG1Y162抗原的α-螺旋、β-折疊、β-轉角、無規卷曲二級結構進行分析和預測。如下圖2藍色Hh表示α-螺旋,約占69.05%,紅色Ee表示β-折疊,約占10.17%,綠色Tt表示β-轉角約占5.63%,紫色Cc表示無規卷曲,約占15.15%。
2.4抗原優化后蛋白質二級結構的分析和對比 運用DNAstar軟件的protein模塊中的Garnier-Robson法和Chou-Fasman法分析EgA31EgG1Y162蛋白(圖 3),EgA31蛋白(圖4)的二級結構EgG1Y162蛋白(圖5),紅色表示為α-螺旋(alpha),綠色表示為β-折(beta),藍色表示為β-轉角(turn),黃色表示為不規則卷(coil)。從預測的結果分析,多價EgA31-EgG1Y162蛋白的二級結構與單獨的EgA31和EgG1Y162蛋白二級結構比較,其α-螺旋,β-折疊(beta)區域基本無變化。β-轉角(turn),不規則卷曲(coil)區域抗原指數增加,其linker連接部位的兩側指數增加指數較高。蛋白的親水性、蛋白抗原的表面可及性、抗原指數均在linker連接兩側有所增加
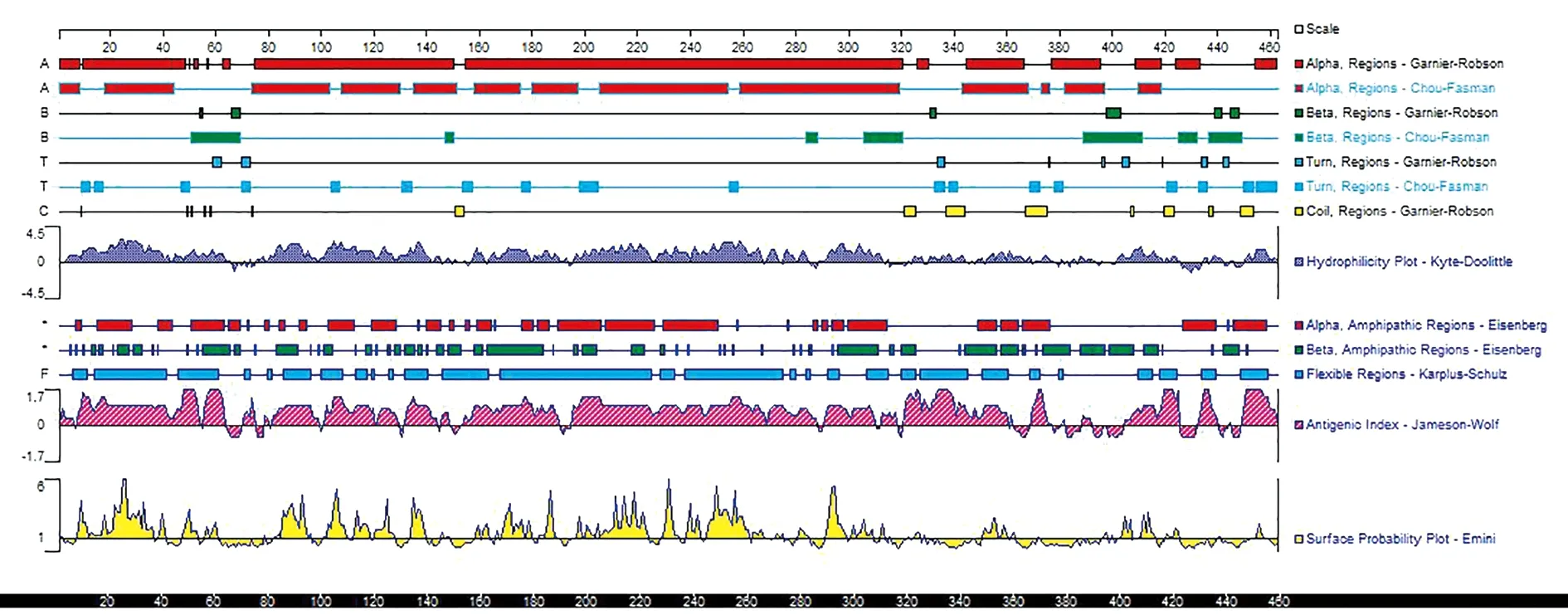
圖3 DNAstar分析EgA31-EgG1Y162蛋白二級結構Fig.3 DNAstar analysis protein secondary structure
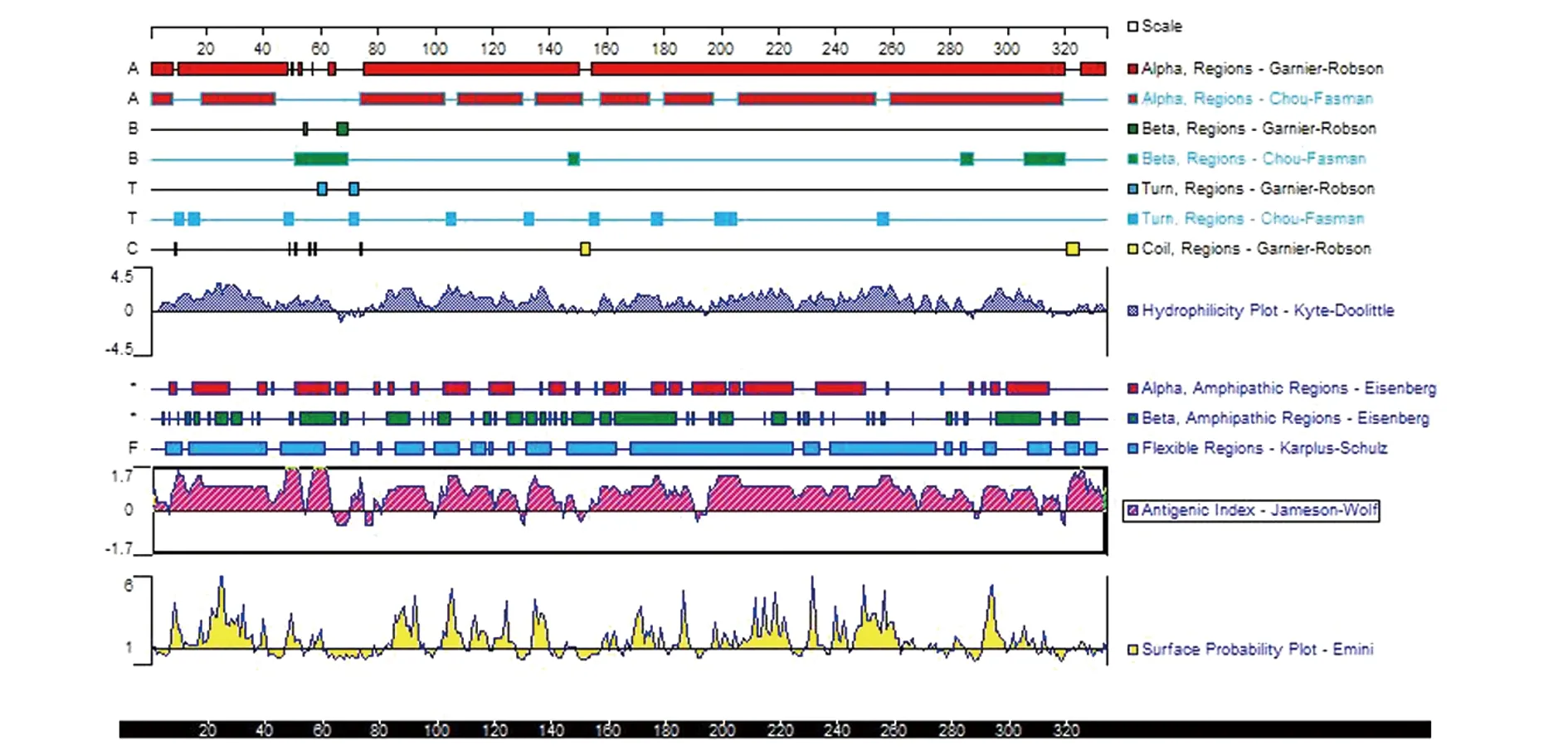
圖4 DNAstar分析EgA31蛋白二級結構Fig.4 DNAstar analysis of EgA31 protein second-ary structure
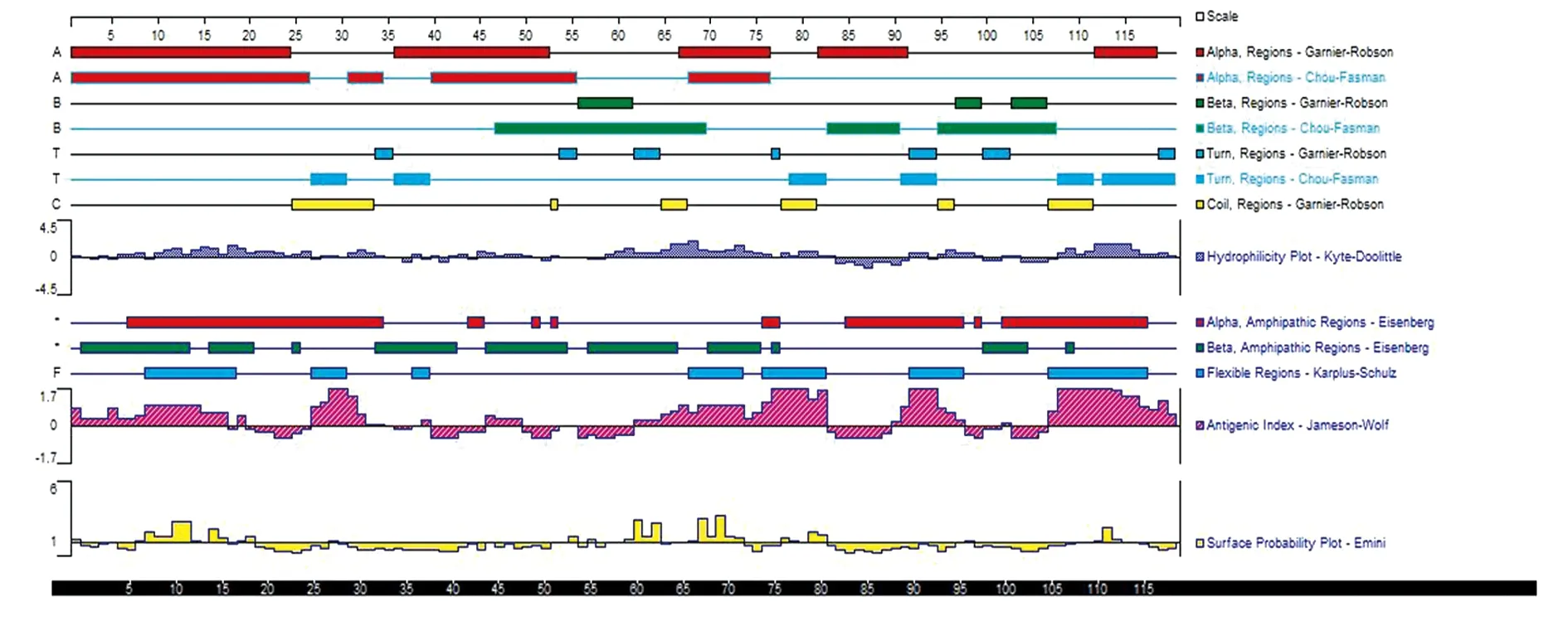
圖5 DNAstar分析EgG1Y162蛋白二級結構Fig.5 DNAstar analysis of EgG1Y16 protein protein secondary structure
2.5EgA31-EgG1y162 DNA序列優化前后對比結果 運用DNAMAN軟件Blast模板比較EgA31-EgG1Y162 DNA序列在優化前后的變化。優化前后兩DNA序列的一致性為80.13%(圖6)。
未優化序列的結果:SEQ未優化序列:1 389 bp;Composition 553 A;223 C;297 G;316 T;0 OTHERPercentage:39.8% A;16.1% C;21.4% G;22.8% T;0.0%OTHER Molecular Weight(kD):ssDNA:431.31 dsDNA:856.14。
優化后序列的結果:SEQ 優化列.txt:1 389 bp;Composition 463 A;335 C;343 G;248 T; 0 OTHERPercentage:33.3% A;24.1% C;24.7% G;17.9% T;0.0%OTHER′Molecular Weight(kD):ssDNA:429.97 dsDNA:856.30。從序列比對的結果分析,優化之后的DNA序列的ACG三種堿基比例改變,其中堿基A在優化后較優化前比例減少了6.5%,堿基G減少了4.9%,堿基C的含量增加了3.3%。

圖6 DNA序列的對比結果Fig.6 Comparison results of DNA sequenceNote:Dark blue is the same base of two sequences,and the rest are different base parts.
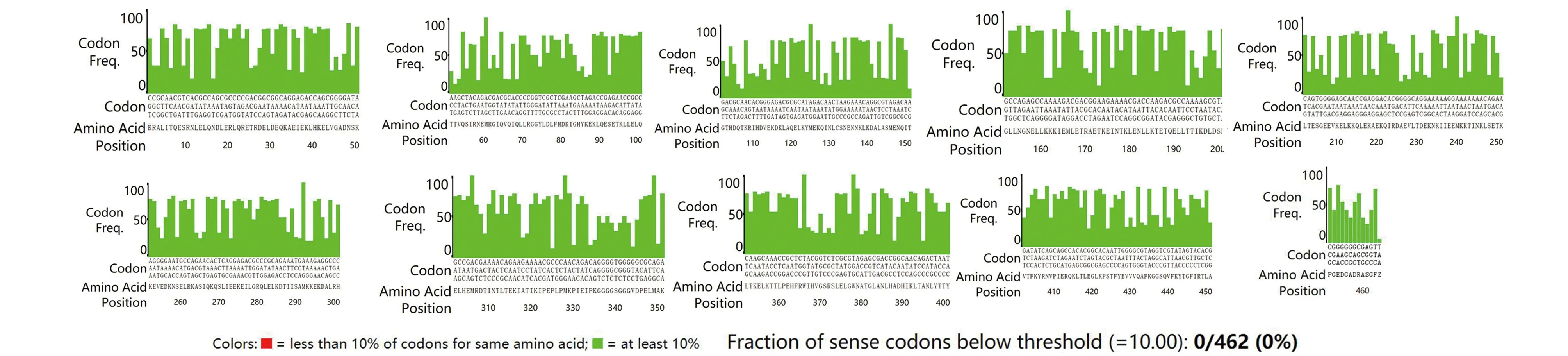
圖7 優化序列密碼子分析結果Fig.7 Optimization sequence codon analysis resultsNote:Codon Adaptation Index(CAI)is 1.
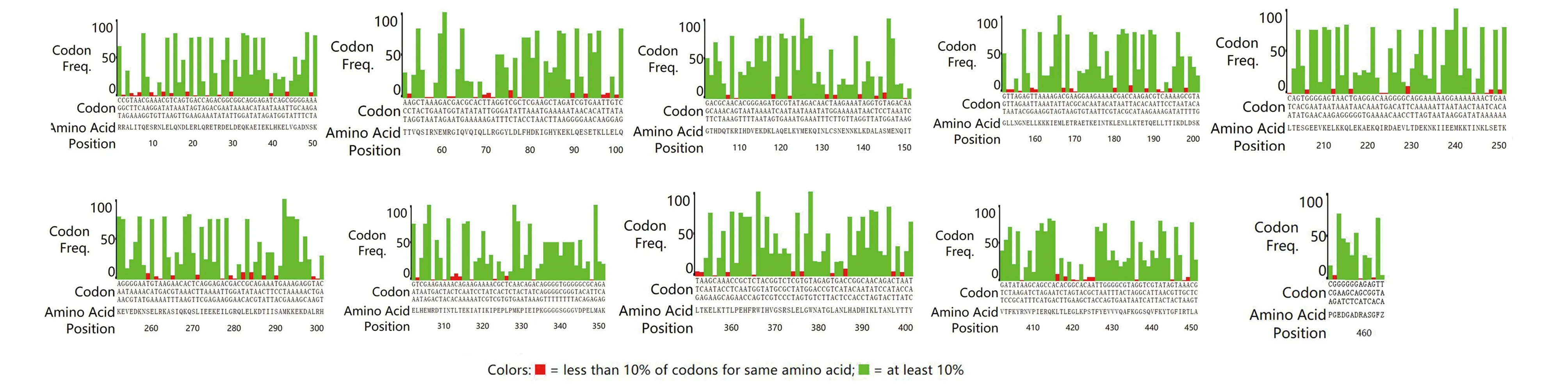
圖8 未優化序列的分析結果Fig.8 Analysis results of unoptimized sequencesNote:Red indicates a low utilization codon CAI<1.

圖9 左SYFPEITHI分析預測T表位,前十組右IEDB分析預測T表位前十Fig.9 Left SYFPEITHI analysis predicts T epitopes,top ten group Right IEDB analysis predicts top ten groups of T epitopesNote:On the left,the higher the score is the easier to form the epitope map.On the right,the lower the percentage is the easier to form an B epitope
表1 EgA31-EgG1y162抗原T和B細胞表位
Tab.1 EgA31-EgG1y162 antigen T and B cell epitopes
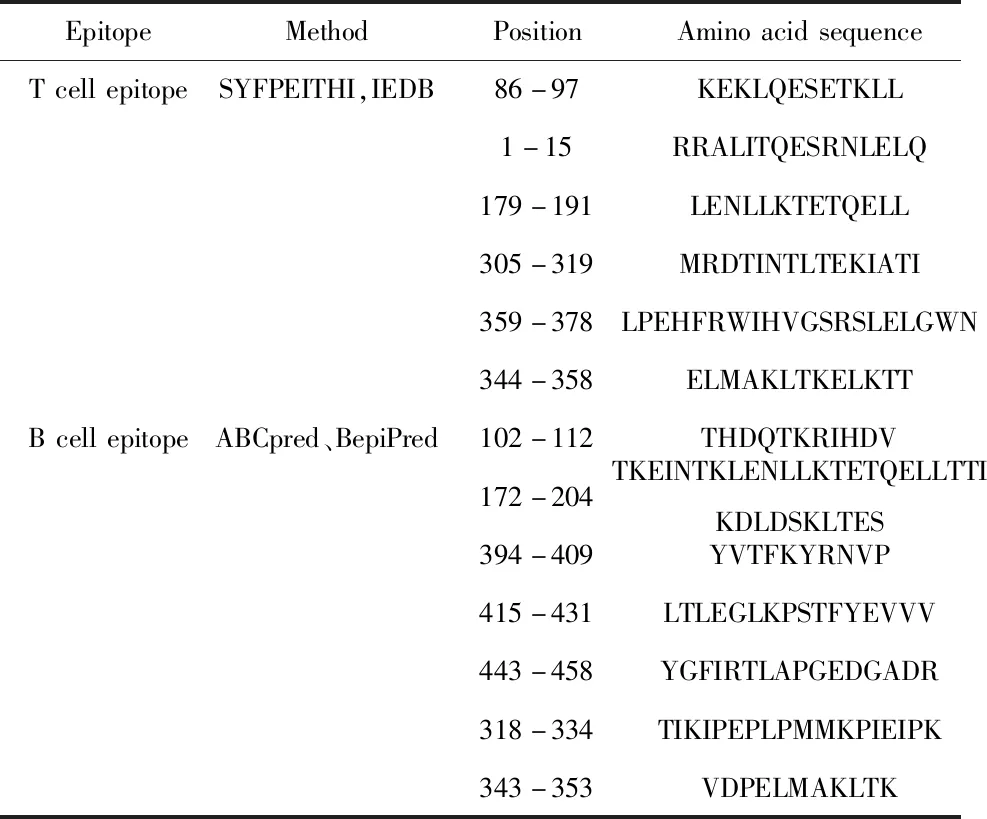
EpitopeMethodPositionAminoacidsequenceTcellepitopeSYFPEITHI,IEDB86-97KEKLQESETKLL1-15RRALITQESRNLELQ179-191LENLLKTETQELL305-319MRDTINTLTEKIATI359-378LPEHFRWIHVGSRSLELGWN344-358ELMAKLTKELKTTBcellepitopeABCpred、BepiPred102-112THDQTKRIHDV172-204TKEINTKLENLLKTETQELLTTIKDLDSKLTES394-409YVTFKYRNVP415-431LTLEGLKPSTFYEVVV443-458YGFIRTLAPGEDGADR318-334TIKIPEPLPMMKPIEIPK343-353VDPELMAKLTK
2.6序列優化前后密碼子的適應指數(CAI )分析結果 利用大腸桿菌對密碼子應用的偏好性,運用在線軟件E.coli Codon Usage Analyzer 2.1分析優化序列中密碼子適應指數CAI為1,且優化序列的密碼子中不含利用率低的密碼子(圖7)。未優化序列密碼子的分析結果(圖8),未優化的序列中含有利用率低的密碼子,數量為121個,密碼子適應指數與優化的序列相比小于優化序列的CAI。
2.7融合抗原EgA31-EgG1Y162的表位分析結果 運用SYFPEITHI軟件和 IEDB 軟件選取前十組分值較高容易形成表位的氨基酸區域(圖9)綜合分析預測聯合抗原EgA31-EgG1Y162蛋白T細胞表位優勢表位(1~15、86~97、179~191、359~388、305~319、344~358)。運用ABCpred、BepiPred軟件分析預測EgA31-EgG1Y162蛋白的B細胞表位,選擇分值較高的前十組,綜合分析預測易形成B細胞抗原表位的氨基酸區域(102~112、172~204、318~334、343~353、394~409、415~431、443~458)。表1預測分析出優化EgA31-EgG1y162的抗原表位氨基酸序列,與前期課題組單獨分析預測EgA31抗原的T細胞表位(201~214、286~297、379~391、507~519),B細胞抗原表位(302~312、372~404、518~534),EgG1Y162抗原B細胞表位(9~17、63~73、77~82、109~117),T細胞表位(6~14、17~36、63~83、106~116)相比,兩個序列用連接后所形成的表位氨基酸區域包括了單獨的EgA31及EgG1Y162蛋白分析預測的T、B細胞表位,其抗原表位未受到影響,聯合的抗原表位的氨基酸區域稍稍大于單獨分析的表位區域。
3 討論
目前人們對抗原誘導機體免疫反應的機制有了更加深入的了解,不斷涌現出新型重組疫苗,如基因重組亞單位疫苗、重組活載體疫苗、重組缺失疫苗、重組蛋白疫苗,基因疫苗等[19,20]。在免疫學技術的發展中,人們克隆表達和分離純化完整的蛋白抗原,并利用完整的抗原來獲得相對應的抗體,這種方法比較復雜,需浪費大量的人力、物力和財力。而表位疫苗的研究則避免了這一問題,是當前分子疫苗研究的熱點課題[21],因此我們分析預測出免疫原性強的抗原表位,再將其聯合起來,從而使疫苗獲得較好免疫保護作用[22]。
本研究將融合抗原序列進行優化構建,誘導表達及鑒定顯示抗原優化后的融合蛋白表達量高,通過生物信息學軟件對優化后的融合抗原序列EgA31-EgG1Y162進行分析研究,蛋白分子質量為52926.58 Daltons;發現該蛋白的原子組成為C4072 h6757N1389O1638S335,理論PI值為6.51,歸為不穩定性蛋白且親水性蛋白,蛋白的親水性指數越大則形成表位的可能性越大。蛋白質二級結構主要的化學鍵是氫鍵,其鍵能較高,從而使蛋白的結構穩定不易形成表位,分析該蛋白二級結構發現α-螺旋,β-折疊比例較高,此結構中含有氫鍵較多且位于蛋白內側,而β-轉角和無規卷曲大部分位于蛋白質的外側與配體容易結合形成抗原表位[23],因此具有潛在的抗原表位優勢。
近年來,蛋白融合技術已得到廣泛的利用,其前提是進行基因融合。本研究linker序列是一段小分子短肽(GGGGSGGG)的柔性氨基酸,其中甘氨酸結構簡單不易折疊,對蛋白的空間構象影響小,由于它自身良好的柔韌性且伸展性好的特點,可使兩端序列的柔性不受影響,保持2種蛋白的正確折疊[24]。通過對融合蛋白和單獨的蛋白比較分析,融合蛋白的β-轉角區域、無規則卷曲區域指數增加,且融合蛋白的骨架柔韌性、抗原表面可及性、抗原指數也有所增加,指數增加最明顯的區域是linker序列連接的兩側的氨基酸殘基區域。這些指數的增加更有利于抗原表位的形成,應用軟件對EgA31-EgG1Y162抗原表位預測分析出融合蛋白的抗原表位包括6個T表位和7個B表位,與單獨的EgA31和EgG1Y162抗原表位分析比較,抗原表位并未發生改變。linker序列作為一段柔性短肽,不僅未對兩端蛋白的正常折疊產生影響,而且增加了linker 序列兩側抗原表位的形成,其B表位(318-334)TIKIPEPLPMMKPIEIPK,(343-353)VDPELMAKLTK在linker序列兩側。Linker序列作為融合蛋白形式發揮作用,從而不僅保證了融合基因所表達蛋白的完整性并且使功能蛋白較好的穩定性和生物活性,可促進融合蛋白的可溶性表達[25]。
研究發現[26],不同宿主的蛋白表達對編碼氨基酸的遺傳密碼子有偏好性,編碼氨基酸時密碼子使用頻率并不完全相同的現象被稱為密碼子偏好性。由于密碼子具有兼并性的特點,編碼同一種氨基酸的不同密碼子稱同義密碼子[25]。經研究大腸桿菌表達菌株偏好C/G結尾的密碼子,其常用偏愛的幾種密碼子中,以A堿基開頭,以C堿基結尾的密碼子較多,因此我們通過分析序列在優化前后個別堿基含量發生改變。密碼子的偏愛對外源性蛋白的表達有重要的影響,可以提高外源基因在宿主細胞內的蛋白表達[27],我們對誘導出的蛋白進行鑒定發現融合蛋白有效表達。通過進一步運用E.coli Codon Usage Analyzer 2.1分析融合抗原序列優化前后密碼子的適應指數(CAI)[28],其程度范圍在0~1,數值越大說明目的基因密碼子使用頻率與宿主中的差異越小,則反應外源基因在宿主細胞內蛋白表達量越高。通過密碼子適應指數分析可知優化序列中CAI的值為1,不含利用率低的密碼子,使優化序列的基因在宿主細胞中誘導出表達量高的蛋白。未優化的序列中則含有多個宿主細胞利用率低的密碼子,不能被宿主細胞高效利用,而影響目的基因的表達。通過抗原序列優化,將目的基因中宿主細胞利用低的密碼子通過堿基替換為宿主細胞所偏愛的密碼子,以此提高目的蛋白表達水平[29]。
綜上所述,本研究融合了細粒棘球絳蟲不同階段的候選疫苗抗原EgA31-EgG1Y162,經過序列優化后,能提高其在體外誘導表達,并且運用生物信息學軟件分析發現該優化序列的融合蛋白具有許多優勢,這為進一步構建保護性融合多價蛋白疫苗防控包蟲感染奠定了實驗基礎,為將來深入開展細粒棘球絳蟲終末宿主犬的多價表位疫苗研究提供新思路。

