提高α-葡萄糖苷酶抑制率的乳酸菌胞外多糖分階段控溫發酵工藝優化
吳明霞,鄭昇陽
(寧德師范學院生命科學學院,福建寧德352100)
糖尿病已成為繼癌癥和心腦血管疾病之后嚴重威脅人類健康的第三大疾病[1],目前治療藥物因效果不佳且長期使用對人體產生的副作用而其使用受到限制。因此,研發天然安全的降血糖藥物具有重要意義。α-葡萄糖苷酶抑制劑已成為安全降血糖的一級藥物得到廣泛推廣[2]。
乳酸菌(lactic acid bacteria,LAB)是一類發酵糖類物質產生乳酸的無芽孢革蘭氏陽性菌總稱,至少含有 23 個菌屬,共 200 多種[3],有多重功能性[4-6]得到證實。測定乳酸菌發酵上清液中α-葡萄糖苷酶抑制力可作為篩選潛在降血糖菌株的可靠依據[7-8]。有研究證明:最適益生菌菌株是來自宿主胃腸道,才能在宿主胃腸道的胃酸、膽汁等一系列不良環境中存活下來,從而發揮其最佳益生作用[9]。
胞外多糖(exopolysaccharides,EPS)是乳酸菌生長代謝過程中分泌于細胞壁外滲到培養基的一類多糖類化合物,是乳酸菌的次級代謝產物[10],具有多種生物活性[11-13]。胞外多糖在體外具有抑制α-葡萄糖苷酶的活力[14],具有潛在降血糖能力。
關于乳酸菌胞外多糖降血糖能力的研究相對較少[15]。目前未見變溫優化胞外多糖和α-葡萄糖苷酶抑制活性工藝的研究。本文考慮到最適生長溫度與最適代謝合成溫度往往不一致[16],采用分階段控制溫度策略提高胞外多糖產量和α-葡萄糖苷酶抑制力,第一階段選取人源乳酸菌最適生長溫度,變溫時間選取胞外多糖趨于穩定時間,第二階段采用最適胞外多糖合成溫度能高效提高胞外多糖濃度產量和α-葡萄糖苷酶抑制率,為降血糖藥物的應用和大規模生產提供理論依據。
1 材料與方法
1.1 材料與設備
1.1.1 材料與試劑
鼠李糖乳桿菌:來源于健康人體糞便,寧德師范學院實驗室保藏。
葡萄糖、蔗糖、蛋白胨、酵母膏、乙酸鈉、CaCl2、MgCl2、無水MgSO4、MnSO4·7H2O、MnSO4·H2O、磷酸氫二胺(均為分析純):福建科翰實驗儀器貿易有限公司;磷酸氫二銨(分析純):北京益利精細化學品有限公司;牛肉膏:北京奧博星生物技術責任有限公司;KH2PO4、吐溫-80(分析純):北京益利精細化學品有限公司;對硝基苯基-α-D-吡喃葡萄糖苷、α-葡萄糖苷酶(生物試劑):美國 Sigma 公司。
1.1.2 儀器
GR60DR 型高壓滅菌鍋:致微(廈門)儀器有限公司;DNP-9162 型恒溫培養箱、DHG-9123A 型電熱恒溫鼓風干燥箱:上海精宏試驗設備有限公司;MC 型電子天平:奧豪斯儀器常州有限公司;T6 型紫外可見分光光度計:北京普析通用有限責任公司;ZHJHC1109C 型超凈工作臺:上海智誠科技有限公司。
1.2 培養基配制
MRS 固體培養基:蛋白胨10 g,牛肉膏10 g,酵母膏5 g,檸檬酸二胺2 g,葡萄糖5 g,蔗糖50 g,吐溫-80 1 mL,乙酸鈉 5 g,磷酸氫二鉀 2 g,MgSO4·7H2O 0.58 g,MnSO4·H2O 0.25 g,磷酸氫二胺 2 g,瓊脂 18 g 115 ℃滅菌20 min 備用。
MRS 液體培養基:蛋白胨10 g,牛肉膏10 g,葡萄糖20 g,乙酸鈉2 g,磷酸氫二鉀2 g,磷酸氫二胺2 g,乙酸鈉 2 g,MgSO4·7H2O 0.58 g,MnSO4·H2O 0.25 g,吐溫 801 mL,蒸餾水 1 000 mL,115 ℃滅菌 20 min 備用。
1.3 培養方法
1.3.1 工藝流程
鼠李糖乳桿菌→斜面培養→種子培養→發酵培養→發酵液抽濾→濃縮→離心→沉淀→烘干→胞外多糖→測定α-葡萄糖苷酶抑制活力
1.3.2 培養方法
1.3.2.1 斜面培養
取保藏菌種在試管MRS 斜面培養基中劃線培養,37 ℃恒溫培養 12 h,在 3 500 r/min、4 ℃條件下離心10 min,用5 mL 0.85 %的生理鹽水洗滌沉淀菌種2次~3 次后制成發酵劑備用(發酵種子液的菌濃度達105CFU/mL)。
1.3.2.2 種子培養
將5 mL 菌懸液接種于裝有40 mL 液體培養基的100 mL 三角瓶中,37 ℃擴大培養12 h 進行活化種子培養。
1.3.2.3 恒溫發酵培養
將種子培養液接種于120 mL 液體培養基1 000 mL三角瓶中,分別在 31、33、35、37、39、41 ℃恒溫培養60 h,每隔6 h 測定發酵液OD600nm、胞外多糖濃度和α-葡萄糖苷酶抑制率。
1.3.2.4 分階段控制溫度發酵培養
將種子培養液接種于液體培養基培養60 h,第一階段溫度分別為36、37、38 ℃,變溫時間分別為46、48、50 h,第二階段溫度分別為 38、39、40 ℃,每隔 6 h測定α-葡萄糖苷酶抑制率。
1.4 單因素試驗設計
1.4.1 第一階段溫度對菌體生長的影響
將種子培養液接種于120 mL 液體培養基的1 000 mL 三角瓶中,分別在 31、33、35、37、39、41 ℃恒溫培養60 h,每隔6 h 測定發酵溫度對發酵液菌體生長的影響,確定乳酸菌最適生長溫度,即分階段控制溫度策略第一階段溫度。
1.4.2 變溫時間對乳酸菌胞外多糖產量的影響
將種子培養液接種于120 mL 液體培養基的1 000 mL 三角瓶中,分別測定 31、33、35、37、39、41 ℃在0、6、12、18、24、30、36、42、48、54、60 h 對發酵液胞外多糖產量的影響,確定分階段控制溫度策略變溫時間。
1.4.3 第二階段溫度對α-葡萄糖苷酶抑制率的影響
將種子培養液接種于入120 mL 液體培養基的1 000 mL 三角瓶中,分別在 31、33、35、37、39、41 ℃恒溫培養60 h,每隔6 h 測定發酵溫度對發酵液α-葡萄糖苷酶抑制率的影響,確定抑制α-葡萄糖苷酶活力的最佳溫度,即分階段控制溫度策略第二階段溫度。
1.5 響應面試驗設計
選取第一階段溫度、變溫時間、第二階段溫度3 個因素,在單因素試驗的基礎上,按照Box-Behnken 中心組合原理,使用Design-Expert 8.0.6 軟件進行響應面優化試驗設計,以α-葡萄糖苷酶抑制率為響應值進行三因素三水平的響應面優化試驗。因素水平編碼表見表1。

表1 因素水平編碼表Table 1 Table of factors and levels
1.6 發酵溫度對分階段控制溫度α-葡萄糖苷酶抑制率的影響
將種子培養液接種于入120 mL 液體培養基的1 000 mL 三角瓶中,在第一階段溫度37 ℃,變溫時間50 h,第二階段溫度40 ℃時培養72 h,每隔6 h 測定α-葡萄糖苷酶抑制率,確定分階段控制溫度最佳發酵時間。
1.7 測定指標與方法
1.7.1 生長曲線的測定
將經過3 次傳代培養8 h 至對數期的新鮮培養物按0.1%(體積分數)接種量接入MRS 培養基中,每隔6 h 取樣測定 OD600nm值[17]。
1.7.2 胞外多糖濃度的測定
標準曲線的制作:準確稱取葡萄糖20 mg 于500 mL容量瓶中,加水至刻度,分別吸取 0.4、0.6、0.8、1.0、1.12、1.4、1.6、1.8,并以蒸餾水補至 2.0 mL,然后加入 6%苯酚1.0 mL 及濃硫酸5.0 mL,搖勻冷卻,室溫25 ℃放置20 min 后于490 nm 測定吸光度。橫坐標為葡萄糖濃度,縱坐標為吸光度值,得標準曲線。
苯酚-硫酸法:取2 mL 發酵液加入1 mL5%的苯酚溶液,5 mL95%的濃硫酸,靜置20 min,高速振蕩搖勻,靜置 20 min 至冷卻,測定 OD490nm值[18]。
1.7.3 α-葡萄糖苷酶抑制率的測定
取 25 μL 發酵上清液添加 50 μL pH 6.8,濃度0.1 mol/L 磷酸鹽緩沖溶液,再加入50 μL 20 mmol/L的對硝基苯基-α-D-吡喃葡萄糖苷溶液,將混合物于37 ℃恒溫箱放置10 min,加入 30 μLα-葡萄糖苷酶溶液20 U/mL 繼續反應20 min,加入50 μL 濃度為1 mol/L碳酸鹽溶液作為反應終止液,將反應液于405 nm 處測定吸光度值,吸光度值與對硝基苯酚的游離量成正比,采用0.1 mol/L 磷酸鹽溶液作為空白對照[19],以阿卡波糖作陽性對照[20]。對α-葡萄糖苷酶的抑制率按式(1)計算如下:
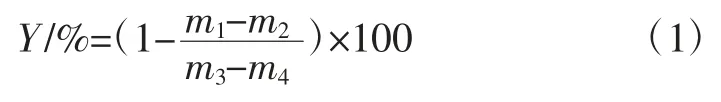
式中:Y 為 α-葡萄糖苷酶抑制率,%;m1為樣品組溶液濃度,mmol/L;m2為樣品空白組溶液濃度,mmol/L;m3為對照組溶液濃度,mmol/L;m4為空白組溶液濃度,mmol/L。
1.8 數據分析
本文采用Design Expert 8.0.6 對數據進行處理。
2 結果與分析
2.1 標準曲線
以葡萄糖濃度為標準制作標準曲線對胞外多糖濃度進行標定,見圖1。
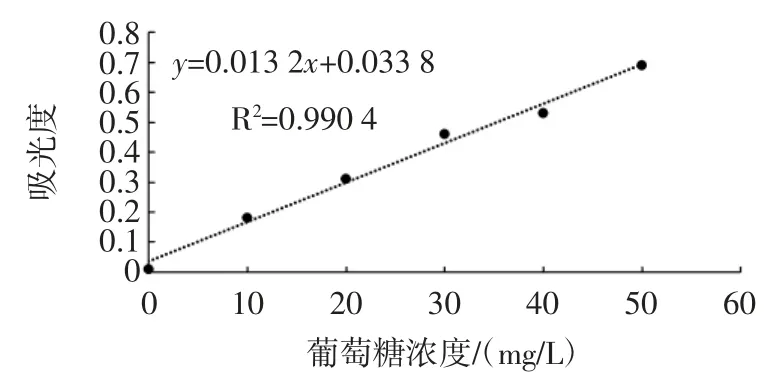
圖1 葡萄糖濃度標準曲線Fig.1 Standard curve of glucose concentration
2.2 分階段控制溫度第一階段溫度的影響
溫度是影響微生物生長繁殖最重要的因素之一。溫度對菌體生長的影響見圖2。
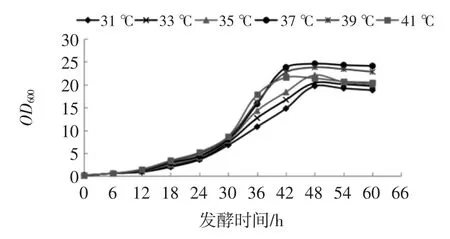
圖2 不同溫度的菌體生長曲線Fig.2 Growth gurves at different temperature
由圖2 可知,發酵溫度37 ℃培養54 h 時OD600nm最大。有研究表明,菌體生長與胞外多糖的合成為部分偶聯型[21],因此在提高胞外多糖產量時,必須同時考慮菌種生長特性[22]。即分階段控制溫度策略第一階段最佳溫度為37 ℃。
2.3 變溫時間的確定
胞外多糖產量與產糖菌株生長環境溫度、pH 值及蛋白含量組分有關[23],不同溫度對胞外多糖的影響見圖3。
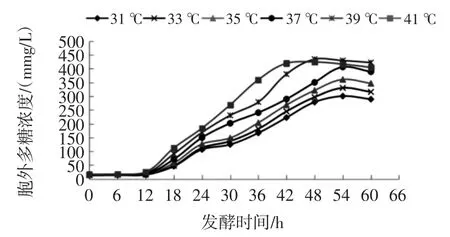
圖3 不同溫度對胞外多糖的影響Fig.3 Effects of different temperatures on extracellular polysaccharides
當溫度較低時,胞外多糖濃度較低,這可能是因為低溫度使合成胞外多糖的類異戊二烯脂質載體發生鈍化作用,使代謝產物胞外多糖含量降低[24];當溫度39 ℃培養42 h 時胞外多糖量最大;當溫度繼續增加時,微生物因生長代謝過快分泌能夠降解多糖的酶而使其產量開始下降[25]。因此,胞外多糖的最佳發酵溫度 39 ℃。
由圖3 可知,當發酵溫度39 ℃時48 h 胞外多糖產量趨于穩定。這可能是因為發酵中期是細胞中單糖聚合成多糖的過程,當發酵后期菌體分泌胞外多糖量趨于穩定[18]。因此,分階段控制溫度策略的最佳變溫時間為48 h。
2.4 第二階段溫度的確定
吳學強[25]研究發現α-葡萄糖苷酶的抑制劑的抑制機理與胞外多糖對α-葡萄糖苷酶產生競爭性抑制的作用有關。發酵溫度對α-葡萄糖苷酶抑制率的影響見圖4。

圖4 不同溫度對α-葡萄糖苷酶抑制率的影響Fig.4 Effect of different temperatures on inhibition rate of alphaglucosidase
由圖4 可知,當溫度較低時,α-葡萄糖苷酶抑制率較低,這可能是與胞外多糖對α-葡萄糖苷酶具有抑制作用的活性物質分泌出細胞外較少有關[15]。在溫度39 ℃發酵54 hα-葡萄糖苷酶抑制率最大,這可能是因為空間構象有利于酶解活性產物的生成而產生反饋抑制[26],則α-葡萄糖苷酶抑制率增加;當發酵溫度繼續增加,α-葡萄糖苷酶抑制率下降。因此,分階段控制溫度策略的第二階段最佳溫度為39 ℃。
2.5 響應面法確定分階段控制溫度
根據試驗結果,選取第一階段溫度、變溫時間、第二階段溫度為自變量,采用中心組合設計進行三因素三水平試驗,以α-葡萄糖苷酶抑制率為響應值,進行響應面分析,試驗設計及結果見表2。
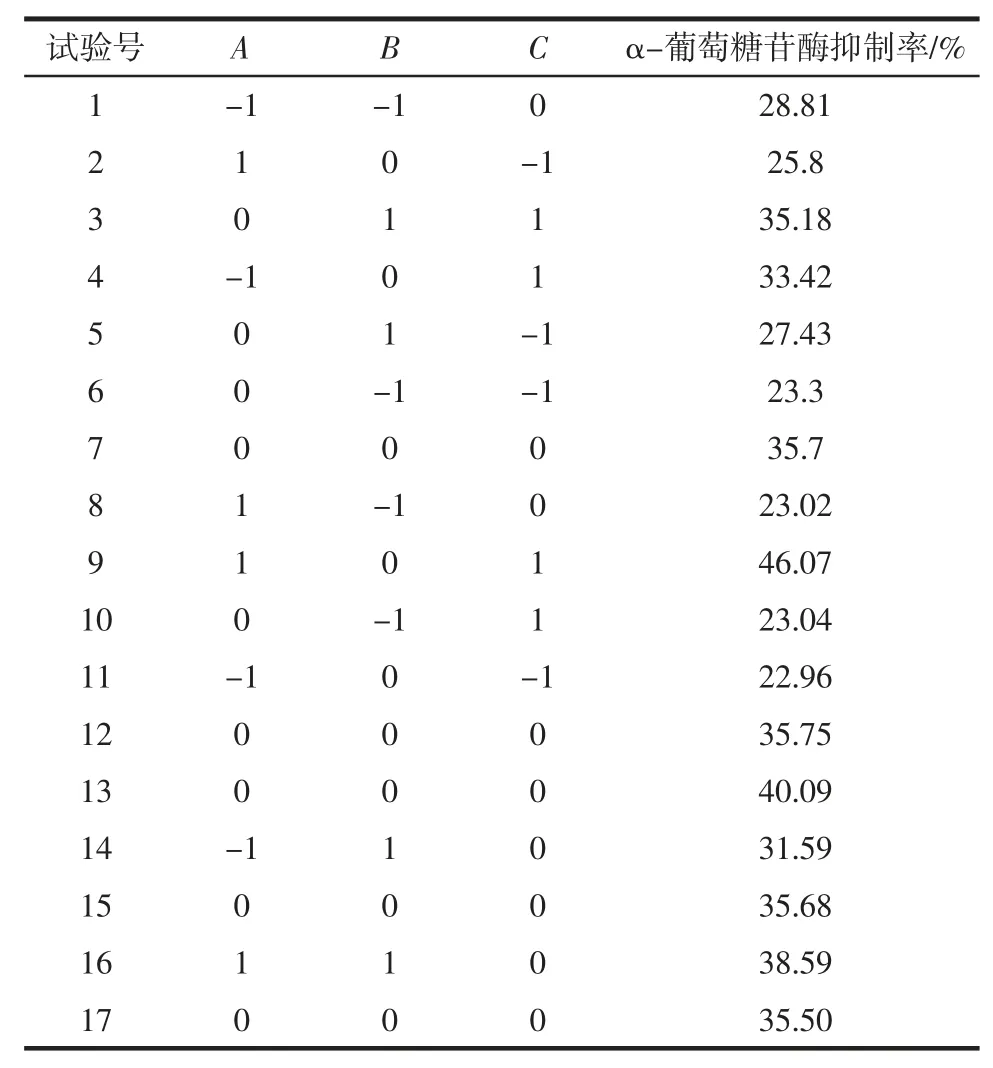
表2 響應面試驗結果Table 2 Results of response surface methodology
2.6 響應面分析和優化
采用Design-Expert 8.0.6 軟件對表2 試驗數據進行顯著性分析,建立提取模型,分析結果見表3。
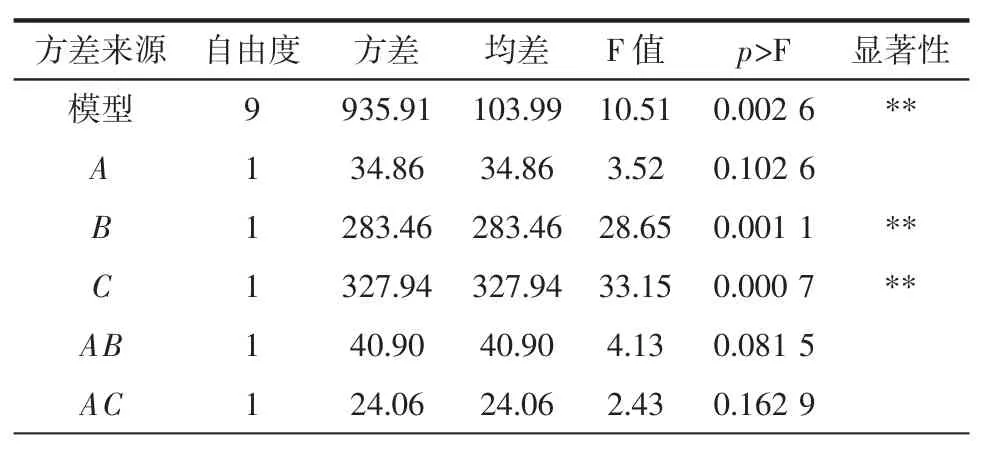
表3 回歸模型方差分析及顯著性檢驗Table 3 Analysis of variance for the regression model
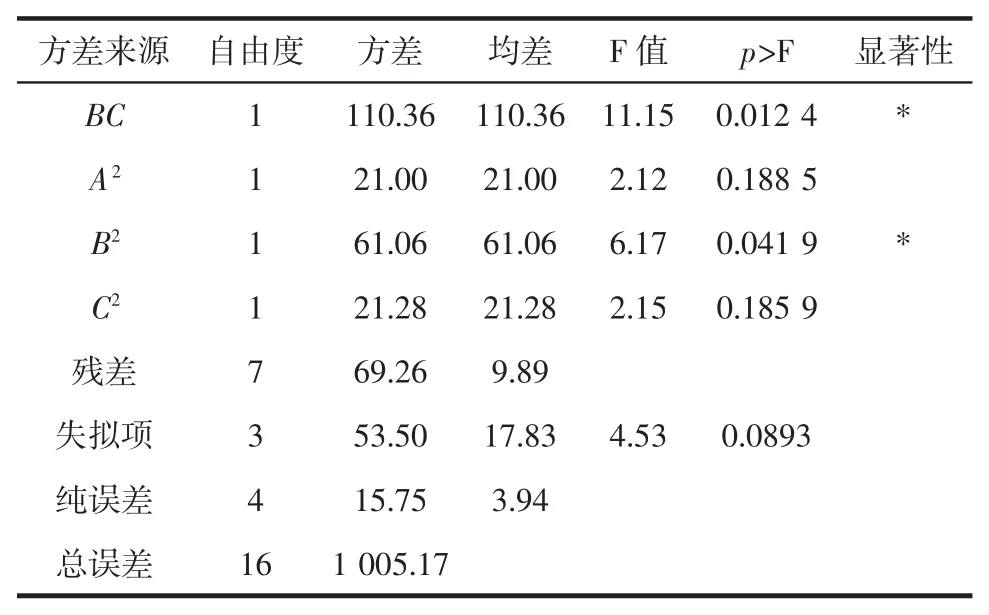
續表3 回歸模型方差分析及顯著性檢驗Continue table 3 Analysis of variance for the regression model
由表3 可知,回歸模型當p>F 值小于0.05 時,即表示該指標顯著;當p>F 值小于0.01 時,即表示該指標極顯著。因此,A 不顯著,B、C 極顯著;二次項 A2、C2不顯著,B2顯著;在交互項中,AB、AC 不顯著,BC 對α-葡萄糖苷酶抑制率影響達到顯著水平;失擬項不顯著,R2=0.931 1,R2Ad=0.842 5,這表明模型可以較好地解釋試驗分階段控制溫度對α-葡萄糖苷酶抑制率影響的變化。通過比較回歸方程中的一次項系數絕對值的大小,可判斷因素影響的大小關系。因此各個因素對α-葡萄糖苷酶抑制率的影響程度依次為:第二階段溫度>變溫時間>第一階段溫度。各因素經二次多項式回歸擬合后,得到第一階段溫度、變溫時間、第二階段溫度3 個因素對α-葡萄糖苷酶影響的二次多項回歸方程為:
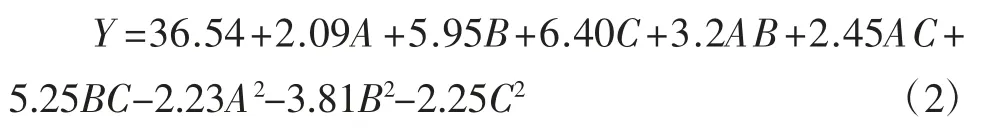
由以上分析可知,各因素對α-葡萄糖苷酶抑制性影響復雜,并非簡單的線性關系,且當第一階段37 ℃,變溫時間50 h,第二階段溫度40 ℃時,α-葡萄糖苷酶抑制率最大為53.60%。因此,采取分階段控制溫度策略提高α-葡萄糖苷酶抑制率是可行的。
2.7 響應面圖和等高線圖分析
從響應面曲線和等高線分析圖可得到最佳參數及各參數之間的相互作用,各因素及其對α-葡萄糖苷酶抑制的響應面及等高線圖見圖5。
由式2 可知,A、B、C 二次項系數均為負值。表示方程的拋物面開口向下有極大值點;由圖5 可知,從響應面曲線和等高線分析圖可得到最佳參數及各參數之間的相互作用:A、B、C 特征值響應面圖為山丘形曲面,即有極大值,二者結果相同。
2.8 驗證試驗
為驗證試驗結果,進行驗證試驗。當第一階段溫度37 ℃,變溫時間50 h,第二階段溫度40 ℃發酵66 h時α-葡萄糖苷酶抑制率為55.78%,與理論預測值誤差為4.06%。表明該結果可靠的。
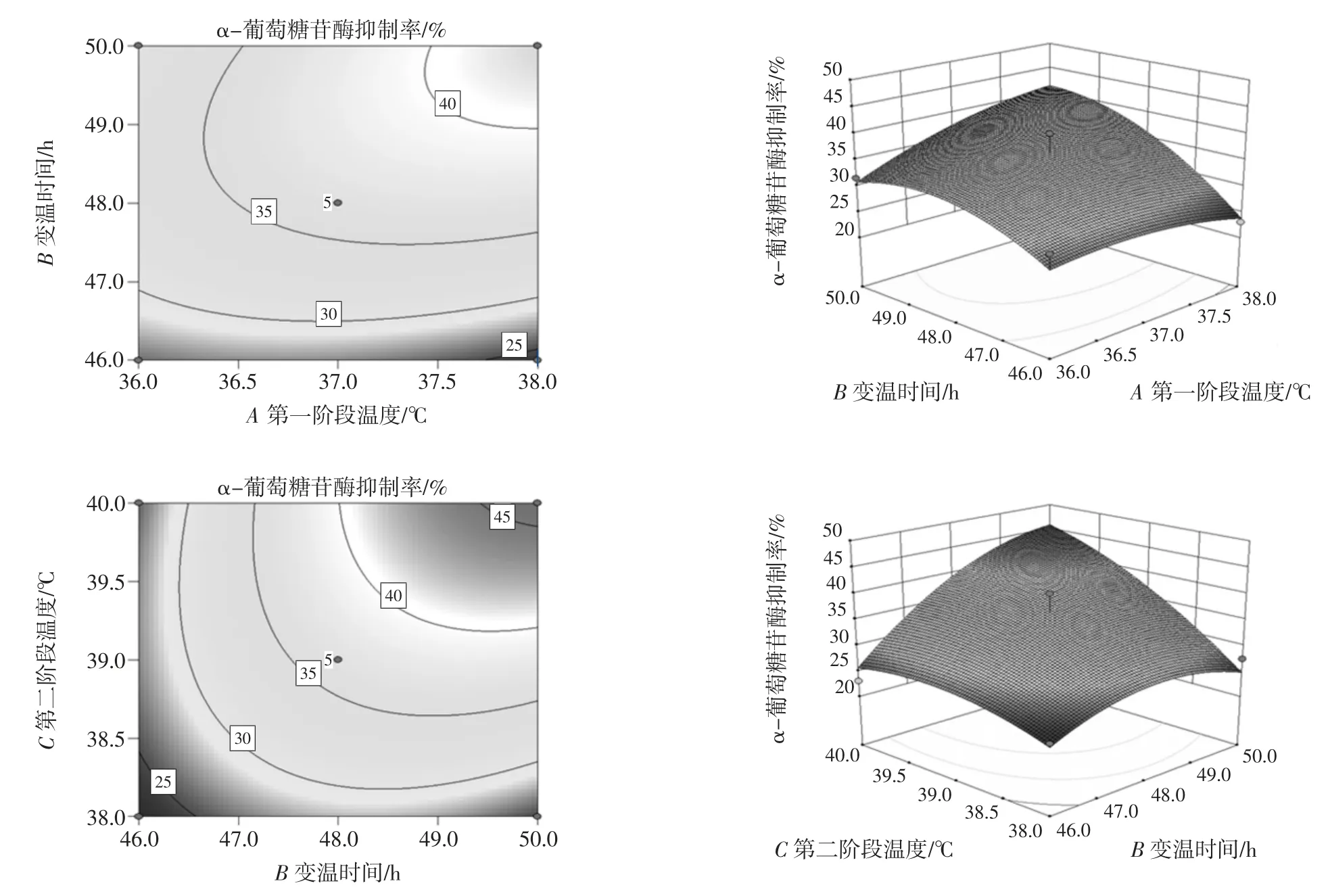
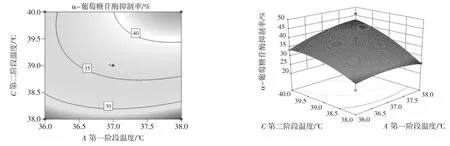
圖5 各因素及其交互作用對α-葡萄糖苷酶抑制率影響的等高線及響應面曲線圖Fig.5 Contour plot and response surface plot of the effects of various factors and interactions on the inhibition rate of alpha-glucosidase
2.9 分階段控制溫度工藝發酵時間的優化
為優化分階段控制溫度工藝發酵時間,當第一階段溫度37 ℃,變溫時間50 h,第二階段溫度40 ℃時研究發酵時間對α-葡萄糖抑制率的影響,見圖6。
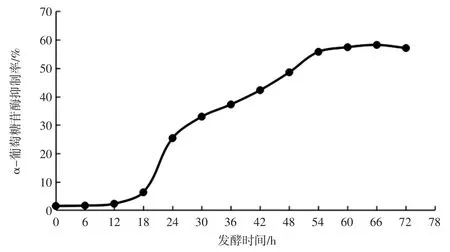
圖6 分階段控制溫度工藝發酵時間的優化Fig.6 Optimization of fermentation time in stage-controlled temperature process
由圖6 可知,分階段控制溫度能顯著延長乳酸菌穩定期,穩定期為54 h~66 h。當第一階段溫度37 ℃,變溫時間50 h,第二階段溫度40 ℃發酵66 h 時,α-葡萄糖苷酶抑制率為58.21%,即分階段控制溫度最適宜發酵時間為66 h。
3 結論
采取分階段控制溫度即當第一階段溫度37 ℃,變溫時間50 h,第二階段溫度40 ℃發酵66 h 時,α-葡萄糖苷酶抑制率為58.21%,結果表明,分階段控制溫度發酵乳酸菌能顯著提高α-葡萄糖苷酶抑制率,這將對降血糖藥物的開發提供參考意義。

