馬鈴薯多酚氧化酶新成員StuPPO9基因的分離鑒定及其過表達煙草遺傳轉化
張金輝,池明,*,Yu Xiang,王遠宏,李二峰,劉慧芹,馬睿
(1.天津農學院,天津300384;2.加拿大農業與農業食品部太平洋食品研究中心,薩莫蘭不列顛哥倫比亞省V0H 1Z0,加拿大)
馬鈴薯(Solanum tuberosum L.)屬茄科一年生草本植物,塊莖可供食用,是全球第四大重要的糧食作物,僅次于小麥、稻谷和玉米。馬鈴薯又稱地蛋、土豆、洋山芋等,茄科植物的塊莖,與小麥、稻谷、玉米、高粱并成為世界5 大作物。馬鈴薯主要生產國有中國、俄羅斯、印度、烏克蘭、美國等。中國是世界馬鈴薯總產最多的國家。2015 年,中國啟動馬鈴薯主糧化戰略,推進把馬鈴薯加工成饅頭、面條、米粉等主食,馬鈴薯成為稻米、小麥、玉米外的又一主糧[1]。
多酚氧化酶(polyphenol oxidase,PPO)是動植物和真菌中普遍存在的一類含銅氧化酶,PPO 催化內源酚類物質氧化為醌,醌再經過聚合形成色素,是引起馬鈴薯褐變的主要酶類[2-3]。
植物中多酚氧化酶通常由核基因編碼,多基因控制,具有時空表達特性[4-7]。Thygesen 等[7]報道,馬鈴薯多酚氧化酶基因(PPO)包含5 個~6 個成員,POTP1/P2(GenBankID:M95196/M95197),POT32(U22921),POT33(U22922)和 POT72(U22923)[8],它們均缺乏內含子結構。它們的核酸序列間享有70%~82%的同源性,屬于組成型PPO 基因,具空間表達特性[9]。植物PPO 多定位于葉綠體類囊體腔或線粒體中[10-11]。而金魚草(Antirrhinum majus)PPO 不具轉運肽結構,定位于液泡[12]。典型的PPO 包含3 個結構域:N 末端的轉運肽,中部高度保守的Cu 結合區和C 末端疏水結構區。高度保守的銅結合區包含CuA 和CuB,負責銅與氧分子及酚類底物的協調聯動[13-15]。馬鈴薯PPO 功能的研究主要集中在與經濟指標相關的酶促褐變反應上[16]。工業中,常使用酶活性抑制劑[17]和物理法[18-19]使PPO 活性降低甚至喪失。科研中,常采用轉基因的方法將正義、反義或雙鏈RNA 轉入植物抑制PPO 基因表達,減少褐變的發生[20-23]。
本試驗通過檢索馬鈴薯基因組數據獲得馬鈴薯所有PPO 成員,并對成員基因StuPPO9 進行分離鑒定、表達載體構建和煙草遺傳轉化,為后期基因功能的研究提供理論和技術支持。
1 材料與方法
1.1 材料與試劑
“大西洋”品種馬鈴薯:天津天興佳業科技有限公司;離心柱型植物總RNA 提取試劑盒、離心柱型Plant Genomic DNA Kit、pEASYR-T3 Cloning Kit 克隆試劑盒:天根生化科技有限公司。
1.2 儀器與設備
GoScriptTM反轉錄系統:Promega 生物技術有限公司;Eppendorf 冷凍離心機:德國艾本德生命科學有限公司、Bio-rad 梯度PCR 儀:伯樂生命醫學產品(上海)有限公司、限制性內切酶BamHI 和PstI(NEB)和pCambia2301-ky 載體:北京索萊寶科技有限公司。
1.3 方法
1.3.1 馬鈴薯中PPO 類似基因的檢索
搜索GenBank 中已被確認的馬鈴薯PPO 基因信息,包括 StuPPO1(GenBank ID:15M95196/ M95197)、StuPPO2 (U22921)、StuPPO3 (U22922) 和 StuPPO4(U22923)。利用 US Joint Genome Institute 庫,在馬鈴薯基因組序列中,選擇blastn 系統默認參數,根據上述已知基因序列對 PPO 類似基因進行搜索。手動檢查BLAST 得到的結果,并查找PPO 類似基因序列。使用NCBI BLAST platform、Vector NTI Advance 11 software和Simple ModularArchitecture Research Tool 等軟件對得到的序列進行分析和整理。
1.3.2 StuPPO9 基因引物的設計與合成
運用Primer 3(version 0.4.0)引物設計軟件,從GenBank 和HarvEST 庫中搜集下載數據,并從獲得的數據中得到特異核苷酸序列區域進行設計。特異性引物如下:
STPO-F(上游引物):5′-ATGTTCATGAATACATCTCAAAC-3′
STPO-R(下游引物):5′-CTAATCCTCAAGCACAATC-3′
擴增目的產物大小為1884bp,引物序列進行合成。
1.3.3 植物總RNA 提取
取大西洋馬鈴薯葉片用錫箔紙包裹置于液氮中,取200 mg 的冷凍樣品組織,迅速放入研缽中研磨成細粉末狀,RNA 提取過程遵循試劑盒(離心柱型)的步驟。提取的RNA 置于-80 ℃冰箱中待用。
1.3.4 第一條鏈cDNA 的合成
cDNA 的合成依照反轉錄試劑盒說明書進行,將得到的cDNA 放在4 ℃條件的冰箱中暫存。
1.3.5 gDNA 的提取
gDNA 的提取依照Plant Genomic DNA Kit(離心柱型)試劑盒說明書進行,將所得溶液收集到離心管中放在-20 ℃的冰箱中保存備用。
1.3.6 目的基因的PCR 擴增和克隆測序
利用StuPPO9 特異性擴增引物,分別以cDNA 和gDNA 為模板擴增目的基因。PCR 反應條件為:95 ℃預熱 5 min;95 ℃,30 s;55 ℃,30 s;重復循環 30 次;72 ℃延伸10 min;恒溫。PCR 擴增反應結束之后,產物于1%的瓊脂糖凝膠中電泳,GoldView1 染色檢測產物大小,再回收目的片段。擴增所得DNA 片段,按照pEASYRT3 Cloning Kit 載體說明書要求進行StuPPO9 基因的連接,轉化Trans1-T1 感受態細胞,隨后挑選出白色的陽性克隆,接種在LB 培養基上,于200 r/min,37 ℃培養6 h,菌液送公司測序。
1.3.7 過表達載體的構建
用限制性內切酶BamHI 和PstI 雙酶將PCR 產物和pCambia2301-ky 載體的質粒進行雙酶切并進行切膠回收,回收的目的片段用T4 DNA Ligase 與pCambia2301-ky 進行連接,16 ℃靜置過夜,將連接產物轉入到大腸桿菌DH5α 感受態細胞中,測序正確的重組載體命名為pCambia2301-StuPPO9。轉化后的菌液均勻涂布在LB 固體培養基上,待完全吸收后,倒置平皿,37 ℃恒溫培養約12 h。培養完成后,在LB 培養基中挑選最佳生長的白色陽性克隆,接種到50 mL 含有氨芐青霉素(ampicillin,Amp)的 LB 液體培養基中,在 37 ℃下振蕩培養12 h。隨后依照重組質粒的提取方法操作,將得到的陽性轉化子質粒提取后送往公司進行測序,確定序列正確后進行植株轉化試驗。
1.3.8 煙草的基因轉化
應用煙草中農桿菌介導的轉基因法[24],將pCambia2301-ky 載體轉入煙草中。轉基因煙草株系首先在含有卡那霉素硫酸鹽的培養集中篩選,隨后進行聚合酶鏈式反應(polymerase chain reaction,PCR)篩選。將卡那霉素硫酸鹽和PCR 篩選陽性株系栽培于溫室中。
2 結果與分析
2.1 基于基因組的馬鈴薯PPO家族基因分析
利用US Joint Genome Institute 基因組庫,對馬鈴薯基因組檢索,共檢索到9 個PPO 相似基因,分別命名為StuPPO1 至StuPPO9。其中StuPPO5-9 是新檢索得到的馬鈴薯PPO 基因。經過進一步分析發現,StuPPO1 至StuPPO8 均位于8 號染色體上,而StuPPO9則位于2 號染色體。StuPPO1 和StuPPO6 位置相鄰,位于 47 kb 的一個區域內,而 StuPPO2、StuPPO3、StuPPO4、StuPPO5,StuPPO7 和 StuPPO8 則串聯在長度為144 kb 的另一區域內。這兩個區域在8 號染色體上間隔2 072 kb。與其他PPO 基因不同,StuPPO8 和StuPPO9 含有內含子結構見表1。
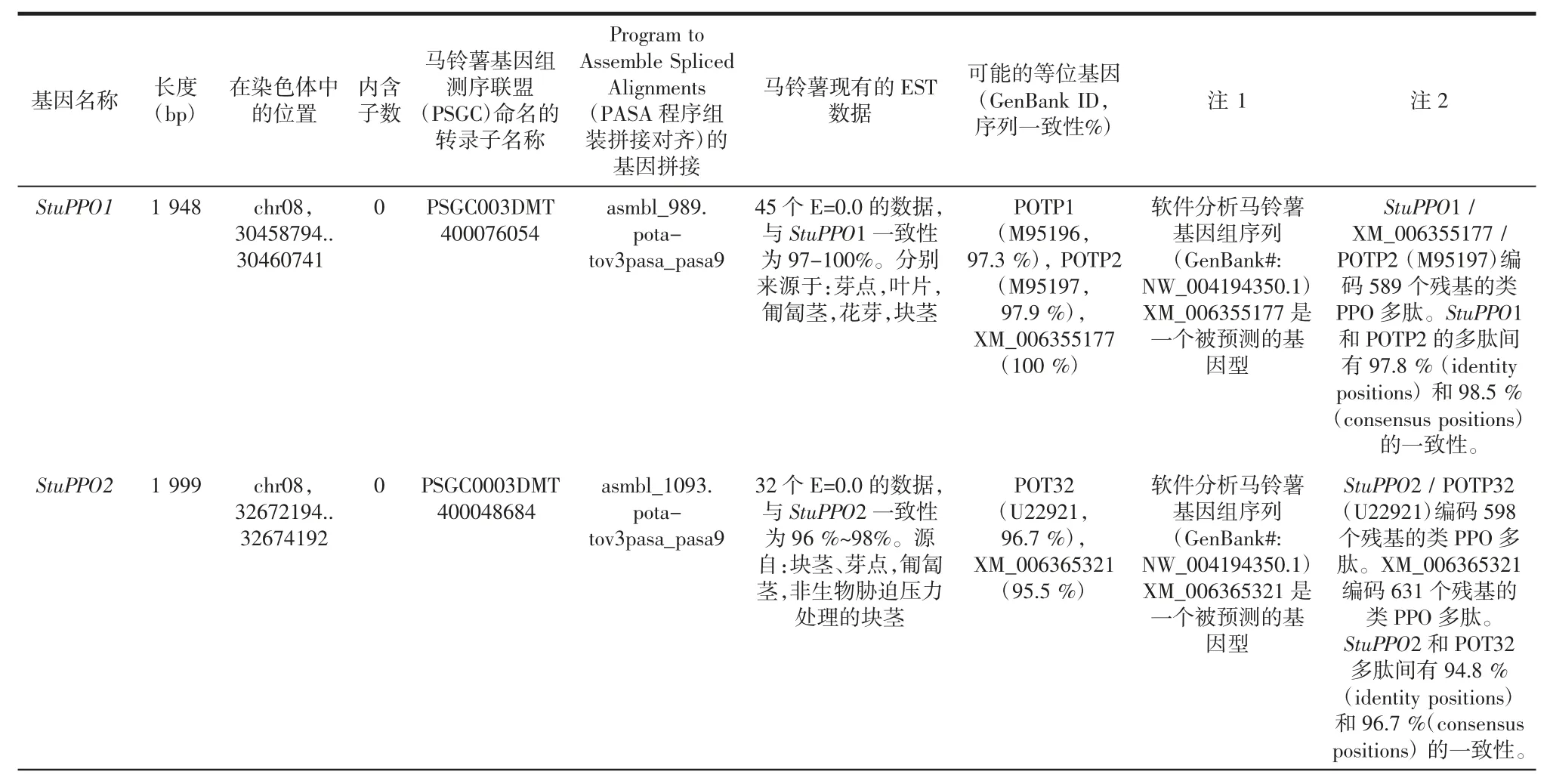
表1 馬鈴薯PPO 基因家族基因組分析Table 1 Genomic analysis of potato PPO gene family
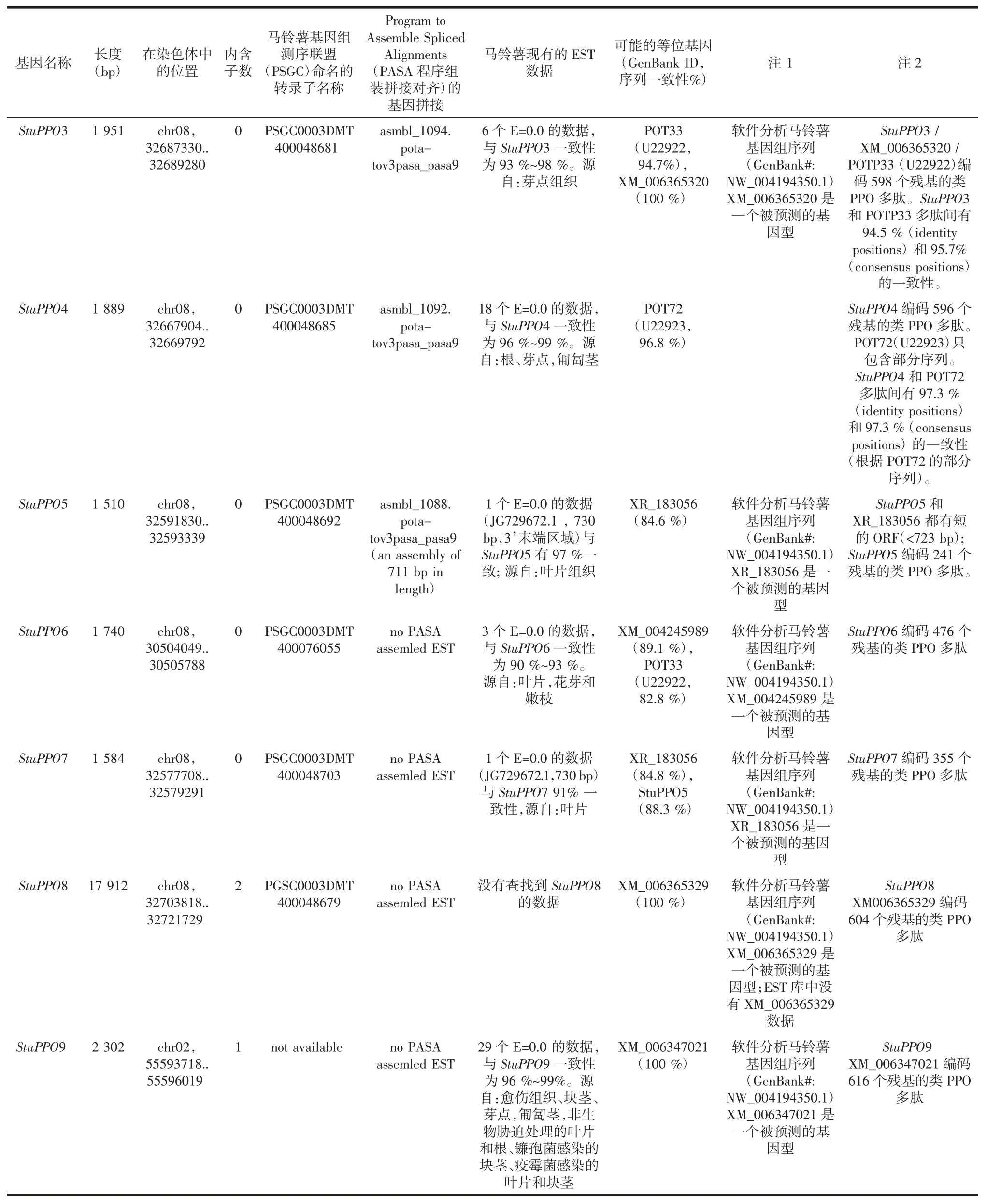
續表1 馬鈴薯PPO 基因家族基因組分析Continue table 1 Genomic analysis of potato PPO gene family
根據核酸序列分析,StuPPO1,StuPPO2,StuPPO3和StuPPO4 間享有70%~82%的同源性,并分別對應先前報道的 POTP1/P2,POT32,POT33 和 POT72。EST庫資料顯示,StuPPO1-StuPPO4,在馬鈴薯不同發育期的組織中都有表達。StuPPO5-9 是新檢索到的PPO 基因。其中StuPPO5-7 在EST 中的數據較少,沒有發現StuPPO8。說明它們很可能在馬鈴薯中表達量很少或僅在特殊狀態下誘導表達。
2.2 PPO蛋白區域和蛋白質特征的分析
采用SignalP 和iPSORT Prediction 在線分析軟件預測9 個PPO 的亞細胞定位,發現除StuPPO2 和StuPPO4 存在線粒體轉運結構域、StuPPO6 不具有轉運肽結構外,其他PPO 基因均存在葉綠體轉運結構域。各PPO 成員均包含高度保守的Cu 結合區。對PPO類似基因編碼的氨基酸序列的分析,表明上述基因編碼的氨基酸都含有3 個典型PPO 蛋白區域:酪氨酸酶區域(pfam00264),PPO1-DWL 區域(pfam12142)和PPO1-KFDV 區域 (pfam12143),StuPPO5 和 StuPPO7的酪氨酸區域比其它PPO 基因的短。StuPPO1-9 蛋白的區域名、重復序列和蛋白質特征見表2。
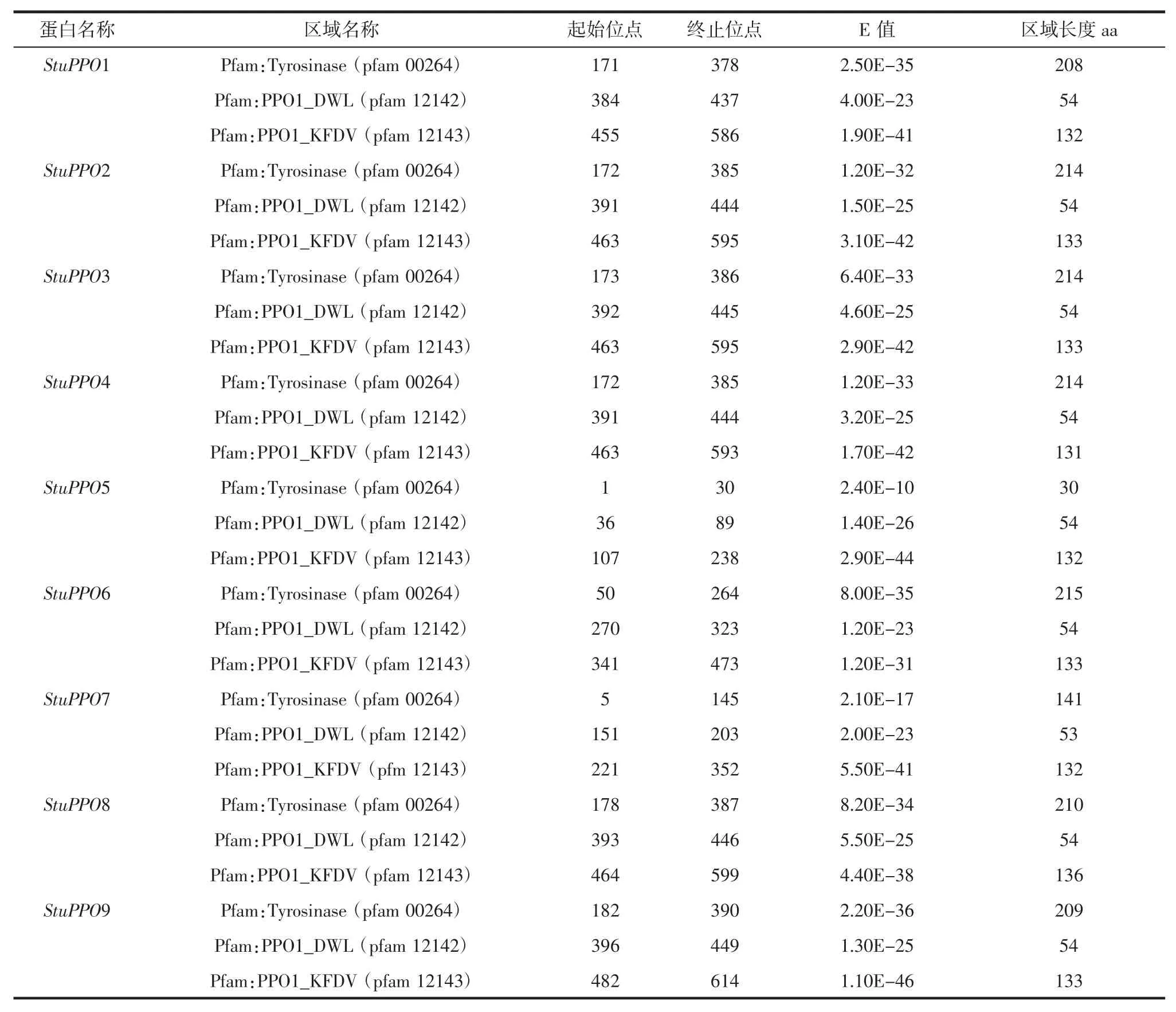
表2 StuPPO1-9 蛋白的區域名、重復序列和蛋白質特征Table 2 Region names,repeats and protein profiles of the StuPPO1-9 protein
2.3 StuPPO9基因的分離和鑒定
以大西洋馬鈴薯葉片為試材,參考馬鈴薯基因組中StuPPO9 預測序列設計特異性引物,分別以反轉錄的cDNA 和gDNA 為模板進行克隆。以cDNA 為模板擴增后獲得1 780 bp 的單一條帶,挑取兩個陽性菌落進行質粒的提取和測序,見圖1。
結果表明,兩個克隆序列完全一致,與XM_0063-47021.2 一致性為98.4%。經gDNA 為模板進行擴增和克隆,核實該基因存在一個104 bp 的內含子結構。
2.4 馬鈴薯StuPPO9基因的同源性分析
運用 MEGA7.0 軟件對番茄 PPO A、PPO E、PPO F、PPO D、PPO B[8]和馬鈴薯 StuPPO1-9 進行 DNA 序列同源性比對,并運用軟件構建基因親緣關系,結果見如圖2。
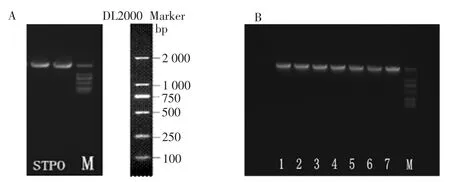
圖1 StuPPO9 基因克隆Fig.1 Amplification of StuPPO9 gene
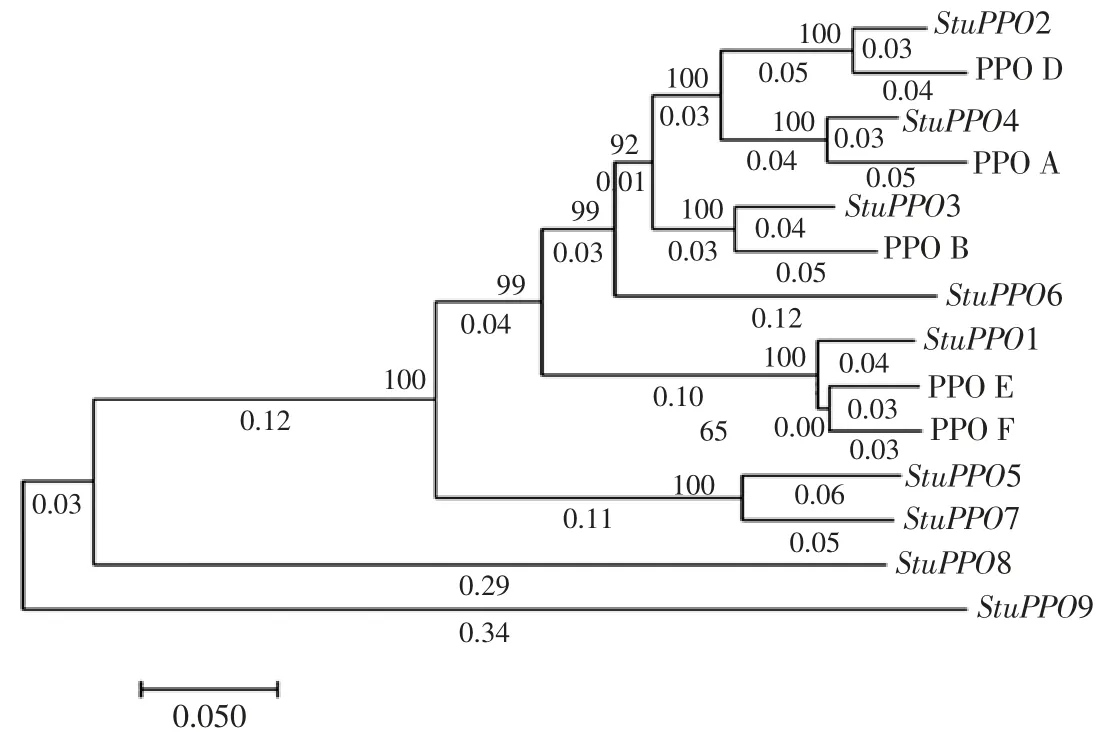
圖2 馬鈴薯與番茄PPO 基因序列進化樹Fig.2 Potato and tomato PPO gene sequence evolution tree
結果表明,StuPPO9 與 StuPPO2、PPO D 的基因親緣關系最遠,與StuPPO4、PPO A、StuPPO3、PPO B、StuPPO6、PPO E、PPO F、StuPPO1、StuPPO5、StuPPO7 基因親緣關系較遠。其中,StuPPO8 和StuPPO9 因在茄科多酚氧化酶基因家族中含有內含子結構,而處于離其他PPO 較遠的分枝中。
2.5 StuPPO9啟動子的預測
根據Blast 及PlantCARE 在線軟件分析,預測StuPPO9 基因起始密碼子上游1 661 bp 的片段為啟動子區域。該區域中TATA-BOX 和CAAT-BOX 分別位于所選序列的1 363 和1 317 位。采用PlantCARE 在線軟件預測啟動子區所包含的順式元件。結果表明,在StuPPO9 基因啟動子區主要包含3 類順式作用元件:第一類是基礎表達元件包括CAAT-box 和TATA-box,說明StuPPO9 啟動子是一個典型的由RNA 聚合酶II結合的啟動子;第二類是包括已經研究報道很多的病原誘導性順式作用元件,如有GT-1 等,第三類是激素誘導反應順式作用元件,如響應乙烯的ERE 元件,ABA 誘導相關的ABRE,響應MeJA 應答相關順式作用元件CGTCA-motif、G-box 響應auxin 應答相關順式作用元件TGA-element,參與抗病和水楊酸通路的GT-1 motif,環境誘導應答順式作用元件LTR、HSE、I-box等,由此推測,StuPPO9 啟動子可能是一個受生物因素和非生物因素誘導表達的啟動子。
2.6 過表達StuPPO9載體的構建和煙草植株轉化
利用StuPPO9 基因與Pcambia2301-ky 骨架重組克隆載體的大腸桿菌菌液為模板,結果見圖3。
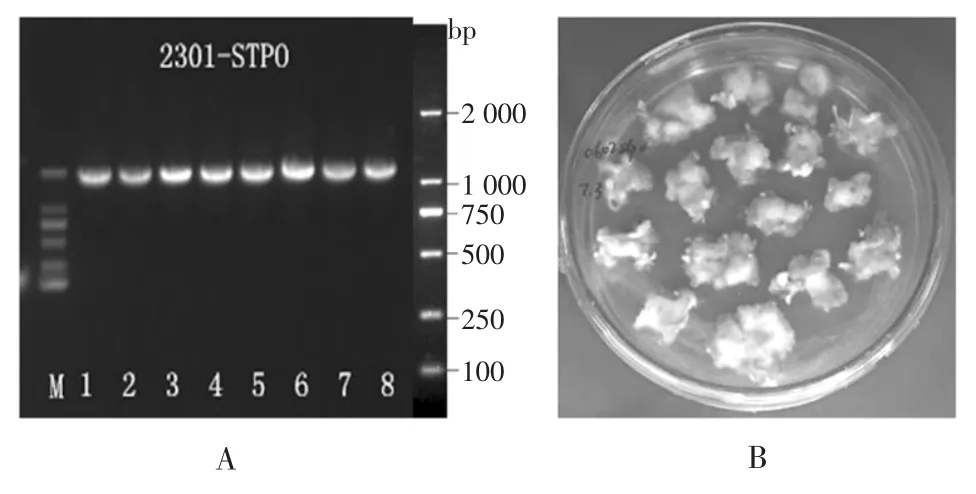

圖3 基因連接載體轉化菌落PCR 電泳圖(A)、StuPPO9 過表達的煙草抗性芽(B)、煙草陽性株系的PCR 篩選(C)陽性煙草移栽收種(D)Fig.3 PCR-electrophoresis map of gene-ligated vectortransformed colonies(A),Tobacco-resistant buds(B)Screening of positive tobacco with overexpressed StuPPO9(C)and positive tobacco transplanting(D)
通過PCR 擴增后電泳檢測結果如圖3A 所示。由圖可知,在2 000 bp 處顯現出特異性條帶與目標基因大小相符且為清晰、均一的電泳條帶,表明目的產物與克隆載體成功連接。將帶有StuPPO9 基因的pCambia2301-ky 載體,連接轉化大腸桿菌。挑取1 個PCR 陽性的轉化子進行質粒的提取。經測序分析確認后,轉化農桿菌并侵染煙草外植體,誘導抗性芽的產生(圖3B),通過PCR 篩選共得到5 個陽性株系(圖3C),并進行移栽收種(圖3D)。
3 結論
通過檢索馬鈴薯基因組發現多酚氧化酶基因數目多于先前報道的5~6 個成員,StuPPO5-9 是新檢索到的PPO 基因。對馬鈴薯正常植株葉片的StuPPO9 進行分離和鑒定,得到長度為1 884 bp 的序列片段,該片段中含有一段長為104 bp 大小的內含子,該基因與XM_006347021 的一致性為98.4%。與其他成員不同,它位于2 號染色體上,其啟動子可能被生物和非生物因素誘導激活。利用農桿菌介導的基因過表達技術,將該基因轉入煙草中,通過PCR 檢測獲得了5 個陽性株系。

