聚二乙炔囊泡的制備及其在醫療檢測領域的應用
郝瑜佳 朱光明

摘?要?聚二乙炔(Polydiacetylene, PDA)因具有獨特的光學及電子特性而受到廣泛關注。兩親性共軛二乙炔(Diacetylene, DA)單體在一定條件下可以自組裝成囊泡結構,紫外線輻射后,經1,4-加成聚合得到聚合物PDA囊泡。PDA在環境刺激下經歷顏色和熒光變化,而PDA囊泡的類細胞膜結構使其具有很好的仿生特性,因此PDA囊泡可以用于細菌、病毒、酶等的檢測以及疾病診斷和藥物控釋。本文介紹了PDA囊泡傳感系統的制備以及固相聚合和顏色變化的機理,綜述了PDA囊泡傳感系統在醫療檢測領域的研究和應用進展,并對PDA囊泡傳感系統存在的問題和未來發展方向進行了總結和展望。
關鍵詞?聚二乙炔; 囊泡; 自組裝; 固相聚合; 醫療檢測; 評述
1?引 言
共軛聚合物作為新型功能材料已被廣泛研究,它們具有廣泛離域的π-電子網絡,內在構象的限制使其具有獨特的光學和電學性質[1~4],因此常被用于設計成傳感器、儲能器件等[5~12]。聚二乙炔(Polydiacetylene,PDA)是其中具有代表性的化合物,它的主鏈高度有序,側鏈可以被功能性基團修飾。PDA具有特殊的光學性質,受到外界刺激時會經歷顏色和熒光的雙重變化[13,14],近年來被廣泛用于生物和化學傳感領域。
PDA是共軛二乙炔(也稱為聯乙炔、二乙炔,Diacetylene, DA)單體在紫外線和γ射線等照射條件下聚合得到的,由于聚合過程不需要引發劑或催化劑[15],因此其純度高,這對于傳感、檢測的應用具有重要意義。 其次,兩親性DA單體具有疏水尾和親水端基,可以在水性溶液中自組裝成囊泡[16,17]、單層或多層平面膜[18,19]、膠束[20,21]等結構,單體排列有序,有利于拓撲固相聚合過程的發生,其中自組裝囊泡的制備程序相對簡單,易于規模化生產,其雙層球狀結構具有很好的仿生特性[22],且用量容易控制,因此更適合于檢測應用。聚合后的藍色PDA囊泡呈藍色,在受到熱[23~25]、有機溶劑[26]、金屬離子[24,27~34]、機械應力[35,36]、受體配體相互作用[37~40]、光[41,42]、pH[24,41]、電流[41,43]等刺激時, 會經歷從藍色到紅色的顏色變化。DA單體親水端基易于修飾,可以結合功能性基團實現特定物質的檢測[44]。以上這些性質使得PDA囊泡傳感器具有靈敏的雙重檢測能力,因此被用于各種無標記比色傳感系統[31],用于檢測病毒[45,46]、細菌[47,48]、蛋白質[49,50]、抗生素[11]、激素[16]、CO2 [51]、三聚氰胺[52]、唾液酸[12]、金屬離子[24, 31]等或進行藥物輸送[53,54]。本文闡述了PDA囊泡傳感器的制備方法,總結了PDA固相聚合和顏色變化機理的研究進展,介紹了近幾年PDA囊泡用于醫療檢測領域的一些代表性研究工作。
2?PDA囊泡傳感器的制備
2.1?兩親性DA單體及其功能化
DA單體的形式為R1CCCCR2,通常由Cadiot-Chodkiewicz反應制備,即乙炔和鹵代乙炔的銅催化的偶聯反應[55]。DA分子的堆積排列與DA的側鏈或取代基密切相關[56]。通常,可用作親水性端基設計的基團有羧酸、酰胺、脲、磺酸酯基團或其鹽的取代基等,它們能夠形成氫鍵,有利于分子的自組裝和聚合,較大的側基不利于二乙炔的聚合[15,39]。單體10,12-二十五碳二炔酸 (10,12-pentacosadiynoic acid, PCDA) 和 10,12-二十三碳二炔酸 (10,12-tricosadiynoic acid, TCDA)(圖1)因其顏色響應的穩定性而受到研究者的青睞[39]。PDA囊泡可以直接對一些環境刺激做出反應,但這種傳感信號較弱且不具有特異性,由于DA分子的親水端基易修飾,可以將功能性基團引入到PDA上,賦予PDA特異性的檢測能力和更顯著的比色響應。
功能性基團通常是通過酰胺化反應或者酯化反應共價連接在二乙炔酸(如PCDA)單體上,然后功能化的單體直接自組裝或與其它脂質混合自組裝[37,45],再經過固相聚合過程得到具有特殊傳感性能的PDA囊泡。改進的酰胺化反應通常是通過1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride, EDC) 和N-羥基琥珀酰亞胺(N-hydroxysuccinimide, NHS)來活化PCDA得到PCDA的琥珀酰亞胺活性酯(PCDA-NHS),這種活性酯再與待連接基團的胺基進行酰胺化學反應, 得到功能化的PCDA[57~59]。目前, 研究人員已經成功制備了糖類功能化PDA[37]、脂質功能化PDA[60]、蛋白質功能化PDA[45]、氨基酸功能化PDA[61]和核酸功能化PDA[31]等多種用于醫療檢測的PDA。
2.2?PDA囊泡
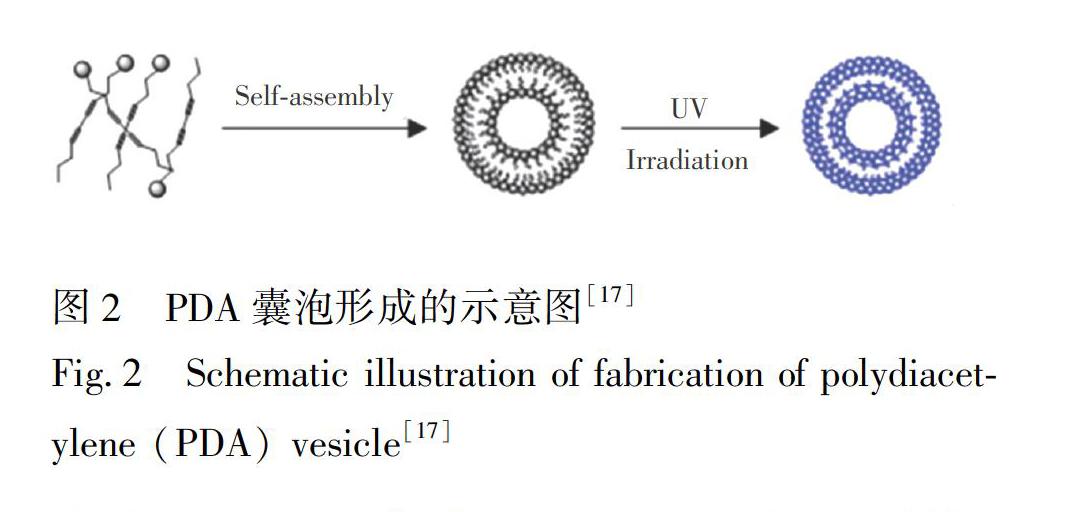
兩親性DA單體具有特殊的結構,理論上單體分子之間可能存在氫鍵、靜電相互作用、疏水/親水相互作用、π-π堆積、主客體相互作用、范德華力等非共價相互作用[24],這些非共價相互作用都有利于DA單體在水性溶液中自然排列(自組裝)[36,62]。通過改變單體的端基和鏈長,可以控制所得自組裝膜的結構[36,55,63~65]。自從Wegner[66]在1969年首次合成PDA以來,利用PDA自身的自組裝過程將其制備成多種形式,如自組裝單分子膜[67~69]、朗繆爾膜[37,60,70,71]和囊泡等。自組裝單分子膜和朗繆爾膜這種平面膜結構的PDA制備程序相對復雜,且難以制造出大面積性能穩定的膜[55]。囊泡(Vesicles)也可以稱為脂質體(Liposome),是PDA在醫療檢測領域應用最多的一種形式。囊泡是兩親性DA單體和其它所需的脂質成分在溶液中自組裝形成的具有封閉雙層結構的“小球”,其內部可以包裹藥物或其它活性成分[72]。囊泡結構的PDA傳感器制備程序簡單,且具有很好的仿生性。
在水性溶液中制備PDA囊泡需采用體積法(圖2)[17]: 將兩親性DA單體和其它所需的脂質成分完全溶解在氯仿中,使其均勻分布,然后在真空中通過N2氣流或者旋轉蒸發除去溶劑; 向干脂質膜中加入去離子水或水性緩沖液,充分水合后, 進行聚碳酸酯膜擠出, 或在高于60℃(DA的相變溫度)下進行探針超聲處理,所得囊泡溶液再通過多孔膜過濾, 以除去聚集體,然后在254 nm紫外光下進行聚合反應, 得到PDA囊泡[40,44]。PDA囊泡溶液的總脂質濃度通常應控制在0.5~2 mmol/L之間,濃度過高會導致PDA的聚集或沉淀。這種體積法制得的囊泡具有多分散性, 一定程度上會影響傳感器系統的質量[73]。
Kim等[73]基于流體動力學聚焦原理,通過使用微流體芯片制造了尺寸分布均勻的PDA囊泡,使用體積法制備的PDA囊泡的直徑平均值和標準偏差為88和31 nm,使用微流體法制備的囊泡的平均值和標準偏差為39和12 nm,且使用微流體法制備的囊泡熒光性能有所提高。體積法的制備過程簡單,微流體法制備過程相對復雜,但制得的囊泡性能較高。
純PDA囊泡中二乙炔單體通過橫向交聯的聚合物鏈連接,限制了膜的流動性。將脂質插入PDA囊泡, 有利于改變PDA的物理性質,如大小[11]、表面電荷和脂質排列等[74], 從而增強PDA囊泡傳感器的靈敏度和穩定性。實驗證明,適當地摻雜二肉豆蔻酰磷脂酰膽堿(DMPC)、二肉豆蔻酰基磷脂酸(DMPA)等有利于提高囊泡的膜流動性,增強囊泡的仿生特性[74],從而增強囊泡與一些生物分子的功能性相互作用[75]。
因為可以很容易控制用量, 相對于平面膜,膠體分散體形式的PDA囊泡更易制備和規模化生產,更適于作分析試劑,但是PDA囊泡溶液中的分散體很容易聚集或從溶液中沉淀出來,而且用配體等生物功能分子對PDA囊泡進行修飾時,需要通過色譜方法從囊泡溶液中分離除去未反應的配體,否則游離的配體會與目標分子結合,會降低PDA材料的反應性[55]。將囊泡固定化可以解決上述兩種問題,并且能保持PDA良好的比色性質[76,77],固定有利于提高檢測靈敏度。目前常用的方法是通過自發吸附[77,78]、共價結合[46,76]以及包封作用[24]實現囊泡的固定化。自組裝的PDA囊泡可以被固定在微珠[79]、纖維素膜[80,81]等固體基底上, 以及溶膠-凝膠材料[24,82]中。不同的形式適用于不同的傳感應用,膠體溶液形式的PDA囊泡適用于大部分檢測,而當PDA囊泡溶液發生嚴重的聚集或耐用性和方便性作為首要考慮因素時,固體化的PDA囊泡更適用于檢測[55]。
3?固相聚合及PDA變色
3.1?固相聚合
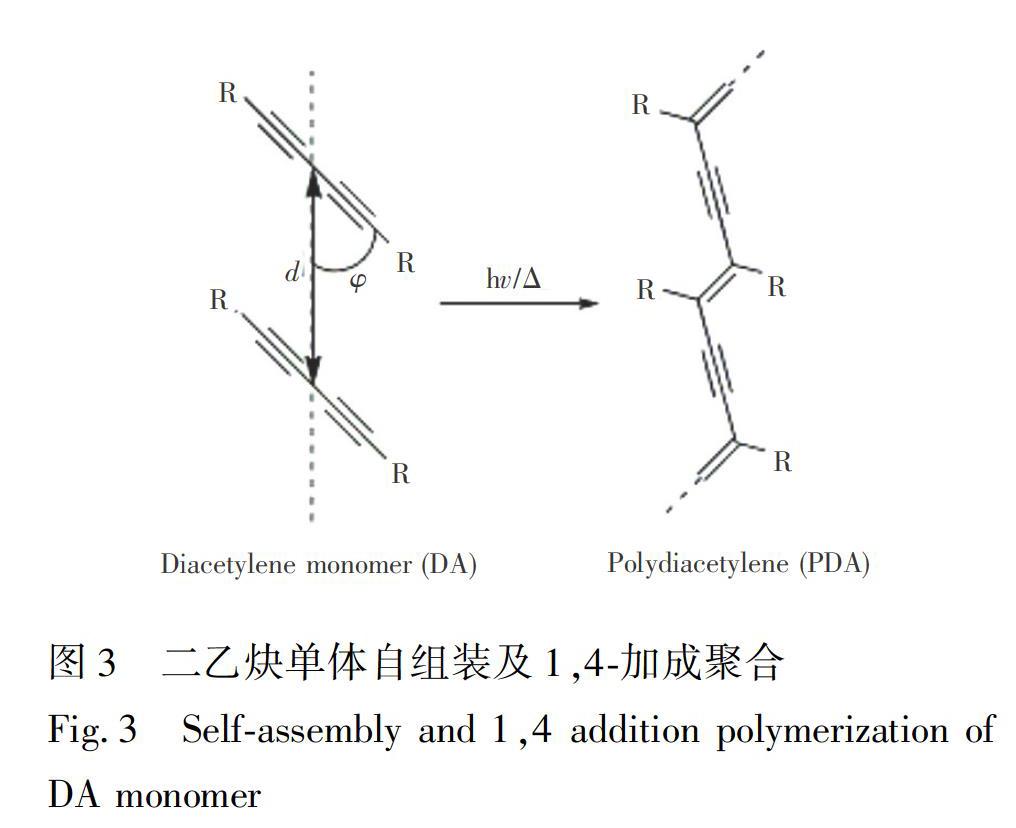
DA的固相聚合是拓撲化學反應,該反應可以在各種緊密堆積的結構中進行[27], 如晶體[83,84]、自組裝的單層或多層膜[36,37,65,67]、囊泡[11,31]、凝膠[24]、電紡纖維[54,85,86]和納米復合材料[43,87,88]等。
單體的緊密堆積是聚合所必需的,如圖3所示,當單體的排列滿足一定的結構參數, 即相鄰DA分子的距離d≈0.5 nm, DA桿和填充軸之間的夾角φ≈45°時,在受到外界刺激的情況下, 如光(UV、γ射線、X射線)、熱(退火)或施加應力, 1,4-加成聚合才會發生。254 nm紫外線很容易誘導聚合得到藍色(最大吸收波長約為640 nm)的PDA囊泡[75,89,90]。
3.2?顏色變化機理
PDA在醫療檢測領域的應用與比色性質密切相關。研究者從多個角度對PDA的變色機理進行了研究。 Lio等[91]揭示了PDA的熱致變色行為與側鏈的重排有關; Cheng等[61]認為PDA的微觀結構在熱致變色和pH致變色時可能通過不同的機制進行; Carpick等[36]認為PDA顏色的變化與其光吸收有關,PDA中的光吸收是通過線性π共軛聚合物主鏈中的π-π*吸收發生的,未聚合的薄膜在可見光區不顯示吸收,呈白色。聚合后PDA通常呈現藍色(最大吸收波長約為640 nm),受到外部刺激時PDA由藍向紅(最大吸收波長約為540 nm)的顏色轉變與可見光譜吸收從低能到高能的轉變有關。具體的吸收光譜和顏色轉變的溫度隨著側基和PDA形式的不同而變化。
藍相和紅相PDA之間的轉換機制仍未被完全闡明。目前被廣泛認可的一種說法是主鏈的吸收特性對應變非常敏感,理論計算表明,主鏈中碳碳鍵旋轉幾度就會顯著改變π-軌道重疊,影響電子狀態,導致主鏈吸收特性發生變化[55]。側鏈在未聚合時就會通過氫鍵、范德華力等支配分子間排列[92~94]。在聚合過程中,由于側鏈排列施加的幾何限制,延伸的主鏈將形成應變構型,即側鏈的堆積能形成一個能量障礙,阻止主鏈采用更松弛的形式。在光聚合后,外部環境的刺激會引起側鏈結構的變化,允許主鏈采用更松弛的構象,主鏈中CC鍵發生旋轉,破壞共軛主鏈的平面性 (如圖4所示),導致PDA主鏈吸收光譜藍移[36,55]。
3.3?親和變色
導致PDA由藍向紅轉變的外界刺激因素有很多,通常將由于發生特定目標分子識別而引起PDA顏色變化的過程稱為親和變色[19]。在醫療檢測領域,各種生物分子、離子或微生物導致PDA的變色基本都屬于親和變色,這種生物化學效應產生于待檢測物質和PDA 膜表面的多點相互作用破壞了膜表面結構; 待檢測物質的疏水結構域插入PDA膜結構引起結構擾動[39, 95~97]。PDA的結構一旦發生擾動,有可能破壞其共軛主鏈的平面性,導致光吸收的變化,呈現出肉眼可見的顏色變化。
4?PDA囊泡在醫療檢測領域的應用
采用PDA囊泡,目前已經實現了對病毒[45,46]、細菌[47,48]、蛋白質[49,50]、抗生素[11]、激素[16]等的檢測以及疾病診斷和藥物輸送[37,53,54]。檢測的原理為待檢測物質引起PDA囊泡的結構發生擾動,破壞了PDA共軛主鏈的平面性,從而引起光吸收的變化。目前研究者多采用了使DA單體功能化的方法提高單體和待檢測物質之間的結合能力,從而增加PDA囊泡的檢測特異性和靈敏度。
4.1?細菌、病毒的檢測
PDA囊泡可以用于檢測病毒和細菌,實質是PDA上連接的功能性基團特異性識別微生物表面物質(如病毒表面蛋白)或微生物分泌的物質(如細菌毒素),這種識別作用引起了PDA結構的擾動。
逆轉錄-聚合酶鏈反應(RT-PCR)和酶聯免疫吸附試驗(ELISA)方法是常用的檢測病毒的方法[98],然而這些方法成本高,并且需要長時間的樣品制備過程和復雜的操作。Seo等[46]以流感病毒M1肽-M1抗體對作為靶-探針模型,開發了DMPA和連接了M1抗體探針的PCDA 共組裝的囊泡微陣列,可以靈敏檢測甲型流感病毒。Roh等[45]利用乙肝表面抗體(HBsAb)與乙肝表面抗原(HBsAg)發生的特異性反應,制成一種特殊的PDA/HBsAb囊泡熒光探測器(圖5),利用PDA囊泡的紅色相作為熒光染料檢測硝酸纖維素膜(NC膜)上的HBsAg,裸眼檢出限在1 ng/mL以下,熒光分析檢出限在0.1 ng/mL以下。
PDA囊泡傳感器已被用于檢測枯草芽孢桿菌[99]、沙門氏菌[100]、耐甲氧西林金黃色葡萄球菌[101]、大腸桿菌[85,102]等多種細菌。Park等[99]開發了胺功能化的PDA囊泡傳感系統(圖6),通過細菌釋放的表面活性素和PDA囊泡之間的特定相互作用檢測細菌。該傳感器在枯草芽孢桿菌SSB466(革蘭氏陽性細菌的無表面活性素菌株)、枯草芽孢桿菌NCIB3610(革蘭氏陽性細菌的產生表面活性素的菌株)、銅綠假單胞菌PA14(一種革蘭氏陰性細菌)三種不同的細菌中特異性檢測NCIB3610。Tao等[101]制備的PDA囊泡可與耐甲氧西林金黃色葡萄球菌(MRSA)分泌的各種成孔毒素(如白細胞介素和α-毒素)結合,他們利用基于數字光處理的3D生物打印技術將PDA納米粒子組裝到明膠甲基丙烯酰水凝膠中, PDA微凝膠在體外和體內(小鼠)都有結合并中和MRSA分泌的成孔毒素的能力,可用于細菌檢測, 并治療細菌感染。
4.2?用于藥物控釋和疾病診斷
囊泡內部的親水“核”可以對藥物進行包封,外層的端基也可連接藥物,其作為藥物遞送載體進行靶向藥物輸送的應用被廣泛報道[53,103]。An研究組[103,104]制備了多種負載多西紫杉醇(DTX)的PDA囊泡,多西紫杉醇能與乳腺癌細胞發生識別,將多西紫杉醇(DTX)負載在由葉酸衍生物和PDA制備的新型葉酸-PDA囊泡上[104],該囊泡傳感器仍然具有良好的生物相容性,在殺死癌細胞方面也表現出更高的效率。這些PDA囊泡在體外模擬和在Bcap-37乳腺癌細胞中都實現了溫度控制的抗癌藥物釋放,藥物的療效顯著提高。
Kim等[105]將PCDA單體與磷脂DMPC混合, 開發了PDA/磷脂囊泡,并將外泌體的標志蛋白(CD-63)的抗體連接在囊泡上, 以誘導抗原-抗體相互作用,該復合免疫傳感器可以選擇性地檢測從人血漿中分離出來的外泌體,作為疾病診斷的信號。溶血磷脂酸(LPA)是卵巢癌的一種敏感的生物標志物[106],Wang等[107]制備了咪唑功能化的PDA傳感器(iPDA),能對LPA進行快速的特異性檢測(圖7A),檢出限為0.5 μmol/L,遠低于在卵巢癌患者體內的血漿LPA濃度。他們還將功能化的PDA裝載在硝酸纖維素膜上,成功區分卵巢癌患者和健康人的血樣。Wang等[12]設計合成了3種DA單體PCDA-pBA、PCDA-Nap和PCDA-EA(如圖7B所示),用苯硼酸(pBA)分子修飾的單體PCDA-pBA用作唾液酸識別的受體,含有萘亞胺(Nap)衍生物熒光團的單體PCDA-Nap被用于增強PDA傳感系統的熒光自放大,熒光團的熒光可在PDA囊泡形成過程中直接淬滅,在唾液酸與復合PDA囊泡特異性結合時又開啟。該傳感器系統可用于人乳腺癌(MCF-7)細胞表面的唾液酸檢測和成像。
4.3?檢測其它生物分子和離子
汞含量超標會嚴重影響人體健康, Wang等[31]將富含胸腺嘧啶(T)的單鏈DNA連接到PCDA單體上并制成囊泡(圖8),適體可與Hg2+選擇性結合形成胸腺嘧啶-HgⅡ-胸腺嘧啶復合物(T-Hg-T)[108], 從而引起PDA的顏色變化。該傳感器可以對未知汞濃度進行定量分析,Hg2+檢出限達5 μmol/L。
Wang等[49]設計的PDA囊泡傳感器可以定量檢測β-葡萄糖苷酸酶; Jannah等[109]利用PDA囊泡的pH敏感性和尿素酶能催化的尿素水解的特性[110],建立了脲酶的比色傳感器平臺,可以用于脲酶的視覺檢測; Kim等[51]設計的PDA囊泡可在3 min內快速檢測到CO2; Cho等[16]將DMPC和PCDA以1∶9的比例混合得到的囊泡,在10種類固醇中可以選擇性地檢測孕激素。
PDA囊泡還常被用于篩選藥物載體。 Wang等[111]制備優化的DMPC/PDA囊泡對市售的3種基因載體Lipofectamine 2000、Entranster-H4000和聚乙酰亞胺顯示出最敏感的變色反應。該傳感器不僅能夠預測基因載體的體外膜親和力,這有助于提高基因轉染效率,而且還為具有高細胞親和力的各種載體材料的高通量篩選提供了方法。
5?總結與展望
自從Wegner等[66]成功合成PDA以來,基于PDA的研究取得了顯著進展。本文討論了PDA的基本屬性,介紹了將PDA囊泡應用于醫療檢測領域的一些有代表性的研究成果。通過設計不同結構的PDA,使其與目標分子特異性結合,然后利用PDA的光學特性實現定性和定量檢測的目的。此傳感器具有雙重檢測能力,能直接輸出檢測信號,相比于其它傳感器更直觀、快速; 而且囊泡結構具有很好的仿生特性和生物相容性,這使得PDA囊泡不僅能檢測與生命活動密切相關的物質,還有望進行藥物的靶向運輸以及疾病的診斷和治療。
但是,到目前為止, PDA傳感器在醫療檢測領域的應用仍面臨著一些挑戰。PDA可以對溫度、pH值等作出響應,因此檢測時溫度、分析緩沖液成分、酸堿度等都可能會影響分析結果,干擾檢測,排除這些因素對檢測結果的干擾有待繼續研究。部分PDA傳感器的傳感信號不足, 在保證檢測特異性的情況下放大檢測信號、提高PDA系統檢測的靈敏度是未來的研究重點。目前PDA系統中的可逆響應已經能通過改變熱、酸堿度、紫外光和電流等實現,但用于醫療檢測領域的可逆PDA傳感器較少,開發可逆的生物和化學PDA傳感器也是一個重要的研究方向。
改進PDA傳感系統最基本的方法是通過化學方法在PDA傳感系統中引入各種功能性基團,不同的功能性基團在一定程度上決定了PDA傳感系統的特異性和靈敏性,由于PDA的可逆性與端基的結構密切相關,因此在末端引入可形成氫鍵、π-π相互作用的基團理論上也有利于增加PDA變色的可逆性,這種化學方法通常涉及有機合成,具有一定的挑戰性,而現代有機合成方法與技術的不斷發展將為PDA傳感器的設計提供更多可能; 在聚合前通過退火處理可以完善組裝體的結構,也可以很好地提升PDA的傳感性能; 此外,還可以通過在PDA囊泡體系中摻入其它脂質成分增強膜流動性和仿生性,從而放大檢測信號。除了優化PDA自身的結構之外,還應考慮將各種新材料與新技術引入PDA囊泡傳感體系。近年來,靜電紡絲、3D打印等材料領域的熱門技術[73,101]被應用到PDA傳感器的設計中,研究者還嘗試將自組裝的PDA負載到纖維支架[112]、石墨烯片[113]、聚偏氟乙烯膜[32,114]等主體基質上, 制備得到各種性能優異的PDA復合材料,這使得PDA傳感器的應用更加方便、快捷,大大增強了PDA材料的實用性。隨著新材料和新技術的不斷涌現,PDA傳感器的研究將迎來更多新的機遇。
References
1?Günes S, Neugebauer H, Sariciftci N S. Chem. Rev., 2007, 107(4): 1324-1338
2?Hoeben F J M, Pascal J, Meijer E W, Schenning A P H J. Chem. Rev., 2005,105(4): 1491-1546
3?MA Yun, ZHOU Yan, DU Wen-Qi, MIAO Zhi-Hui, QI Zheng-Jian. Progress in Chemistry, 2015,27(12): 1799-1807
馬 昀, 周 妍, 杜文琦, 繆智輝, 祁爭健. 化學進展, 2015,27(12): 1799-1807
4?ZHOU Xiao-Yu, ZHAO Jian-Wei, MA Gui-Min, JIA Hong-Xia. Chinese J. Anal. Chem., 2019,47(7): 1006-1013
周曉毓, 趙建偉, 馬貴敏, 賈紅霞.分析化學,2019,47(7): 1006-1013
5?Thomas S W, Joly G D, Swager T M. Chem. Rev., 2007,107(4) : 1339-1336
6?Zhang Z T, Liao M, Lou H Q, Hu Y J, Sun X M, Peng H S. Adv. Mater., 2018,30(13): 1704261
7?Shi K L, Zhang W F, Gao D, Zhang S Y, Lin Z Z, Zou Y, Wang L P, Yu G. Adv. Mater., 2018,30(9): 1705286
8?Kim Y H, Han M S, Kim J B, Kim E Y. Energy Environ. Sci., 2018,11(8): 2124-2133
9?Su Y W, Lin Y C, Wei K H. J. Mater. Chem. A, 2017,5(46): 24051-24075
10?Xiao S Q, Zhang Q Q, You W. Adv. Mater., 2017,29(20): 1601391
11?Kang D H, Jung H S, Ahn N Y, Lee J, Seo S B, Suh K Y, Kim J S, Kim K S. Chem. Commun., 2012,48(43): 5313-5315
12?Wang D E, Yan J H, Jiang J J, Liu X, Tian C, Xu J, Yuan M S, Han X, Wang J Y. Nanoscale, 2018,10(9): 4570-4578
13?CHENG Huan, ZHU Guang-Ming, SONG Rui. Progress in Chemistry, 2013,25(12): 2113-2118
成 歡, 朱光明, 宋 蕊.化學進展,2013,25(12): 2113-2118
14?Qian X, Stdler B. Chem. Mater., 2019,31(4): 1196-1222
15?Wegner G. Macromol. Chem. Phys.,1972,154(1): 35-48
16?Cho E, Hu Y, Choi Y, Jung S. J. Ind. Eng. Chem., 2018,63: 288-295
17?Nguyen L H, Naficy S, McConchie R, Dehghani F, Chandrawati R. J. Mater. Chem. C, 2019,7(7): 1919—1926
18?Geiger E, Hug P, Keller B A. Macromol. Chem. Phys., 2002,203(17): 2422-2431
19?FAN Yi, ZHANG Li-Gong, HOU Fang-Yu, MA Bao-Liang, SHEN De-Zheng, LI Ya-Jun. Chem. J. Chinese Universities, 2003,24(4): 657-661
范 翊, 張立功, 候芳玉, 馬保亮, 申德振, 李亞軍.高等學校化學學報,2003,24(4): 657-661
20?Yao D, Li S, Zhu X, Wu J, He T. Chem. Commun., 2017,53(7): 1233-1236
21?Doerflinger A, Quang N N, Gravel E, Ducongé F, Doris E. Int. J. Pharm., 2019,565: 59-63
22?WANG Xue-Jing, MU Wei, HAN Xiao-Jun. Chinese J. Anal. Chem., 2019,47(8): 1134-1144
王雪靖, 穆 韡, 韓曉軍.分析化學,2019,47(8): 1134-1144
23?Chance R R, Baughman R H, Müller H, Eckhardt C J. J. Chem. Phys., 1977,67(8): 3616-3618
24?Xu Y Y, Fu S Y, Liu F Y, Yu H Y, Gao J G. Soft Matter, 2018,14(39): 8044-8050
25?Mapazi O, Matabola P K, Moutloali R M, Ngila C J. Sens. Actuators B, 2017,252: 671-679
26?Ahn D J, Lee S M, Kim J M. Adv. Funct. Mater., 2009,19(10): 1483-1496
27?Wu S, Pan L B, Huang Y J, Yang N, Zhang Q J. Soft Matter, 2018,14(33): 6929-6937
28?Lee J, Jun H, Kim J. Adv. Mater., 2009,21(36): 3674-3677
29?Lee J, Kim H Y, Kim J. J. Am. Chem. Soc., 2008,130(15): 5010-5011
30?Gwon Y J, Kim C, Lee T S. Sens. Actuators B, 2019,281: 343-349
31?Wang M, Wang F, Wang Y, Zhang W, Chen X. Dyes Pigm., 2015,120: 307-313
32?Wen J T, Bohorquez K, Tsutsui H. Sens. Actuators B, 2016,232: 313-317
33?Jang Y S, Yoon B, Kim J M. Macromol. Res., 2011,19(1): 97-99
34?Yun D, Cho E, Dindulkar S D, Jung S. Macromol. Mater. Eng., 2016,301: 805-811
35?Carpick R W, Sasaki D Y, Burns A R. Langmuir, 2000,16(3): 1270-1278
36?Carpick R W, Sasaki D Y, Marcus M S, Eriksson M A, Burns A R. J. Phys. Condens. Mat., 2004,16(23): 679-697
37?Charych D H, Nagy J O, Spevak W, Bednarski M D. Science,1993,261(5121): 585-588
38?Charych D H, Spevak W, Nagy J O, Bednarski M D. Mat. Res. Soc. Symp. Proc.,1992,292: 153-161
39?Okada S, Peng S, Spevak W, Charych D. Acc. Chem. Res.,1998,31(5): 229-239
40?Lebègue E, Farre C, Jose C, Saulnier J, Lagarde F, Chevalier Y, Chaix C, Renault N J. Sensors, 2018,18(2): 599
41?Sun X M, Chen T, Huang S Q, Li L, Peng H S. Chem. Soc. Rev., 2010,39(11): 4244-4257
42?Lee J, Seo S, Kim J S. ACS Appl. Mater. Interfaces, 2018, 10(4): 3164-3169
43?Peng H S, Sun X M, Cai F J, Chen X L, Zhu Y C, Liao G P, Chen D Y, Li Q W, Lu Y F, Zhu Y T, Jia Q X. Nat. Nanotechnol., 2009,4(11): 738-741
44?Wen J T, Roper J M, Tsutsui H. Ind. Eng. Chem. Res., 2018,57(28): 9037-9053
45?Roh J, Lee S Y, Park S, Ahn D J. Chem. Asian J., 2017,12(16): 2033-2037
46?Seo S, Lee J, Choi E J, Kim E J, Song J Y, Kim J. Macromol. Rapid Commun., 2013,34(9): 743-748
47?Oliveira T V, Soares N F F, Andrade N J, Silva D J, Medeiros E A A, Badaró A T. Food Chem., 2015,172: 428-432
48?Xia Y, Deng J, Jiang L. Sens. Actuators B, 2010,145(2): 713-719
49?Wang D E, Zhang Y, Li T, Tu Q, Wang J. RSC Adv., 2014,4(32): 16820-16823
50?Park H K, Chung S J, Park H G, Cho J H, Kim M, Chung B H. Biosens. Bioelectron., 2008,24(3): 480-484
51?Kim K W, Lee J M, Kwon Y M, Choi T Y, Kim J Y H, Bae S, Song J A. Macromol. Res., 2018,26(3): 284-290
52?Lee J, Kim J. Chem. Mater., 2012,24(14): 2817-2822
53?Qin G, Li Z, Xia R, Li F, O'Neill B E, Goodwin J T, Khant H A, Chiu W, Li K C. Nanotechnology, 2011,22(15): 155605
54?Eslamian M, Khorrami M, Yi N, Majd S, Abidian M R. J. Mater. Chem. B, 2019,7(2): 224-232
55?Reppy M A, Pindzola B A. Chem. Commun., 2007,39(42): 4317-4338
56?Sarkar A, Okada S, Matsuzawa H, Matsuda H, Nakanishi H. J. Mater. Chem., 2000,10(4): 819-828
57?Hermanson G T. Bioconjugate Techniques. 3nd ed. Academic press, 2013:233-234
58?Kim J M, Ji E K, Woo S M, Lee H, Ahn D J. Adv. Mater., 2003,15(13): 1118-1121
59?Kim J M, Lee Y B, Yang D H, Lee J S, Lee G S, Ahn D J. J. Am. Chem. Soc., 2005,127(50): 17580-17581
60?Friedman S, Kolusheva S, Volinsky R, Zeire L, Schrader T, Jelinek R. Anal. Chem., 2008,80(20): 7804-7811
61?Cheng Q, Yamamoto M, Stevens R C. Langmuir, 2000,16(12): 5333-5342
62?Song J, Cisar J S, Bertozzi C R. J. Am. Chem. Soc., 2004,126(27): 8459-8465
63?Xie F, Chen C, Chen J, Liu M. J. Photochem. Photobiol. A, 2018,355: 283-289
64?Menzel H, Horstmann S, Mowery M D, Cai M, Evans C E. Polymer, 2000,41(22): 8113-8119
65?Sasaki D Y, Carpick R W, Burns A R. J. Colloid Interface Sci., 2000,229(2): 490-496
66?Wegner G. Macromol. Chem. Phys.,1971,145(1): 85-94
67?Kim T, Crooks R M, Tsen M, Sun L. J. Am. Chem. Soc.,1995,117(14): 3963-3967
68?Menzel H, Mowery M D, Cai M, Evans C E. J. Phys. Chem. B,1998,102(47): 9550-9556
69?Sullivan S P, Schnieders A, Mbugua S K, Beebe T P. Langmuir, 2005,21(4): 1322-1327
70?Ma B, Fan Y, Zhang L, Kong X, Li Y, Li J. Colloids Surf. B, 2002,27(2-3): 209-213
71?Li Y, Ma B, Yi F, Kong X, Li J. Anal. Chem., 2002,74(24): 6349-6354
72?Cho E, Jung S. Molecules, 2018,23(1): 107
73?Kim G, Song S, Lee J, Kim J M. Langmuir, 2010,26(23): 17840-17842
74?Kim K Y, Choi H, Lee G S, Ahn G J, Oh M K. Colloids Surf. B, 2008,66(2): 213-217
75?Thet N T, Jamieson W D, Laabei M, Mercer-Chalmers J D, Jenkins A T. J. Phys. Chem. B, 2014,118: 5418-5427
76?Kim J M, Ji E K, Woo S M, Lee H, Ahn D J. Adv. Mater., 2003,15(13): 1118-1121
77?Su Y L. J. Colloid Interface Sci., 2005,292(1): 271-276
78?Stanish I, Santos J P, Singh A. J. Am. Chem. Soc., 2001,123(5): 1008-1009
79?Lim M C, Shin Y J, Jeon T J, Kim H Y, Kim Y R. Anal. Bioanal. Chem., 2011,400(3): 777-785
80?Eaidkong T, Mungkarndee R, Phollookin C, Tumcharern G, Sukwattanasinitt M, Wacharasindhu S. J. Mater. Chem., 2012,22 (13): 5970-5977
81?Pumtang S, Siripornnoppakhun W, Sukwattanasinitt M, Ajavakom A. J. Colloid Interface Sci., 2011,364(2): 366-372
82?Jung S H, Jang H, Lim M C, Kim J H, Shin K S, Kim S M, Kim H Y, Kim Y R, Jeon T J. Anal. Chem., 2015,87(4): 2072-2078
83?Yaji T, Izumi K, Isoda S. Appl. Surf. Sci., 2002,188(3): 519-523
84?Jo S, Yoshikawa H, Fujii A, Takenaga M. Appl. Surf. Sci., 2006,252(20): 7383-7388
85?Yapor J P, Alharby A, Gentry-Weeks C, Reynolds M M, Alam A K M M, Li Y V. ACS Omega, 2017,2(10): 7334-7342
86?Li Y, Wang L, Wen Y, Ding B, Sun G, Ke T, Chhen J, Yu J. J. Mater. Chem. A, 2015,3(18): 9722-9730
87?Tahir M N, Nyayachavadi A, Morin J F, Simon R G. Polym. Chem., 2018,9(22): 3019-3028
88?Traiphol N, Chanakul A, Kamphan A, Traiphol R. Thin Solid Films, 2017,622(331): 122-129
89?Yoon J, Chae S K, Kim J M. J. Am. Chem. Soc., 2007,129(11): 3038-3039
90?Wang D E, Zhao L, Yuan M S, Chen S W, Li T, Wang J. ACS Appl. Mater. Interfaces, 2016,8(41): 28231-28240
91?Lio A, Reichert A, Ahn D J, Nagy J O, Salmeron M, Charych D H. Langmuir,1997,13(24): 6524-6532
92?Eckhardt H, Boudreaux D S, Chance R R. J. Chem. Phys.,1986,85(7): 4116-4119
93?Hankin S H W, Downey M J, Sandman D J. Polymer,1992,33(23): 5098-5101
94?Lee D C, Sahoo S K, Cholli A L, Sandman D J. Macromolecules, 2002,35(11): 4347-4355
95?Chen X, Zhou G, Peng X, Yoon J. Chem. Soc. Rev., 2012,41(13): 4610-4630
96?Su Y L, Li J R, Jiang L. Colloids Surf. B, 2004,39(3): 113-118
97?Su Y L, Li J R, Jiang L, Cao J. J. Colloid Interface Sci., 2005,284(1): 114-119
98?Neumann G, Noda T, Kawaoka Y. Nature, 2009,459(7249): 931-939
99?Park J, Ku S K, Seo D, Hur K, Jeon H, Shvartsman B, Seok H K, Mooney D J, Lee K. Chem. Commun., 2016,52(68): 10346-10349
100?Oliveiraa T V, Soaresa N F F, Coimbraa J S R, Andradea N J, Mourab L G, Medeirosa E A A, Medeiros H S. Sens. Actuators B, 2015,221(31): 653-658
101?Tao J, Xu X, Wang S, Kang T, Guo C, Liu X, Cheng H, Liu Y, Jiang X, Mao J, Gou M. ACS Macro Lett., 2019,8: 563-568
102?Koh J J, Liu S, Zeng W, Zou H, Wang L, Suresh V, Beuerman R, Cao D. Sens. Actuators B, 2013,178: 563-571
103?Yan X, An X. RSC Adv., 2014,4(36): 18604-18607
104?Li L, An X, Yan X. Colloids Surf. B, 2015,134: 235-239
105?Kim C, Lee K. Biomacromolecules, 2019,20(9): 3392-3398
106?Mills G B, Moolenaar W H. Nat. Rev. Cancer, 2003,3(8): 582-591
107?Wang Y, Pei H, Jia Y, Liu J, Li Z, Ai K, Lu Z, Lu L. J. Am. Chem. Soc., 2017,139(33): 11616-11621
108?Liu X, Tang Y, Wang L, Zhang J, Song S, Fan C. Wang S. Adv. Mater., 2007,19(11): 1471-1474
109?Jannah F, Kim J M. Dyes Pigments, 2019,169: 15-21
110?Zambelli B, Musiani F, Benini S, Ciurli S. Acc. Chem. Res., 2011,44(7): 520-530
111?Wang J W, Zheng F, Chen H, Ding Y, Xia X H. ACS Sens., 2019,4: 977-983
112?Haridas V, Sadanandan S, Collart-Dutilleul P Y, Gronthos S, Voelcker N H. Biomacromolecules, 2014,15 (2): 582-590
113?Wang X, Sun X, Hu P A, Zhang J, Wang L, Feng W, Lei S, Yang B, Cao W. Adv. Funct. Mater., 2013,23 (48): 6044-6050
114?Jeong J P, Cho E, Yun D, Kim T, Lee I S, Jung S. Polymers, 2017,9(4): 127
Advances in Fabrication of Polydiacetylene Vesicles
and Their Applications in Medical Detection
HAO Yu-Jia, ZHU Guang-Ming*
(College of Natural and Applied Sciences, Northwestern Polytechnical University, Xi' an 710129, China)
Abstract?Polydiacetylenes (PDAs) have received increasing attention as smart materials owing to their unique optical and electronic properties. PDAs are the most commonly synthesized as self-assembled bilayer vesicles via 1,4 addition polymerization. Vesicles are often perceived as closely mimicking the cell membrane, thus functioning as convenient biomimetic platforms. PDAs undergo colorimetric and fluorescent transition in response to external stimuli. Therefore, PDA vesicles can be used for medical detection, such as bacteria, viruses, proteins, and enzymes, etc. In this review, the preparation of PDA vesicle sensing systems and the mechanism of solid phase polymerization are summarized. The relative applications of PDA vesicle sensing systems in medical detection are introduced. Besides, the shortcomings and issues to be solved, and future directions are also discussed and prospected.
Keywords?Polydiacetylene; Vesicle; Self-assembly; Solid phase polymerization; Medical detection; Review
(Received 18 September 2019; accepted 4 November 2019)

