基于氧氣梯度共培養(yǎng)芯片的腫瘤細(xì)胞抗藥性研究
孫威 陳雨晴 汪明芳 王月榮 張敏 章弘揚 胡坪

摘?要?腫瘤微環(huán)境是一個復(fù)雜的體系,對腫瘤的發(fā)展、侵襲和轉(zhuǎn)移起至關(guān)重要的作用。本研究利用一個簡單的氧氣梯度芯片構(gòu)建了體外腫瘤缺氧微環(huán)境模型。此芯片由產(chǎn)生氧氣梯度的蛇形通道和用于小鼠肝癌細(xì)胞(Hepa1-6細(xì)胞)與肝星狀細(xì)胞(JS-1細(xì)胞)共培養(yǎng)的3個平行通道組成,通過在腫瘤細(xì)胞生長的區(qū)域制造氧氣梯度模擬腫瘤缺氧微環(huán)境。利用此芯片,開展了Hepa1-6細(xì)胞對紫杉醇和替拉扎明(TPZ) 的抗藥性研究,并從分子機制上分析導(dǎo)致抗藥性的可能原因。結(jié)果表明,芯片所產(chǎn)生的氧氣梯度的濃度范圍為2.3%~16.7%。在缺氧條件下,共培養(yǎng)的Hepa1-6細(xì)胞在TPZ作用下存活率顯著下降,但對紫杉醇產(chǎn)生抗藥性。免疫熒光分析結(jié)果表明,缺氧及共培養(yǎng)可提高細(xì)胞因子TIMP-1與TGF-β的表達,促使JS-1細(xì)胞活化,進而增強Hepa1-6細(xì)胞對紫杉醇的抗藥性。
關(guān)鍵詞?微流控芯片; 腫瘤微環(huán)境; 氧氣梯度; 細(xì)胞共培養(yǎng); 抗藥性
1?引 言
氧氣梯度廣泛存在于人體內(nèi)的組織、器官中,不僅影響人體的內(nèi)穩(wěn)態(tài)平衡,還調(diào)控著體內(nèi)細(xì)胞的多種行為[1,2]。人的組織與器官中的氧含量常低于大氣中的氧含量,如人肝臟中的氧含量約為4%~6%[3]; 而在快速增殖的腫瘤中,遠離血管的腫瘤細(xì)胞內(nèi)的氧含量,甚至只有1%[4]。缺氧會影響細(xì)胞的各種行為,如加速細(xì)胞遷移[5]、促進干細(xì)胞分化[6]、促進血管生成[7]、促進腫瘤細(xì)胞生長[8]以及使腫瘤細(xì)胞產(chǎn)生抗藥性[9,10]等。
微流控技術(shù)具有高通量、集成化、樣品消耗低、設(shè)計靈活、生物兼容性好等特點,已成為體外細(xì)胞生物學(xué)研究的強有力工具[11~16]。近年來,利用微流控技術(shù)成功建立了多種體外的缺氧模型[17~19]。由于微流控芯片的高度集成性,常用的體外氧氣控制方法仍可在微芯片中使用,如利用厭氧培養(yǎng)箱調(diào)節(jié)氧氣濃度[20,21],或使用化學(xué)試劑CoCl2[22]或Na2SO3[23]吸收細(xì)胞培養(yǎng)基中的氧氣,從而制造細(xì)胞缺氧。但這些方法通常只能制造單一的氧氣濃度,不能形成氧氣梯度,且化學(xué)試劑的加入難免對細(xì)胞造成損傷。廣泛用于芯片制作的聚二甲基硅氧烷(Polydimethylsiloxane, PDMS)具有良好的透氣性,因此可通過控制氣體的擴散來制造缺氧。Adler等[24]構(gòu)建了一個雙層芯片,其中一層通道與氮氣和氧氣鋼瓶相連,通過電腦控制氣體混合的比例,利用兩層芯片間PDMS膜的透氣性,在另一層流體通道中形成氧氣梯度。此氧氣梯度穩(wěn)定可控,被廣泛用于細(xì)胞遷移[25]、血管生成[26]、胚胎發(fā)育[27]、藥物實驗[28]等研究中。但此方法需要使用氣體鋼瓶與氣體混合器等大體積外部設(shè)備,實驗操作復(fù)雜。為了避免使用氣體鋼瓶[29~31],Chen等[32]構(gòu)建了氧氣梯度芯片,利用鄰苯三酚與氫氧化鈉混合可吸收周圍氧氣的性質(zhì),在芯片中制造了穩(wěn)定的氧氣梯度,并在缺氧條件下考察了抗腫瘤藥物替拉扎明(TPZ)對A549腫瘤細(xì)胞的抗藥性,結(jié)果表明,在缺氧條件下TPZ對A549細(xì)胞具有更大的殺傷性。
目前,微流控芯片中氧氣梯度構(gòu)建方法及應(yīng)用研究多關(guān)注單種細(xì)胞,而忽略了多種細(xì)胞之間的相互作用,這與真實的體內(nèi)微環(huán)境不符。本研究組構(gòu)建了一個氧氣濃度芯片[33],并證明缺氧環(huán)境中的腫瘤細(xì)胞與成纖維細(xì)胞共培養(yǎng)時,其遷移速率顯著高于常氧與單培養(yǎng)條件; 此實驗結(jié)果表明,缺氧作為腫瘤微環(huán)境的重要標(biāo)志,對腫瘤細(xì)胞的各種行為具有調(diào)控作用。利用上述缺氧芯片,本研究在芯片中共培養(yǎng)小鼠肝癌細(xì)胞與小鼠肝星狀細(xì)胞,從而更精準(zhǔn)地模擬肝腫瘤微環(huán)境,考察了抗腫瘤藥物在缺氧與共培養(yǎng)條件下的細(xì)胞毒性,并研究了腫瘤細(xì)胞產(chǎn)生抗藥性的相關(guān)機制。
2?實驗部分
2.1?儀器與試劑
Ti-S倒置熒光顯微鏡、A1R激光共聚焦顯微鏡(日本尼康公司); LSP04-1A微量注射泵(保定蘭格恒流泵有限公司); Multiskan FC酶標(biāo)儀(美國Thermo Fisher公司)。
聚二甲基硅氧烷(PDMS)前體及引發(fā)劑(美國Dow Corning公司); PBS、DMEM培養(yǎng)基、0.25%胰蛋白酶-EDTA溶液、胎牛血清、細(xì)胞核染料DAPI(4,6-diamidino-2-phenylindole)、CellTracker CMFDA與CMTPX(美國Thermo Fisher公司); 噻唑藍、鄰苯三酚、紫杉醇、替拉扎明(TPZ)、戊二醛、Triton X-100、牛血清白蛋白(BSA)、三(4,7-聯(lián)苯-1,10-鄰菲啰啉)二氯化釕(II)、NaOH (美國Sigma公司); Calcein-AM/PI活細(xì)胞/死細(xì)胞雙染試劑盒(上海翊圣生物科技有限公司); 抗α-SMA單克隆抗體、抗TIMP-1單克隆抗體、抗TGF-β單克隆抗體(美國Santa Cruz公司); Alexa Fluor555熒光標(biāo)記二抗(英國Abcam公司)。
2.2?微流控芯片設(shè)計與氧氣濃度的構(gòu)建
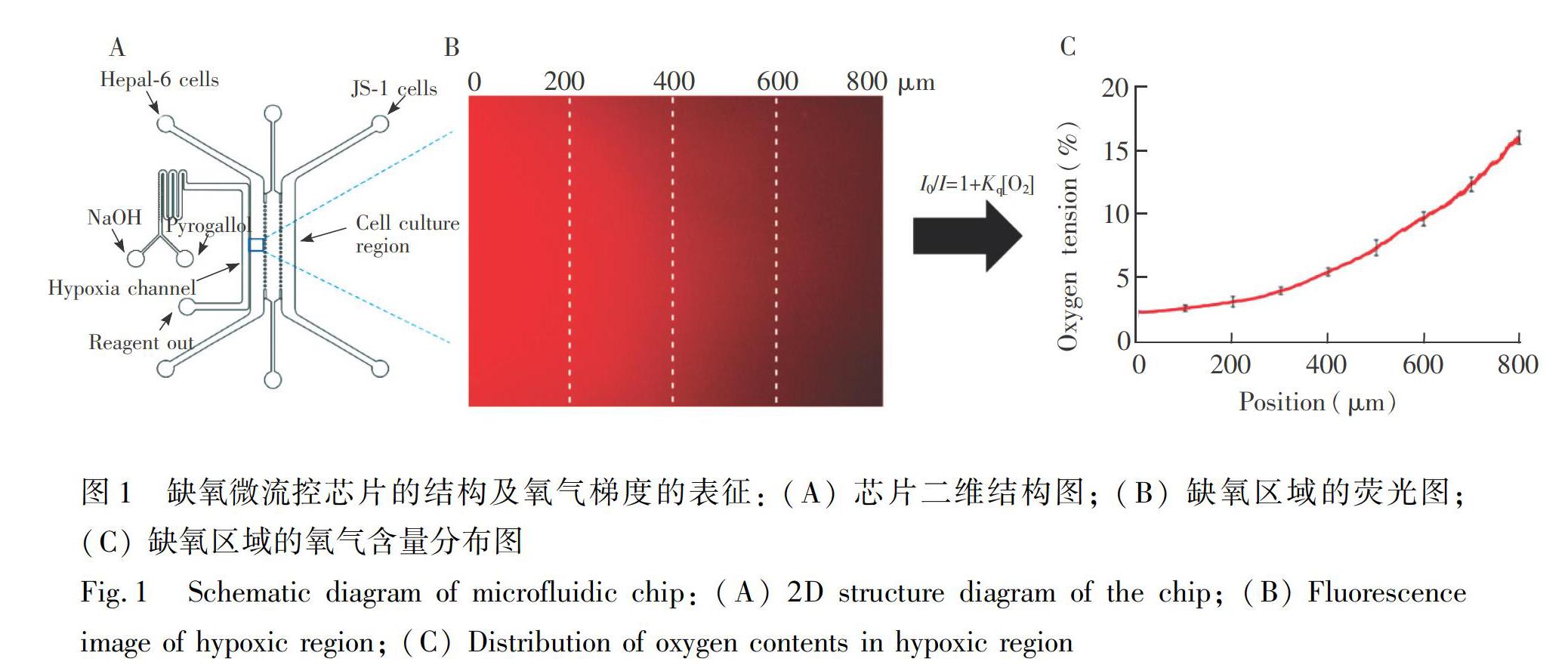
氧氣梯度芯片包含缺氧通道和細(xì)胞培養(yǎng)單元兩個部分(圖1A)。缺氧通道寬200 μm,通道設(shè)計為蛇形,使得缺氧試劑充分混合; 細(xì)胞培養(yǎng)單元由3個平行的通道構(gòu)成,每個通道之間以六邊形的微柱陣列分隔,微柱直徑75 μm,間距100 μm,細(xì)胞通道寬800 μm。
根據(jù)文獻[34]報道,鄰苯三酚在堿性條件下能快速吸收周圍的氧氣。為了在芯片中獲得穩(wěn)定的氧氣梯度,用微流泵將1 mol/LNaOH與5 mg/mL 鄰苯三酚以5 μL/min的流速持續(xù)地引入缺氧通道,使相鄰的細(xì)胞培養(yǎng)通道中形成長時間穩(wěn)定的氧氣梯度。
為表征細(xì)胞培養(yǎng)通道中產(chǎn)生的氧氣梯度,將200 μmol/L 熒光染料三(4,7-聯(lián)苯-1,10-鄰菲啰啉)二氯化釕(II)指示劑注入與缺氧通道相鄰的細(xì)胞培養(yǎng)通道。當(dāng)氧氣存在時,指示劑發(fā)生熒光淬滅,根據(jù)Stern-Volmer方程:
I0/I=1 + Kq[O2](1)
其中,I為待測體系的熒光強度,I0為氧氣濃度為0時的熒光強度,Kq為淬滅系數(shù)。為了確定Kq,在缺氧通道中分別通入純氮(氧氣濃度為0%)與純氧(氧氣濃度為100%),則有:
Kq=I0/I100-1(2)
其中,I0為通入純氮時的熒光強度,I100為通入純氧時的熒光強度。通道中的氧氣濃度可通過公式(3)計算:
[O2]=(I0/I-1)/Kq(3)
2.3?細(xì)胞培養(yǎng)及MTT實驗
小鼠肝癌細(xì)胞Hepa1-6與小鼠肝星狀細(xì)胞JS-1用10% DMEM培養(yǎng)基培養(yǎng),待細(xì)胞達到80%融合度時,用0.25%胰蛋白酶-EDTA溶液將其消化,加入新鮮的DMEM培養(yǎng)基終止消化,1000 r/min離心5 min,棄去上清液,重懸細(xì)胞至所需濃度。
將細(xì)胞重懸至5×103 個/μL的密度,接種至96孔板中,每孔加200 μL 細(xì)胞懸液,在37℃細(xì)胞培養(yǎng)箱中培養(yǎng)24 h,再分別加入200 μL不同濃度的紫杉醇或TPZ孵育24 h,最后使用MTT法檢測各孔細(xì)胞活性,用于評價藥物毒性。
2.4?芯片中的細(xì)胞共培養(yǎng)
芯片在使用前,首先置于紫外燈下照射1 h,再使用0.1 mg/mL 纖連蛋白包被芯片通道1 h,以促進細(xì)胞貼壁。將重懸后的Hepa1-6細(xì)胞(2×106 cell/mL)和JS-1細(xì)胞(1.5×106 cell/mL)用移液槍分別注入芯片中,將芯片置于培養(yǎng)箱中6 h,使細(xì)胞貼壁,然后將儲液池中多余的細(xì)胞除去,并更換新鮮的培養(yǎng)基。芯片每12 h換液一次。
使用活細(xì)胞染色實驗對細(xì)胞的生長與增殖情況進行考察,分別使用CellTracker CMFDA與CMTPX對重懸的細(xì)胞染色30 min,再按上述方法將細(xì)胞注入芯片,待細(xì)胞完全貼壁2天后,使用倒置熒光顯微鏡拍攝其熒光圖,觀察細(xì)胞的生長與增殖情況。
2.5?缺氧條件下的藥物測試和細(xì)胞活力評估
共設(shè)置了5組實驗,分別為對照組、兩種細(xì)胞的單培養(yǎng)組、共培養(yǎng)組以及缺氧共培養(yǎng)組。在接種細(xì)胞至芯片1天后,對照組更換正常的DMEM培養(yǎng)基,其余4組將培養(yǎng)基更換為適當(dāng)濃度的藥物,置于培養(yǎng)箱中培養(yǎng)24 h。使用Calcein-AM/PI活細(xì)胞/死細(xì)胞雙染試劑盒對藥物作用后的腫瘤細(xì)胞的存活率進行考察,活細(xì)胞顯綠色熒光,死細(xì)胞顯紅色熒光。細(xì)胞存活率(p)由公式(4)計算:
p=NG/(NG+NR) × 100%(4)
其中,NG和NR分別是綠色熒光和紅色熒光細(xì)胞的數(shù)量。
2.6?細(xì)胞免疫熒光測定
利用免疫熒光法對兩種細(xì)胞進行免疫熒光染色。在藥物作用24 h后,移去培養(yǎng)基,用PBS將芯片中的細(xì)胞培養(yǎng)通道沖洗3遍,加入2.5% 戊二醛固定30 min,清洗后,加入0.2% Triton X-100透化15 min, 用10% BSA封閉1 h,再分別加入α-SMA、TIMP-1、TGF-β一抗過夜,以Alexa Fluor555標(biāo)記的IgG為二抗,于熒光顯微鏡下判定結(jié)果。
3?結(jié)果與討論
3.1?微流控芯片結(jié)構(gòu)與氧氣梯度的表征
本研究采用的氧氣梯度芯片結(jié)構(gòu)如圖1A所示,左側(cè)的缺氧區(qū)域用于產(chǎn)生化學(xué)缺氧,右側(cè)的3個通道用于細(xì)胞的共培養(yǎng)。由于制作芯片采用的PDMS材料具有良好的透氣性,細(xì)胞培養(yǎng)通道中的氧氣透過PDMS被鄰近缺氧通道中的鄰苯三酚消耗。芯片右側(cè)的細(xì)胞培養(yǎng)單元由3個平行的通道構(gòu)成,每個通道之間用六邊形微柱陣列分隔,由于存在微柱阻力與液體表面張力,流經(jīng)的液體不會泄露至相鄰?fù)ǖ乐小R虼耍稍谛酒拿總€通道內(nèi)接種不同種類的細(xì)胞,從而模擬細(xì)胞旁分泌作用。
氧氣梯度的熒光表征結(jié)果如圖1B所示,此方法可在細(xì)胞培養(yǎng)區(qū)域制造寬度800 μm的缺氧環(huán)境,與腫瘤細(xì)胞培養(yǎng)通道的寬度接近。根據(jù)不同位置的熒光強度計算得到的氧氣濃度(圖1C),氧氣濃度梯度的范圍為2.3%~16.7%,與腫瘤內(nèi)部的缺氧模式相近。此方法的優(yōu)點是芯片結(jié)構(gòu)簡單,可產(chǎn)生穩(wěn)定的氧氣梯度,且試劑消耗量極少,相比于物理缺氧,不需要氣體鋼瓶等外部設(shè)備。
3.2?芯片中小鼠肝癌細(xì)胞與肝星狀細(xì)胞的共培養(yǎng)
腫瘤微環(huán)境中存在大量的基質(zhì)細(xì)胞,而星狀細(xì)胞則是肝癌微環(huán)境中重要的基質(zhì)細(xì)胞。為了在體外建立可靠的腫瘤模型,將Hepa1-6細(xì)胞與JS-1細(xì)胞在芯片中共培養(yǎng)。由于芯片中存在微柱陣列,兩種細(xì)胞可在不同的芯片通道中增殖(圖2A); 細(xì)胞接種2天后,熒光顯微鏡掃描顯示, 兩種細(xì)胞均可在芯片中增殖生長(圖2B)。
3.3?氧氣梯度下的藥物作用
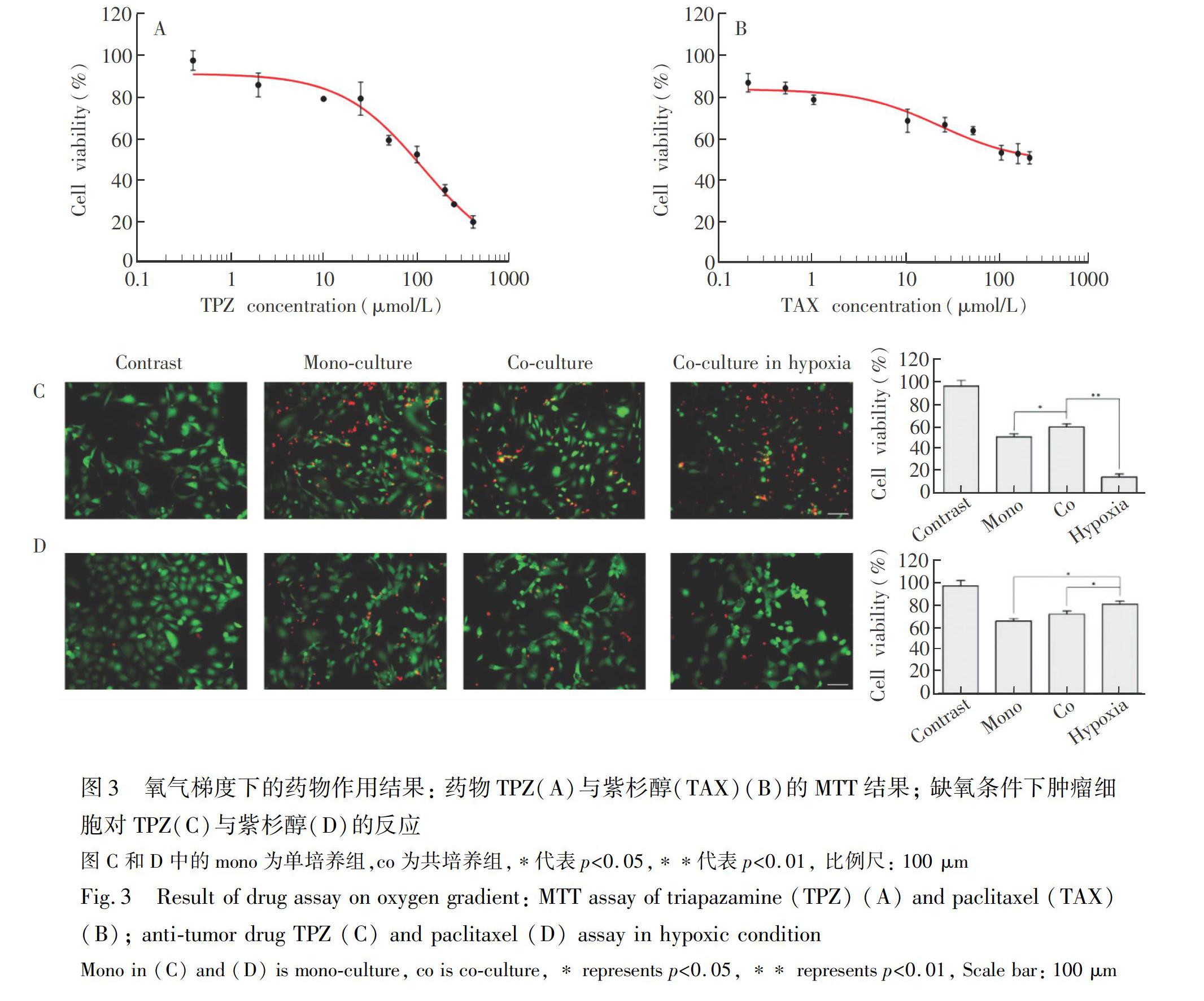
本研究采用Calcein-AM/PI雙染法對抗腫瘤藥物紫杉醇、TPZ的細(xì)胞毒性進行表征。TPZ是一種對氧氣敏感的抗腫瘤藥,在氧氣濃度較低時對腫瘤細(xì)胞的作用更明顯[35]。
在進行芯片抗藥性實驗之前,使用孔板MTT法對藥物濃度進行初步篩選,結(jié)果如圖3A和3B所示。當(dāng)TPZ濃度為100 μmol/L時,細(xì)胞存活率接近50%,而紫杉醇在24 h內(nèi)對細(xì)胞的毒性不大。由于高濃度的紫杉醇容易析出,因此,分別使用100 μmol/L TPZ與50 μmol/L 紫杉醇進行后續(xù)芯片實驗。芯片實驗中,上述濃度藥物作用24 h后,兩種藥物對Hepa1-6細(xì)胞與JS-1細(xì)胞的生長均有抑制作用(圖3C和3D)。對于這兩種藥物,共培養(yǎng)均可增加Hepa1-6細(xì)胞的抗藥性。缺氧條件下,Hepa1-6細(xì)胞杉醇作用下的細(xì)胞存活率大于常氧條件; 而對于TPZ則相反,缺氧組的腫瘤細(xì)胞存活率急劇下降至20%,這與TPZ的特性相符。上述結(jié)果表明,在進行藥物篩選時,氧氣濃度對抗腫瘤藥物的藥效的影響不可忽略。
3.4?缺氧與共培養(yǎng)促進腫瘤細(xì)胞的抗藥性
由于Hepa1-6細(xì)胞在低氧下對紫杉醇具有抗藥性,因此選取紫杉醇作為研究對象,采用免疫熒光染色法探究了Hepa1-6細(xì)胞產(chǎn)生抗藥性的原因。在藥物作用24 h后,對細(xì)胞進行免疫熒光表征。α-SMA是肝星狀細(xì)胞活化的標(biāo)志性因子,在肝纖維化中起到重要的作用。由圖4A可知,與Hepa1-6細(xì)胞共培養(yǎng)的JS-1細(xì)胞的α-SMA表達較單培養(yǎng)顯著上升,說明共培養(yǎng)時,Hepa1-6細(xì)胞通過旁分泌作用促進了JS-1細(xì)胞中α-SMA的表達,并且加速了肝星狀細(xì)胞的活化與纖維化; 共培養(yǎng)缺氧組中,JS-1細(xì)胞的α-SMA表達較單培養(yǎng)顯著上升,較共培養(yǎng)組略有上升,表明缺氧環(huán)境中的腫瘤細(xì)胞亦會影響肝星狀細(xì)胞的活化。TIMP-1主要在活化后的肝星狀細(xì)胞中表達,由圖4B可知,共培養(yǎng)模式下,星狀細(xì)胞中的TIMP-1高于單培養(yǎng)模式,表明共培養(yǎng)促進了星狀細(xì)胞的活化; 與缺氧的腫瘤細(xì)胞共培養(yǎng)時,星狀細(xì)胞中的TIMP-1顯著高于非缺氧條件下的共培養(yǎng)組,提示缺氧的Hepa1-6細(xì)胞可促使JS-1細(xì)胞中TIMP-1表達的增加,顯著加速了肝星狀細(xì)胞的活化。TGF-β能導(dǎo)致腫瘤細(xì)胞的藥物抵抗,由圖4C可知,共培養(yǎng)組中腫瘤細(xì)胞的TGF-β蛋白的表達高于單培養(yǎng)組,表明星狀細(xì)胞的旁分泌作用會影響腫瘤細(xì)胞對紫杉醇的抗藥性; 而缺氧組腫瘤細(xì)胞的TGF-β蛋白的表達量最高,證明了缺氧與活化了的星狀細(xì)胞均能增加腫瘤細(xì)胞中TGF-β的表達量,進而促進腫瘤細(xì)胞的抗藥性。
4?結(jié) 論
利用微流控技術(shù)構(gòu)建了一個體外的缺氧腫瘤微環(huán)境模型,利用此模型進行了抗腫瘤藥物TPZ與紫杉醇的體外毒性研究,并對腫瘤細(xì)胞抗藥性的相關(guān)蛋白進行了檢測。結(jié)果表明,本方法建立的缺氧模型可產(chǎn)生穩(wěn)定的氧氣梯度,可用于構(gòu)建體外的缺氧實驗?zāi)P汀K幬飳嶒炑芯勘砻鳎鯕鉂舛葘τ诳鼓[瘤藥物的藥效具有不可忽略的影響。在缺氧條件下,TPZ對共培養(yǎng)的Hepa1-6細(xì)胞毒性增大,但對于藥物紫杉醇,缺氧會導(dǎo)致腫瘤細(xì)胞產(chǎn)生抗藥性,這是由于缺氧及共培養(yǎng)使得抗藥性細(xì)胞因子TIMP-1與TGF-β的表達升高,導(dǎo)致肝星狀細(xì)胞活化,從而增強腫瘤細(xì)胞的抗藥性。相比于常規(guī)的體外實驗,本研究建立的缺氧-共培養(yǎng)模型更接近腫瘤的真實環(huán)境,可為體外藥物篩選以及新藥研究提供新方法。
References
1?Tsai A G, Johnson P C, Intaglietta M. Physiol. Rev., 2003, 83(3): 933-963
2?Eales K L, Hollinshead K E R, Tennant D A.Oncogenesis, 2016,5(1): e190
3?De Santis V, Singer M.Brit. J. Anaesth.,2015,115(3): 357-365
4?Jahanban-Esfahlan R, de la Guardia M, Ahmadi D, Yousefi B.J. Cell. Physiol.,2018,233(3): 2019-2031
5?Joseph J V, Conroy S, Pavlov K, Sontakke P, Tomar T, Eggens-Meijer E, Balasubramaniyan V, Wagemakers M, Dunnen W F, Kruyt F A.Cancer Lett.,2015,359(1): 107-116
6?Lin Q, Lee Y J, Yun Z.J. Biol. Chem.,2006,281(41): 30678-30683
7?Liao D, Johnson R S.Cancer Metastasis Rev.,2007,26(2): 281-290
8?Vaupel P.Oncologist,2004,9 (Supplement 5): 10-17
9?Wilson W R, Hay M P.Nat. Rev. Cancer,2011,11(6): 393-410
10?Vaupel P, Mayer A.Cancer Metast. Rev.,2007,26(2): 225-239
11?ZHANG Feng, GAO Dan, LIANG Qiong-Lin.Chinese J. Anal. Chem.,2016,44(12): 1942-1949
張 逢, 高 丹, 梁瓊麟. 分析化學(xué), 2016,44(12): 1942-1949
12 LIAO Ze-Rong, LI Yong-Rui, GU Le, LEI Run-Hong, MIAO Yun-Fei, LAN Hong-Ying, DENG Yu-Lin, GENG Li-Na. Chinese Journal of Chromatography, 2019, 37(4): 343-347
廖澤榮, 李永瑞, 古 樂, 雷潤宏, 苗云飛, 藍鴻穎, 鄧玉林, 耿利娜. 色譜, 2019, 37(4): 343-347
13?SHI Yang, SHAO Xiao-Guang. Chinese Journal of Chromatography, 2019, 37(9): 925-931
石 楊, 邵小光. 色譜, 2019, 37(9): 925-931
14?Bhatia S N, Ingber D E.Nat. Biotechnol.,2014,32(8): 760-772
15?LIN Dong-Guo, LIN Jin-Qiong, LI Pei-Wen, YANG Na, XU Bang-Lao, LIU Da-Yu.Chinese J. Anal. Chem., 2018,46(1): 113-120
林冬果, 林錦瓊, 李佩文, 楊 娜, 徐邦牢, 劉大漁.分析化學(xué),2018,46(1): 113-120
16?LIN Bing-Cheng.Micro/Nano Fluidic Chip Laboratory.Beijing: Science Press, 2013:2-5
林炳承.微納流控芯片實驗室.科學(xué)出版社, 2013: 2-5
17?Chang C W, Cheng Y J, Tu M, Chen Y H, Peng C C, Liao W H, Tung Y C.Lab Chip,2014,14(19): 3762-3772
18?Wang W, Li L, Ding M, Luo G, Liang Q.Biochip J.,2018,12(2): 93-101
19?Park T E, Mustafaoglu N, Herland A.Nat. Commun.,2019,10(1): 2621
20?Chen L J, Ito S, Kai H, Nagamine K, Nagai N, Nishizawa M, Abe T, Kaji H.Sci. Rep.,2017,7(1): 3538
21?Na K, Lee M, Shin H W, Chung S.Lab Chip, 2017,17(9): 1578-1584
22?Gao Y, Majumdar D, Jovanovic B, Shaifer C, Lin C, Zijlstra A, Webb D J, Li D.Biomed. Microdevices,2011,13(3): 539-548
23?Wang L, Liu W, Wang Y, Wang J, Tu Q, Liu R, Wang J.Lab Chip,2013,13(4): 695-705
24?Adler M, Polinkovsky M, Gutierrez E, Groisman A.Lab Chip,2010,10(3): 388-391
25?Acosta M A, Jiang X, Huang P K, Cutler K B, Grant C S, Walker G M,Gamcsik M P.Biomicrofluidics,2014,8(5): 054117
26?Tabata Y, Yoshino D, Funamoto K, Koens R, Kamm R D, Funamoto K.Integr. Biol. UK,2019,11(1): 26-35
27?Wang Z, Oppegard S C, Eddington D T, Cheng J.PloS one,2017,12(9): e0185267
28?Khanal G, Hiemstra S, Pappas D.Analyst,2014,139(13): 3274-3280
29?Li Y, Li L, Liu Z, Ding M, Luo G, Liang Q.Microfluid. Nanofluid.,2016, 20(7): 97
30?Gao Y, Stybayeva G, Revzin A.Lab Chip,2019,19(2): 306-315
31?Li L, Li Y, Shao Z, Luo G, Ding M, Liang Q.Anal. Chem.,2018,90(20): 11899-11907
32?Chen Y A, King A D, Shih H C, Peng C C, Wu C Y, Liao W H, Tung Y C.Lab Chip,2011,11(21): 3626-3633
33?Sun W, Chen Y, Wang Y, Luo P, Zhang M, Zhang H, Hu P.Analyst,2018,143(22): 5431-5437
34?Fieser L F.J. Am. Chem. Soc.,1924,46(12): 2639-2647
35?Beck R, Rper B, Carlsen J M, Huisman M C, Lebschi J A, Andratschke N, Picchio M, Souvatzoglou M, Machulla H J, Piert M.J. Nucl. Med.,2007,48(6): 973-980
Study on Drug Resistance to Tumor Cell in Oxygen
Gradient and Co-culture Microfluidic Chip
SUN Wei1, CHEN Yu-Qing1, WANG Ming-Fang1, WANG Yue-Rong1, ZHANG Min2, ZHANG Hong-Yang1, HU Ping*1
1(Shanghai Key Laboratory of Functional Materials Chemistry, School of Chemistry and Molecular Engineering,
East-China University of Science and Technology, Shanghai 200237, China)
2(Shanghai Key Laboratory of New Drug Design, School of Pharmacy,
East China University of Science and Technology, Shanghai 200237, China)
Abstract?Tumor microenvironment is a complex system, and it is of great importance in development, invasion and metastasis of tumor. In this work, an in vitro tumor hypoxic microenvironment model was constructed using an oxygen gradient microfluidic chip. The microfluidic chip was composed of two parts: one was a serpentine shape channel to generate oxygen gradient by a chemical reaction, the other was a three-parallel channel for the co-culture of cancer cells (Heap1-6 cells) and hepatic stellate cells (JS-1 cells). The oxygen gradient was made in cancer cells to simulate hypoxic tumor microenvironment, and then a drug-resistance study on paclitaxel and tirapazamine (TPZ) in hepa1-6 cells was performed and the potential reason of the drug resistance was analyzed by molecular mechanism. The result showed that the oxygen gradient was 2.3%-16.7% on chip. The Hepa1-6 cells expressed paclitaxel resistance in hypoxic condition, but cell viability was significant down due to the effect of TPZ. The results of immunofluorescence assay showed hypoxia and co-culture could promote the expression of TIMP-1 and TGF-β, induce the activation of JS-1 cell and then enhance the drug resistance of Hepa1-6 cell to paclitaxel.
Keywords?Microfluidic chip; Tumor microenvironment; Oxygen gradient; Cell co-culture; Drug resistance
(Received 30 September 2019; accepted 8 November 2019)
This work was supported by the National Natural Science Foundation of China (No. 81973285).

