太行菊組織培養技術初探
白鳳麟

摘? ? 要:針對太行菊,對其根、莖和葉采用組織培養技術使其快速生長繁殖,獲得預期產量。本試驗包括選取太行菊種子、種子消毒、無菌苗培育、愈傷組織誘導、叢生芽增殖、生根壯苗和煉苗移栽等過程。經試驗結果分析可得:無菌苗在 1/2 MS 培養基生長最好;組織(根、莖和葉)愈傷誘導的最適濃度為 MS+8 g 瓊脂粉+30 g 蔗糖+2.0 mg/L 6-BA+1.0 mg/L NAA+1.0 mg/L 2,4-D;叢生芽增殖的最適濃度為 MS+30 g 蔗糖 +8 g 瓊脂粉+0.2 mg/L 6-BA+2.0 mg/L NAA。
關鍵詞:太行菊;組織培養;愈傷組織誘導;叢生芽增殖
文章編號: 1005-2690(2020)24-0001-03? ? ? ?中圖分類號: S567.239? ? ? ?文獻標志碼: B
1? ?材料與方法
1.1? ?試驗材料
試驗材料為長治市老頂山太行菊。
1.2? ?試驗儀器及藥品
1.2.1? ?試驗儀器
高壓滅菌鍋(TOMY 全自動高壓滅菌鍋),超凈工作臺(DL–CJ–1N型),烘箱,培養皿,錐形瓶,組培瓶,pH 試紙等。
1.2.2? ?試驗藥品
MS 培養基,蔗糖,瓊脂,NAA(萘乙酸),6–BA(6–芐基氨基嘌呤),2,4–D(2,4–二氯苯氧乙酸),1/2 MS 培養基等。
2? ?試驗方法
2.1? ?太行菊種子選取
挑選太行菊長勢均一的種子,首先用自來水浸泡 4? h,在超凈工作臺用 75%的酒精消毒 30 s,再用 0.1%升汞消毒 8 min,最后用無菌水清洗 3~4次。
2.2? ?無菌苗生長
將上述消毒的無菌種子在超凈工作臺中接種在 1/2 MS 培養基上,放在組培實驗室中培養。
試驗共有 10 個組培瓶,每個組培瓶放10顆種子[1](溫度 25 ℃,光照 14 h)。每天觀察并記錄數據,30 d后統計數據。
2.3? ?誘導愈傷組織
選取長勢較好且均一的無菌苗,取其根和莖在 MS 培養基進行組織愈傷誘導。其中根、莖和葉切成1 cm 左右。每個濃度有 30 小段的根、莖和葉。每天觀察并記錄相關現象,30 d后統計數據[2]。
2.4? ?叢生芽增殖培養
選取愈傷組織誘導出的叢生芽,并去掉枯葉和基部的愈傷組織,接種于 MS 培養基中增殖培養[3],每個梯度培養基接種15瓶。每天觀察并記錄試驗現象,20? d后統計數據。
2.5? ?生根壯苗
繼代培養上述不定芽生長到合適時的再生芽,從基部切下接種在生根培養基上,每個梯度培養基分別接種15瓶[4]。每天觀察并記錄試驗現象,培養10 d后統計數據。
2.6? ?煉苗移栽
將生長狀態良好、長勢較為均一的太行菊組培苗移栽與營養土基質中進行培養,每隔5 d進行此觀察,觀察期間要對其進行合理澆水管理[5]。
2.7? ?結果統計
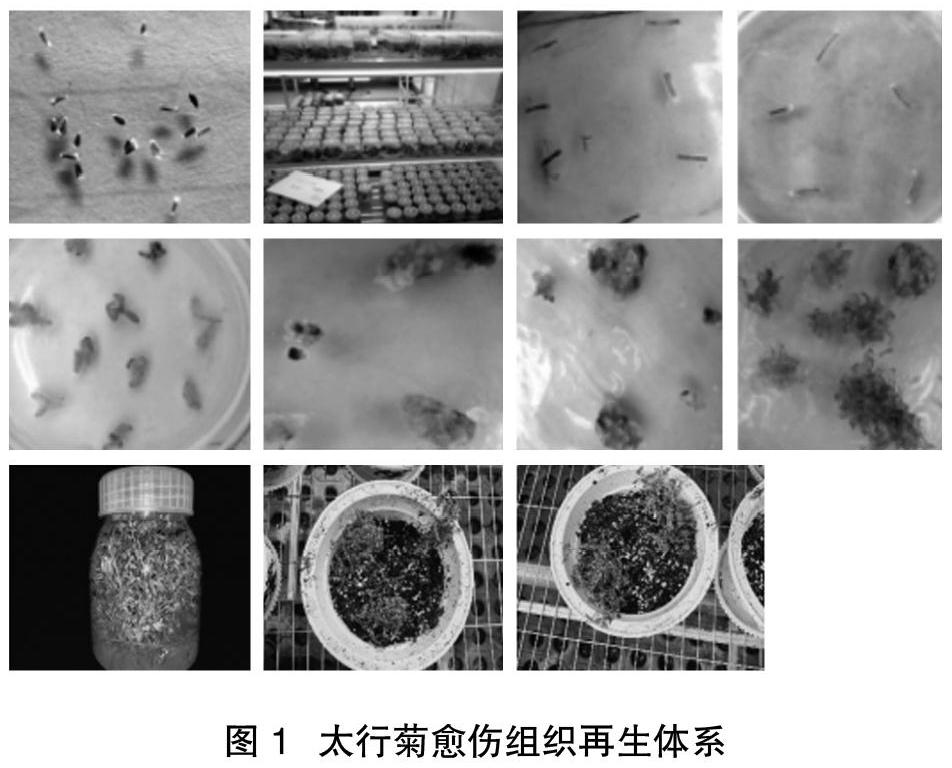
太行菊愈傷組織再生體系建立見圖1。
誘導率=(誘導愈傷組織的外植體數/總外植體數)×100%
增殖倍數=增殖的叢生芽數/接種數
生根率=(生根苗數/接種苗數)×100%
3? ?結果與分析
3.1? ?無菌苗生長
30 d后,太行菊形態及其生長情況如下。
(1)本試驗過程中沒有出現染菌的情況,即染菌率為 0%。
(2)不同的發芽率:組培瓶 1、3、4、5 的發芽率均為 80%;組培瓶 2、6、9、10 的發芽率均為 60%;組培瓶 7 的發芽率為 30%;組培瓶 8 的發芽率為 40%。
(3)組培瓶 1、2、8 的株較高;組培瓶 3、5、7、10 的株高;組培瓶 4、6、9的株較矮。
(4)所有根系都幾乎發達[6]。
(5)組培瓶 1 葉片繁盛但基部有少量枯葉;組培瓶 2 基部幾乎沒有黃色葉子;組培瓶 3 葉片小還少;組培瓶 4 葉片繁盛;組培瓶 5 葉片多且較小;組培瓶6 基部有少量枯葉;組培瓶 7 葉片較大;組培瓶 8 葉片少;組培瓶 9 葉片多;組培瓶 10 基部比頂端繁茂。
綜合以上情況,組培瓶 1、2、7 苗長得好,組培瓶 6、9 苗長得較好。做愈傷誘導時選取組培瓶 1、2、7、6、9 為材料。
3.2? ?誘導愈傷組織
30 d后,太行菊組織愈傷誘導情況如下。
3.2.1? ?根的誘導
從濃度 1 到濃度 9,濃度 3、濃度 6 和濃度 9 的誘導率差別不大,且誘導率最高分別為93.3%、93.3%和 96.7%,都可以作為根的愈傷誘導的方案。
濃度 3 的誘導情況:愈傷沒有褐化,體積大;濃度 6 的誘導情況:愈傷帶有少量褐化,體積大;濃度 9 的誘導情況:愈傷沒有褐化,體積較大。綜合誘導率和愈傷是否褐化、大小的情況,此次愈傷誘導試驗的適宜濃度為 9,其配方為:MS+8 g 瓊脂粉+30 g 蔗糖+2.0 mg/L 6–BA+1.0 mg/L NAA +1.0 mg/L 2,4–D(適宜培養基配方)[7]。
3.2.2? ?莖的誘導
從濃度 1 到濃度 9,濃度 4、6、8 的誘導率差別不大,且誘導率最大分別為76.7%、80.0%和 83.3%,均可作為莖的愈傷誘導方案[8]。濃度 4的誘導情況為愈傷帶有少量褐化,體積大;濃度 6 的誘導情況為愈傷沒有褐化,體積較小;濃度 8 的誘導情況為愈傷沒有褐化,體積較大[9]。綜合誘導率和愈傷是否褐化、大小的情況,此次誘導試驗的適宜濃度是 8,其配方為:MS+8 g 瓊脂粉+30 g 蔗糖+2.0 mg/L 6–BA+0.5 mg/L NAA+0.5 mg/L 2,4–D(適宜培養基配方)[10]。
3.2.3? ?葉的誘導
從濃度 1 到濃度 9,濃度 3、4、9 的誘導率差別不大,且誘導率最大分別為80.5%、80.0%和 89.5%,均可作為葉的愈傷誘導方案。濃度 3 的誘導情況為愈傷沒有褐化,體積大;濃度 4 的誘導情況為愈傷沒有褐化,體積較小;濃度 9 的誘導情況為愈傷沒有褐化變色,體積較大。綜合誘導率和愈傷是否褐化、大小的情況,此次誘導試驗的適宜濃度為 9,配方為:MS+8 g 瓊脂粉+30 g 蔗糖+2.0 mg/L 6–BA+1.0 mg/L NAA+1.0 mg/L 2,4–D(適宜培養基配方)[11]。
3.2.4? ?綜合根、莖和葉的誘導情況
此次試驗誘導的適宜配方為濃度 9 即MS+8 g瓊脂粉+30 g 蔗糖+2.0 mg/L 6–BA+1.0 mg/L NAA+1.0 mg/L 2,4–D。根、莖和葉的愈傷均有褐變現象,且根的褐變出現的概率較多,但是褐變的量較少。
3.3? ?叢生芽的增殖培養
不定芽增殖生成叢生芽,叢生芽的增殖情況如下:濃度 1 和濃度 5 增殖較慢,且體積不大,說明增殖情況不好;濃度 2 和濃度 4 雖然增殖較好,但是其體積和濃度 3 相較而言,濃度 3的增殖情況更有優勢,綜合所知濃度 3 的增殖情況最好。濃度 3 的培養基配方為:MS+30 g 蔗糖+8 g 瓊脂粉+0.2 mg/L 6–BA+2.0 mg/L NAA[12]。
4? ?討論與結論
4.1? ?無菌苗生長
通過數據可知,染菌率為 0%,說明此消毒方法具有可操作性,具體操作步驟:酒精(75%)消毒 30 s→升汞(0.1%)消毒 8 min→無菌水清洗 3~5 次[13]。
出現不同的發芽率,且有的發芽率差距較大如組培瓶 1、2、3、4、5 和組培瓶 7;根系發達情況,葉子生長情況都不同,可能的原因包括以下5方面。
(1)有的種子可能經過消毒后在外暴露的時間較長。
(2)可能經過氯化汞時由于不能一次性把種子取出來,導致停留時間較長。
(3)可能種子本身存在問題。
(4)可能由于使用 pH 試紙調節 pH值,肉眼觀察會出現誤差,導致培養基的 pH值與理論值存在一定的誤差。
(5)可能是培養瓶沒有洗干凈,有雜物殘留。
以上原因都可能導致試驗結果與預期的結果有差距[14]。
4.2? ?太行菊組織愈傷誘導
從數據可以明顯看出:濃度 3、濃度 6 和濃度 9 誘導愈傷的情況最好,綜合誘導率和愈傷顏色、大小的來看,誘導愈傷的最合適培養基配方為:濃度 9(MS+8 g 瓊脂粉+30 g 蔗糖+2.0 mg/L 6–BA+1.0 mg/L NAA+1.0 mg/L 2,4–D)[15]。
若是大量誘導愈傷,也可以用濃度 3 和濃度 6 的配方:濃度 3(MS+8 g 瓊脂粉+30 g 蔗糖+1.0 mg/L 6–BA+1.0 mg/L NAA+1.0 mg/L 2,4–D);濃度 6(MS+8 g 瓊脂粉+30 g 蔗糖+1.5 mg/L 6–BA+1.0 mg/L NAA+1.0 mg/L 2,4–D)。
本試驗出現了褐化現象:植物組織本身釋放的褐色物質,使培養基變成褐色,從而使愈傷組織也變成褐色,最終導致植物組織死亡。發生褐化的原因錯綜復雜,主要由于植物本身的生理特性和培養基的環境變化[16]。另外,植物的年齡也會影響植物愈傷組織的褐化。植物的莖和段被切割后,切割口細胞中的酚類化合物是一種保護性物質,使切口不容易被其他物質侵染,但是有利有弊,這種酚類物質不穩定,會引發一系列連鎖反應:酚類化合物→醌類物(褐色)+水→其他酶失活→代謝紊亂→生長停滯→組織死亡[17]。
褐化現象是試驗中不愿意出現的,所以要解決此問題,可以根據褐化的因素來制定方案:如果是繼代保存時間過長,也會發生此類現象;如果是由于植物組織本身中的物質酚類化由于環境因素如培養基或者培養基中的某些物質使愈傷組織發生褐化,對于這種褐變采取適當的措施或者愈傷組織適應了環境的變化,褐化的情況會減輕或者褐化的情況不會發生[18]。徐振彪等將正在生長的愈傷組織轉移到含有NaCl 的培養基中,發現組織周圍尤其是接觸培養基部分發生褐變,但培養基中沒有看到擴散的褐變物質。當溫度升高時會使酶失活從而使愈傷組織發生褐化,酚類物質引發的一系列反應需要氧的參與,可以在培養基中加一些活性炭(抗環血酸)、抗氧化性等物質[19]。
4.3? ?叢生芽增殖
增殖快慢、芽高低不一樣的原因如下。
(1)可能是觀察 pH 試紙時肉眼看到的 pH 值與實際值存在誤差。
(2)培養皿可能沒有洗干凈,有雜物殘留。
(3)可能此次的培養基配方中激素加的量較少。

