鋁的活潑性實驗創(chuàng)新設計
鄭雅蘭
摘要: 為了使學生切實體驗單質(zhì)鋁的活潑性并感悟創(chuàng)新理念,對傳統(tǒng)儀器作巧妙改造后,將“鋁在空氣中氧化”實驗中的鋁條插于橡膠塞直立講桌使“毛刷”立體呈現(xiàn),再用抖落“白毛”的鋁條在懸于細口瓶熱水中的底部有洞小試管內(nèi)直接補充演示“鋁和熱水的反應”,實驗中清晰地看到白色沉淀產(chǎn)生,收集的氫氣也能安全點燃。這樣把兩個實驗連貫起來優(yōu)化了教學流程,提高了課堂實驗教學效果。
關鍵詞: 鋁的活潑性; 鋁和熱水的反應; 實驗改進
文章編號: 1005-6629(2020)02-0061-03
中圖分類號: G633.8
文獻標識碼: B
課堂演示實驗不僅是學生客觀地認識物質(zhì)的性質(zhì)及變化規(guī)律獲得化學知識的重要途徑,更是提高學生綜合素質(zhì),培養(yǎng)和發(fā)展學生觀察能力、思維能力、創(chuàng)新能力的重要方法和手段。高中教育階段是培養(yǎng)學生創(chuàng)新能力的重要時期,教師在課堂教學(特別是實驗教學)中不拘泥于課本、敢于創(chuàng)新設計并產(chǎn)生好的實驗效果,其意義就不僅局限于培養(yǎng)學生的認知能力,對于培養(yǎng)他們的創(chuàng)新意識、激發(fā)他們的創(chuàng)新熱情都有不可低估的作用。因此教師不僅是傳道、授業(yè)、解惑的啟蒙者,更是身教重于言教的創(chuàng)新觀念的踐行者。秉承這種觀念,將鋁的自然氧化及鋁和水反應兩個實驗連貫起來設計成一個新的課堂演示實驗,在此和大家分享,并作一些探討。
1? 問題的提出
上科版高中化學教材高二第八章第2節(jié)是“鋁和鋁合金的崛起”。教材中安排了“鋁在自然界的存在形式和冶煉方法”、“單質(zhì)鋁的物理性質(zhì)和用途”、“單質(zhì)鋁及化合物的性質(zhì)”[1]等多個知識點的內(nèi)容,其中單質(zhì)鋁性質(zhì)的學習是重點之一。《上海市高中化學學科教學基本要求》第99頁有一具體要求是“描述鋁與氧氣、水、氧化鐵反應的實驗現(xiàn)象,書寫相關化學方程式,歸納鋁的強還原性”[2]。明確要求描述鋁與氧氣、水反應的實驗現(xiàn)象,但教材中只安排了鋁的氧化實驗[3],并沒有安排鋁和水反應的實驗,這不利于學生認識鋁的強還原性(活潑金屬置換水中氫離子是其強還原性的重要表現(xiàn))。為了加強認識和理解,多數(shù)教師會利用學生已知的金屬活動性順序表及活潑金屬鈉置換水中氫離子產(chǎn)生氫氣的知識推演鋁和水反應的產(chǎn)物和現(xiàn)象。有少數(shù)教師還會嘗試做鋁和水反應的實驗,通常的做法是先用砂紙擦除鋁表面的氧化膜,然后插入試管內(nèi)蒸餾水中再加熱,觀察產(chǎn)生的氣泡等。這個實驗方案雖
簡單,但是實驗效果很差,通常看不到白色沉淀(氫氧化鋁)的生成,想要收集氣體做點燃試驗也較難做到。
那么,怎樣讓學生在課堂上能夠清楚地看到鋁和水反應產(chǎn)生的氣泡和難溶物,并且能夠?qū)a(chǎn)生的氣體收集、點燃?筆者結(jié)合多年的研究和實踐,設計了以下課堂教學過程和演示實驗,獲得了很好的教學效果。
2? 實驗方案
2.1? 實驗藥品及儀器
螺旋狀鋁條(比小試管略短)、課前灌裝在暖瓶中的煮沸自來水(或煮沸的3%~5%氯化鈉溶液)、10%硝酸汞溶液(或氯化汞溶液)、2mol/L氫氧化鈉溶液;500mL細口瓶(1個)、底部有小洞的小試管(1個)、完好的相同規(guī)格小試管(2個)、和小試管配套的單孔塞(單孔塞上配有橡膠管及尖嘴玻管)、止水夾(2個)、比小試管口徑大的橡膠塞(1個)、1000mL大燒杯(1個)
2.2? 實驗裝置
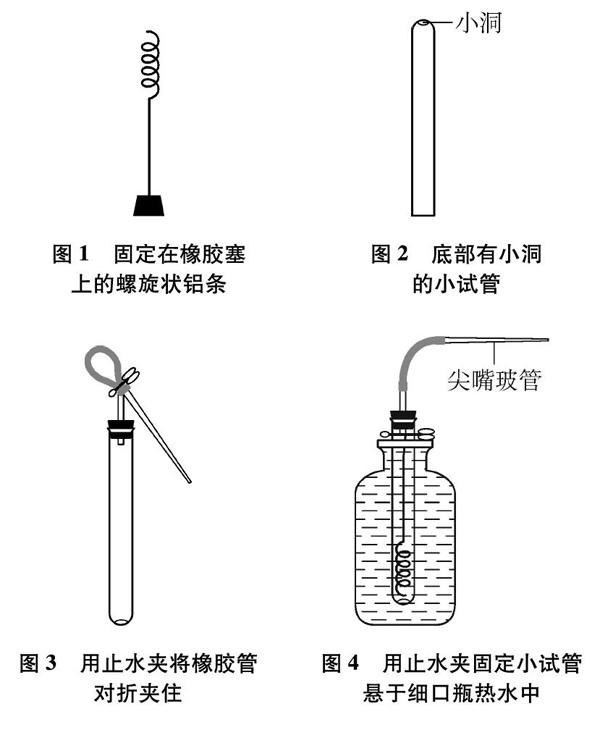
如圖1~圖4所示:
圖1? 固定在橡膠塞上的螺旋狀鋁條
圖2? 底部有小洞的小試管
圖3? 用止水夾將橡膠管對折夾住
圖4? 用止水夾固定小試管懸于細口瓶熱水中
2.3? 實驗步驟及現(xiàn)象
(1) 課前準備好底部有小洞的小試管(如圖2所示);1000mL大燒杯裝滿自來水備用;在試管架上準備好兩個小試管,分別盛有10%硝酸汞溶液(或氯化汞溶液)和2mol/L氫氧化鈉溶液待用(注: 液體液面距試管口1cm左右,防止插入鋁條后溶液溢出)。
(2) 如圖1所示,將螺旋狀鋁條的一端固定在橡膠塞上,再將該鋁條插于盛有2mol/L氫氧化鈉溶液的試管中(橡膠塞的作用是保證鋁條不會掉入堿液中),當試管中有大量氣泡產(chǎn)生時,取出螺旋狀鋁條在大燒杯的備用水中洗滌干凈,再迅速插入硝酸汞溶液(或氯化汞溶液)的試管中,引導學生觀察鋁條表面顏色的變化。
(3) 待鋁條表面變成灰黑色(約1分鐘),取出鋁條以插入的橡膠塞做底座直立于講桌A4白紙上(鋁條直立便于觀察,白紙便于氧化產(chǎn)物的收集,收集到的氧化鋁可用于后續(xù)氧化鋁的兩性實驗,這樣得到的氧化產(chǎn)物活性較好[4],在強酸、強堿中的溶解很迅速,溶解過程中沒有氣泡產(chǎn)生也印證了“汞齊化”鋁單質(zhì)長出來的“毛”是氧化鋁)。然后,教師邊講邊引導學生觀察氧化膜去除后鋁條在空氣中的自然氧化——毛刷現(xiàn)象[5]。
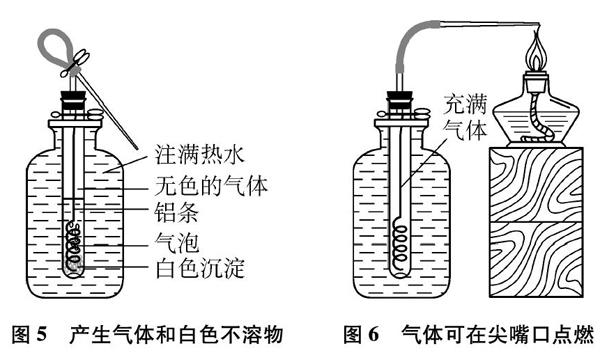
(4) (鋁單質(zhì)能夠在自然條件下氧化說明鋁較活潑,其活潑性還表現(xiàn)在它和水的反應)抖落鋁條表面的“白毛”,取下鋁條上的橡皮塞,將鋁條放入底部有洞的小試管中,塞上配套的單孔塞,然后在500mL細口瓶中注滿提前準備好的煮沸自來水(或3%~5%的氯化鈉溶液[6],不建議直接使用蒸餾水),再用止水夾夾住小試管的管口懸空固定于500mL細口瓶瓶口(如圖4所示)。待小試管中充滿熱水后,用止水夾將橡膠管對折夾住(如圖3所示)。
(5) 觀察細口瓶中的小試管: 鋁條表面有大量氣泡產(chǎn)生,液面下降,還不斷有白色沉淀產(chǎn)生(如圖5所示)。當小試管中液面不斷下降,氣體充滿小試管時(大約2~3分鐘),先點燃酒精燈,對準玻管尖嘴處,然后打開止水夾,可看到尖嘴處有火苗產(chǎn)生(如圖6所示)。
圖5? 產(chǎn)生氣體和白色不溶物
圖6? 氣體可在尖嘴口點燃
3? 實驗注意事項及相關說明
鋁活潑性實驗最關鍵的步驟是除去鋁條表面的氧化膜。首先,氫氧化鈉溶液不要過稀,溶解氧化膜要充分,等試管中有大量氣泡產(chǎn)生時再取出,快速放到大燒杯的備用水中洗去附著的堿液;然后,迅速放入硝酸汞溶液(或氯化汞溶液)[7]的試管中,在硝酸汞溶液中的浸泡時間必須掌握好,觀察鋁條表面變成暗灰黑色[8]即可(室溫下,時間控制在45秒至1分鐘之間最佳,時間不宜長,否則會影響鋁條和水的反應);最后,要等它的“毛”長出來脫落,觸感鋁條有點燙,再放入熱水中(鋁條在空氣中“長毛”時間大約兩分鐘,非常適合課堂邊講邊實驗)。
為了更利于課堂邊講邊實驗的時間把控,筆者做了多組對比實驗,發(fā)現(xiàn)水溫對產(chǎn)生氫氣的速率影響較大,一般控制水溫80℃以上,反應速率就比較快,大約2~3分鐘就能集滿一試管的氫氣(用自來水和4%的氯化鈉溶液反應速率相差無幾)。
另外,在較低溫度下“氯離子效應”[9]對該反應的速率影響很大。筆者用4%氯化鈉溶液和純凈蒸餾水控制50℃的水溫做了對比實驗,結(jié)果是4%氯化鈉溶液的反應速率比蒸餾水快許多,集滿一試管的氫氣大約需要12分鐘。而在50℃的條件下,鋁條與蒸餾水反應速率非常慢,20分鐘才收集了3毫升的氫氣,這也是實驗中不建議使用蒸餾水的原因(成本高且比自來水反應慢)。
4? 本實驗設計的創(chuàng)新點及意義
(1) 優(yōu)化了課堂實驗教學流程。將鋁單質(zhì)在空氣中的自然氧化“毛刷實驗”以及“鋁單質(zhì)和熱水的反應”兩個重要的性質(zhì)實驗結(jié)合起來,使課堂教學中演示實驗前后連貫、一氣呵成,教學內(nèi)容銜接得很好,使學生對鋁的金屬活潑性認識更加充分。而且“毛刷實驗”的產(chǎn)物還能為后續(xù)氧化鋁的兩性實驗提供活性較好的反應物。
(2) 實驗設計巧妙。①500mL細口瓶容積較大,裝滿熱水后實驗過程中無需再加熱,且水溫不易降低;②用底部有洞的小試管收集氫氣,從水位的下降可觀察到氣體的產(chǎn)生和排水集氣法的過程;③用生成“鋁汞齊”的方法破壞鋁條表面氧化膜,使其與水反應產(chǎn)生氣體的速率大大加快。
(3) 實驗操作簡單安全,現(xiàn)象明顯,便于推廣。實驗過程中使用有洞小試管,利用排水集氣法收集氣體產(chǎn)物——氫氣,保證了氫氣的純度,可以安全地點燃。還能夠清晰地觀察到不溶性物質(zhì)——氫氧化鋁的生成。實驗中所用儀器均為常規(guī)儀器,底部有洞的小試管和螺旋狀鋁條都不難加工,甚至可以在課堂上講解鋁的物理性質(zhì)時當場彎曲鋁條,使學生更直觀地認識鋁的硬度,一舉兩得。
(4) 實驗用時短、重復性好。本文設計的實驗方案集滿一試管的氫氣只需要2~3分鐘,非常適合邊講邊實驗的課堂教學。如果設計成探究實驗,需要多次收集氣體的話,只要再次將尖嘴玻管下端的橡膠管對折夾住,可立即觀察到小試管中液面下降,且后續(xù)產(chǎn)生氣體的速率會越來越快。
(5) 實驗教學的問題設計可根據(jù)教學情況收放自如,可以課堂討論也可以課后思考。例如鋁條為什么要彎成螺旋狀?鋁條表面除去氧化膜的辦法有哪些?哪個方法更方便?為什么教師要用“毛刷實驗”后的鋁條來做鋁和水的反應?這樣做有什么好處?(對于有些感興趣的學生還可以就“氯離子效應”[10]查找資料、對比、探究、討論)……這些問題的討論可促使學生將鋁在空氣中自然氧化的放熱,以及形成“鋁汞齊”的作用(除了破壞鋁表面形成致密氧化膜以外,還可能有電化學腐蝕加快反應速率)等知識點的復習和鞏固,通過問題討論把這些知識和原理有機地聯(lián)系起來,對培養(yǎng)和鍛煉學生發(fā)現(xiàn)問題、分析問題、解決問題的能力很有意義。
(6) 這個課堂實驗教學的創(chuàng)新設計對培養(yǎng)學生的創(chuàng)新意識和創(chuàng)新精神很有作用。該設計是在安全有保障、條件允許的情況下,把課本上“鋁在空氣中的氧化實驗”做了改進和拓展,并進行探究性教學。此類創(chuàng)新實驗教學的實施和體驗,不但使學生耳目一新,而且能讓他們體會到化學的魅力和創(chuàng)新的魔力。當創(chuàng)新意識不再是口頭的描述和期待,而是切切實實的感受和體驗時,創(chuàng)新的理念才會真正在學生的頭腦中生根發(fā)芽。
參考文獻:
[1][3]姚子鵬主編. 高級中學課本·化學·高中二年級第一學期(試用本)[M]. 上海: 上海科學技術出版社, 2007: 13~16.
[2]上海市教育委員會教學研究室. 上海市高中化學學科教學基本要求(試驗本)[S]. 上海: 華東師范大學出版社, 2017: 105.
[4][5][8]王程杰, 李桂林. 鋁片長毛實驗中幾個問題的解惑[J]. 化學教學, 2009, (4): 5~7.
[6][7][9][10]王程杰. 關注氯離子效應在中學化學實驗中的應用[J]. 化學教學, 2015, (12): 53~56.

