著-聚賴氨酸/淀粉抑菌膜的制備及性能檢測
邱肖華,吳依莎,朱政澤,張泛舟,陳銀瀅,余作龍,活潑
(浙江樹人大學生物與環境工程學院,浙江杭州310015)
隨著人們對食品包裝材料造成的食品安全和環境承受能力等問題關注,使安全、環保的食品包裝膜成為研究熱點,尤其是近年對可食性包裝膜研究較多。可食性包裝膜分為蛋白質類、多糖類、類脂類以及復合膜[1-3],采用天然多功能活性成分取代人工合成及傳統的單功能食品添加劑已成為國內外食品科學研究的新熱點[4-5]。其中淀粉基可食膜是以淀粉(starch film,St)(主要是直鏈淀粉)為基質,以多元醇(如甘油、山梨醇、聚乙二醇等)及類脂物質(如脂肪酸、單甘油脂、表面活性劑等)為增塑劑,少量動植物膠(如褐藻膠、瓊脂等)為增強劑制作而成[6]。淀粉基膜具有綠色環保、安全無毒、可生物降解等特點,是當今最具發展前景的材料之一。
著-聚賴氨酸(epsilon-poly lysine,PL)作為一種微生物源的天然防腐劑,可由微生物菌株Streptomyces albulus No.346 發酵制得[7],具有安全、高效、水溶性好、抗菌譜廣等優點[8]。PL 對革蘭氏陰性菌、革蘭氏陽性菌、酵母和霉菌都有抑制作用[9],是一種天然的抑菌劑[10]。
通過PL 對大腸桿菌、枯草芽孢桿菌和酵母菌的抑菌試驗,得出PL 對3 種菌的最小抑菌濃度(minimum inhibitory concentration,MIC),并參考獲得的MIC,制備不同濃度的PL/St 抑菌膜,以前期獲得的St膜配方為參考制膜,并進行抑菌性試驗,篩選出最佳的抑菌膜。對篩選出的抑菌膜進行性能檢測,并與St膜進行比較,為PL/St 抑菌膜在功能性包裝膜的應用領域提供參考。
1 材料和方法
以大腸桿菌、枯草芽孢桿菌、酵母菌等,3 種菌為研究對象,采用打孔法,以抑菌圈為指標,對PL 的抑菌性能進行研究。
1.1 材料和設備
1.1.1 試驗菌種
大腸桿菌(Escherichia coli)、枯草芽孢桿菌(Bacillus subtilis)和酵母菌(Yeast)。試驗菌種由浙江樹人大學微生物實驗室提供。
1.1.2 培養基
牛肉膏蛋白胨培養基:牛肉膏3 g,蛋白胨10 g,氯化鈉 5 g,瓊脂粉 20 g,水 1 000 mL,pH 7.0~7.2。
細菌基礎培養基(luria-Bertani,LB):蛋白胨 10 g,酵母膏 5 g,氯化鈉 10 g,瓊脂粉 20 g,水 1 000 mL,pH 7.0~7.4。
酵母膏胨葡萄糖瓊脂培養基(yeast extract peptone dextrose medium,YPD):葡萄糖 20 g,酵母提取物 10 g,蛋白胨 20 g,瓊脂粉 20 g,水 1 000 mL,pH 5.0。
1.1.3 材料和試劑
豌豆淀粉(食品級):煙臺東方蛋白科技有限公司;甘油(食品級):浙江杭州雙林化工試劑廠;海藻酸鈉(食品級):山東精協海洋科技發展有限公司;著-聚賴氨酸(食品級):南京軒凱生物科技有限公司;牛肉膏、酵母膏:北京雙旋微生物培養基制品廠;蛋白胨:南京茂捷生物科技有限公司;酵母提取物:合肥強盛生物科技有限公司;葡萄糖:廣東光華科技股份有限公司;氯化鈉:上海試四赫維化工有限公司;瓊脂粉:杭州木木生物科技有限公司,以上均為分析純。
1.1.4 儀器和設備
SW-CJ 超凈工作臺:蘇州凈化設備有限公司;GI54DW 高壓蒸汽滅菌鍋:美國Zealway Instrument Inc(致微)儀器有限公司;SPX-250B-Z 生化培養箱、BGZ-140 烘箱:上海博迅實業有限公司;PL303 電子分析天平:梅特勒-托利多儀器(上海)有限公司;QYC-2102C/KYC-1102C 搖床:上海福瑪設備有限公司;BCD-186KB 冰箱:青島海爾股份有限公司;TA.XT plus物性儀:北京微訊超技儀器技術有限公司;07HWS-2數顯恒溫磁力攪拌器、JHS-2/90 恒速數顯攪拌機:杭州儀表電機有限公司;MB45 鹵素水分儀:奧豪斯儀器(上海)有限公司;MCR102 流變儀:奧地利安東帕(中國)有限公司;BRUKER 紅外光譜儀:德國布魯克光譜儀器公司;JC2000D3 接觸角測量儀:上海中晨數字技術設備有限公司。
1.2 方法
1.2.1 菌懸液的制備
用接種環挑取2~3 環已活化培養24 h 的大腸桿菌、枯草芽孢桿菌和培養48 h 的酵母菌分別于無菌生理鹽水中制成菌體濃度為107cfu/mL~108cfu/mL 的菌懸液。
1.2.2 PL 溶液的配制
精確稱取 PL,分配配制成濃度為 0、0.25、0.5、0.75、1、2、4、8、16、32、64 mg/mL 的 PL 溶液,待用。
1.2.3 含菌平板的制作
分別配制牛肉膏蛋白胨培養基、LB 培養基、YPD培養基和素瓊脂。待所需物品及培養基滅菌后,在超凈工作臺中,先倒一層素瓊脂,大約5 mL。待其凝固后,放上牛津杯(牛津杯需在酒精燈火焰上快速過一下)。待培養基的溫度適宜后,倒入平板,用移液槍分別移取各上述菌懸液100 μL 加入其對應的培養基中,快速搖勻,制成混菌平板,并做好標記。靜置待培養基凝固后,小心拔出牛津杯,待用。
1.2.4 PL 的 MIC 測定
采用平板打孔法[11-13]。將配制好的PL 溶液,用移液槍移取不同濃度的PL 溶液100 μL 于平板的孔內(每個平板3 個孔,每個濃度兩個平行),每種培養基增加一組無菌生理鹽水為空白對照。將平板放入恒溫培養箱中培養,大腸桿菌與枯草芽孢桿菌置于37 ℃,酵母菌置于30 ℃,培養24 h~48 h 后,觀察試驗結果。
1.2.5 PL/St 抑菌膜的制備
100 mL 水溶液中添加 11 g 豌豆淀粉、1.2 mL 甘油0.4 g 海藻酸鈉,在 95 ℃下,300 r/min 攪拌 30 min[14],待淀粉糊化后,加入抑菌劑PL,攪拌10 min,經真空脫氣工藝脫氣后,流延鋪膜于鋼板上,并在50 ℃烘干,揭膜,儲存待用。
1.2.6 PL/St 膜抑菌性研究
分別配制3 種培養基,加熱融化并分裝入三角瓶中,將培養皿、涂布棒等物品包好后一起滅菌,然后在超凈工作臺中倒平板并做標記,冷卻。用移液槍分別移取各上述菌懸液10 μL 加入對應的培養基中,涂布均勻,靜置使其滲入。用打孔器將制備的不同濃度的抑菌膜打成小圓片(大約3 mm),小心放置于涂有菌的平板上,在恒溫培養箱中,培養24 h~48 h,觀察平板抑菌圈的大小,衡量膜的抑菌性[15]。
1.2.7 膜厚度測定
選擇平整、均勻、無孔洞、無皺褶的膜,用螺旋測微器(精度0.01 mm)測樣品的4 個頂點和中心點上的厚度,然后取5 個值的平均值,即為膜的厚度,單位為mm[16]。
1.2.8 抗張強度與斷裂延伸率測定
按照GB/T 1040.3-2006《塑料拉伸性能的測定第3 部分:薄塑和薄片的試驗條件》[17],將樣品裁成長10 cm,寬0.5 cm 的長條,用物性儀測定膜的拉伸強度(TS)和斷裂延伸率(E),每組測垂直方向橫縱各3 條,共6 個平行樣,計算平均TS與E。標距為50 mm,試樣速度為100 mm/min。

式中:TS為抗拉強度,MPa;F 為膜所受拉力,N;S為膜的橫截面積,m2。

式中:E 為斷裂延伸率,%;L0為試樣原始標準距離,mm;L 為試樣斷裂時標準距離,mm。
1.2.9 傅立葉紅外光譜分析(fourier transform infrared spectroscopy,FTIR)
剪一小片制得的抑菌膜樣品,然后進行紅外光譜掃描,考察膜的組分對膜結構的影響。采集條件為:25 ℃下,以 4 cm-1分辨率,在 500 cm-1~4 000 cm-1波數范圍內,掃描32 次,得紅外光譜圖。
1.2.10 流變性能
將糊化后的膜液倒入流變儀中,在流變儀上裝cp轉子,設定測得溫度為80 ℃,按設定程序進行操作,測得流變曲線。其中,黏度曲線模型為:
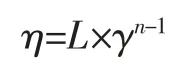
式中:η 為黏度,Pa·s;γ 為剪切速率,s-1;k 為稠度系數,與黏度相關的常數;n 為流動指數。
1.2.11 水蒸氣透過系數的測定
透濕率即在規定的溫度、相對濕度環境中,在單位壓差下、單位時間內透過單位面積和一定厚度膜的水蒸汽量。根據塑料薄膜及片材透水蒸汽試驗方法的原理和步驟,采用GB1037-1988《塑料薄膜和片材透水蒸氣性試驗方法杯式法》[18]擬杯子法,具體方法為:在25 ℃條件下,于稱量瓶中放入無水氯化鈣,氯化鈣使用前應粉碎,使其粒度為2 mm,并在200 ℃條件干燥2 h,冷卻,然后稱取一定量的氯化鈣于稱量瓶中。選平整、均勻、無孔洞、無皺褶的膜,測量其厚度后,用熔化的石蠟將其封于口上,然后放入相對濕度為100%的干燥器中,測量溫度為25 ℃,每隔24 h 后取出稱重,連續測量一周。每一組做至少3 個平行試驗,結果以每組的算術平均值表示。

式中:WVP(water vapor permeability)為透水系數,g·mm/m2·d·KPa;Δm 為穩定的質量增量,g;d 為膜的厚度,mm;A 為有效測定面積,m2;t 為測量時間間隔,d;ΔP 為試樣兩側的水蒸汽壓差,KPa。
1.2.12 透油性研究
取約5 mL 色拉油置于試管中,以待測膜封口,倒置于濾紙上,放置一周,每天稱量濾紙質量的變化,按下式計算透油系數(Poil)[19]:

式中:Poil 為透油系數,g·m/m2·d;Δm 為濾紙質量的變化,g;d 為膜厚,mm;A 為膜的面積,m2;T 為放置時間,d。
1.2.13 接觸角
假定不同的界面間力可用作用在界面方向的界面張力來表示,則當液滴在固體平面上處于平衡位置時,這些界面張力在水平方向上的分力之和應等于零,即:

式中:γS/A 為固-氣界面張力,N;γL/A 為液-氣界面張力,N;γS/L 為固-液界面張力,N;θ 為液體與固體間的界面和液體表面的切線所夾(包含液體)的角度,°。
液體與固體間的界面和液體表面的切線所夾(包含液體)的角度,稱為接觸角。接觸角是反應物質與液體潤濕性關系的重要尺度,當θ=0,完全潤濕;當θ<90°,部分潤濕或潤濕;當 θ=90°,是潤濕與否的分界線;當 θ>90°,不潤濕;當 θ=180°,完全不潤濕。
2 結果與分析
2.1 PL的MIC
著-聚賴氨酸對3 種菌的最低抑菌濃度見圖1。

圖1 ε-聚賴氨酸對3 種菌的最低抑菌濃度Fig.1 MIC of PL solution for different microorganisms
圖1 試驗結果表明,PL 對3 種菌都有明顯的抑菌作用,但對 3 種菌的 MIC 不同。PL 濃度為 1 μg/mL 時,對大腸桿菌表現出抑菌作用;PL 濃度為2 μg/mL 時,對枯草芽孢桿菌和酵母菌表現出抑菌作用。
PL 對大腸桿菌、枯草芽孢桿菌和酵母菌均有良好的抑菌效果。不同著-聚賴氨酸濃度的膜對3 種菌的抑菌圈直徑見圖2。

圖2 不同ε-聚賴氨酸濃度的膜對3 種菌的抑菌圈直徑Fig.2 The inhibition zone diameter of films with different concentrations of PL to different microorganisms
根據圖2 可得,對大腸桿菌的抑菌效果最佳,枯草芽孢桿菌和酵母菌其次。PL 的抑菌機理在于破壞微生物的細胞膜結構,造成細胞壁與細胞質分離,菌體塌陷,細胞質溢出等現象,破壞菌體正常生理代謝,引起細胞的物質、能量和信息傳遞中斷,與細胞內部物質發生作用,破壞細胞核心,造成紫外吸收物溢出,最終導致細胞死亡[20]。在3 種菌中,產生差異主要原因是細胞壁的不同厚度和組分造成。
2.2 PL/St膜的抑菌性
含著-聚賴氨酸的St 膜最低抑菌濃度見圖3。

圖3 含ε-聚賴氨酸的St 膜最低抑菌濃度Fig.3 MIC of St films with different concentrations of PL to different microorganisms
從圖3 抑菌性結果來看,濃度為32 mg/g 的PL 抑菌膜對3 種菌有微弱的抑菌性。濃度為64 mg/g 的PL抑菌膜對3 種菌都有著明顯的抑菌性,抑菌圈的環形區域較大,說明該濃度抑菌膜具有良好的抑菌效果。單一的St 膜并不具備抑菌效果,而在淀粉糊化后,加入PL 作為抑菌劑,能對St 膜的抑菌效果得到改善,使其具有抑菌性。PL/St 抑菌膜的抑菌效果,隨著PL 的濃度增大而增強。
PL/St 膜的濃度為64 mg/g 時,對大腸桿菌、枯草芽孢桿菌和酵母菌都有明顯的抑菌效果,且抑菌性較強,但和PL 的抑菌性相比,其抑菌膜的濃度提高較大,原因是PL 溶液能較好地與培養基接觸并滲透到培養基中,而膜只有表面和邊緣接觸,導致MIC 提高較大。選用濃度64 mg/g 的抑菌膜來進行性能檢測,并與St 膜進行對比。
2.3 膜性能檢測
2.3.1 抗拉強度和斷裂延伸率
抗拉強度和斷裂延伸率見圖4。

圖4 抗拉強度和斷裂延伸率Fig.4 Tensile strength and elongation
如圖4 結果表明,兩種膜相比,St 膜的抗拉強度(Ts)較好,PL/St 膜的斷裂延伸率(E)有所提高。原因在于所用著-聚賴氨酸的分子量只有5 000 Da,而淀粉的分子量達到了幾百萬,在攪拌的過程中,PL 能呈現分子狀態[21],能較好的進入淀粉分子的間隙之中,降低產品的剛性,增加其的柔韌性,起到松弛大分子的作用,從而使Ts 降低、E 增加。
2.3.2 水蒸氣透過率
水分透水速率和水分透過系數見圖5。

圖5 水分透水速率和水分透過系數Fig.5 Water vapor transmission rate and water vapor permeability
如圖5 研究結果表明,St 膜和PL/St 抑菌膜的水蒸氣透過率和水蒸氣透過系數都較大,說明St 膜和PL/St 抑菌膜的阻濕性能較差,PL/St 抑菌膜的透水速率與透水系數均比淀粉膜的要大,原因是由于PL 是親水性的陽離子多聚物,還有大量的極性氨基酸,具有較強親水性,著-聚賴氨酸分子分散在淀粉分子中間,增強了水分的滲透作用,故PL/St 抑菌膜的阻濕性要比淀粉膜差。
2.3.3 透油性
試驗過程中,通過稱量濾紙片的質量來判斷透油性。膜的透油性見圖6。

圖6 兩種膜的透油性Fig.6 Oil permeability of two different films
St 膜和PL/St 抑菌膜第2 天濾紙片的重量與第1天相比,都稍有下降,原因可能是濾紙本身水分含量會因為環境中水分濕度的改變而改變,之后幾天濾紙片的重量沒有太大的的變化。可以認為St 膜和PL/St抑菌膜的透油性為0。試驗結果表明,St 膜和PL/St 抑菌膜都有著非常好的阻油性。
2.3.4 FTIR 分析
膜的紅外光譜分析見圖7。
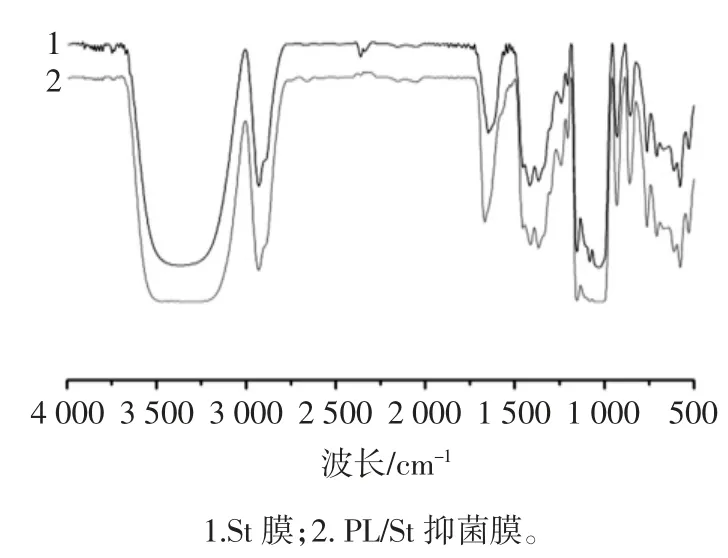
圖7 膜的紅外光譜分析Fig.7 FTIR spectra of different films
從文獻[22]可知,淀粉在 3 360、2 928、1 646 、1 021 cm-1處有特征吸收峰。PL 在 3 382、3 362、3 081、1 633、1 535 cm-1處有特征吸收峰[23]。3 460 cm-1處為-OH 的振動吸收峰,2 938 cm-1處為C-H 鍵的伸縮振動峰,1 210 cm-1處為C-O 伸縮振動吸收峰。1 100 cm-1處為C-O-C 的伸縮振動吸收峰。由于添加抑菌劑等小分子質量分數較小,對質量比較高的大分子淀粉分子的作用力影響較小,紅外光譜分析分子間較弱的相互作用力的表現較弱。
2.3.5 流變性能
膜的流變性能檢測見圖8。

圖8 膜的流變性能檢測Fig.8 Rheological curve of different film fluids
如圖8,當樣品膜液糊化完成后,隨著剪切速率的增大,膜液的粘度經過先平穩后急劇下降再緩慢下降等過程,說明在0.3 s-1時,膜液發生剪切變稀現象,具有非牛頓流體特性。由于抑菌劑的添加量較少,與淀粉膜液相比,流變性有一定差異,但總體流變性基本一致。
2.3.6 接觸角
St 膜液和PL/St 膜液的接觸角見圖9。

圖9 兩種膜液的接觸角Fig.9 Contact angle of two different film fluids
如圖9 所示,經過接觸角測量儀的測量,得出的數據結果為:淀粉膜液的接觸角為123.19°,PL/St 膜液的接觸角為125.61°。從試驗結果可以得出,St 膜液和PL/St 膜液的接觸角都較大,揭膜的難易程度相差較小,都比較容易揭膜。
3 結論
本文研究PL 的抑菌性并借鑒前期的制膜方法對PL 加入到St 膜中的各種性能進行研究,結果表明:PL對大腸桿菌、枯草芽孢桿菌和酵母菌的MIC 分別為1、2、2 μg/mL;St 膜中加入抑菌劑 PL 對 St 抑菌膜的抑菌性有著較好效果,濃度為64 mg/g 的PL/St 膜對大腸桿菌、枯草芽孢桿菌和酵母菌有著明顯的抑菌作用;PL/St 抑菌膜與St 膜相比,抗拉強度下降,但斷裂延伸率有所提升。PL/St 膜與St 膜的阻濕性均較差,均有較好的阻油性;力學性能測試、紅外表征、流變性和接觸角檢測表明添加少量的PL 對St 膜性能影響較小。

