乙酸異丁酯與甲醇酯交換反應動力學
王 坤
(湖南中創化工股份公司,湖南 岳陽 414000)
異丁醇是一種重要的基礎化工原料,可用作有機合成的原料,用于制造石油添加劑,抗氧劑、2、6-二叔丁基對甲酚增塑劑、合成橡膠、人造麝香和合成藥物等,還可作為高級溶劑、萃取劑等。其酯類衍生物如醋酸異丁酯、丁酸異丁酯、乳酸異丁酯等在涂料行業中可作為溶劑使用。異丁醇還被廣泛用作硝酸纖維素漆的助溶劑,以增加其光澤和流動性,并防止其褪色[1]。乙酸甲酯在工業上主要用于醫藥、涂料、膠粘劑、油墨、皮革生產過程中的溶劑,聚氨酯泡沫發泡劑、天那水等[2]。
目前,異丁醇主要來自于丙烯羰基化生產丁/辛醇裝置副產的異丁醛加氫。丙烯羰基合成法制得正、異丁醛,加氫成正、異丁醇,該路線產物中有多種同分異構體,如正丁醛與異丁醛或者正丁醇與異丁醇,產物分離難度較大[3]。目前國內外研究較多的制備異丁醇的方法是以合成氣為原料制備甲醇、異丁醇的工藝路線,但是CO加氫合成低碳醇的過程中會伴隨生成CO2、烴類、酮類等副產物,目前該技術的難點是設計出高選擇性、高活性的催化劑,目前的催化劑還不能滿足工業生產的要求[3]。針對以上合成異丁醇的方法存在的問題,提出了以乙酸異丁酯和甲醇為原料,通過酯交換生產異丁醇,副產乙酸甲酯的方法。已有的文獻報道均表明反應精餾技術可以有效地提高酯交換反應的轉化率,為了提高產物的收率,主要是采用反應精餾的方法進行酯交換反應[4]。
目前的文獻報道顯示陽離子交換樹脂作催化劑用于酯交換反應,反應效果較好,但是該動力學研究目前尚無人報道。本文對乙酸異丁酯與甲醇酯交換的反應動力學進行了研究,考察了反應溫度,催化劑濃度,醇酯比等條件的影響,建立了反應動力學模型,為該反應的反應精餾塔的設計模擬、工藝優化等提供理論依據。
1 實驗與方法
1.1 實驗原料
乙酸異丁酯,分析純,湖南匯虹化工試劑有限公司;甲醇,分析純,湖南匯虹化工試劑有限公司;醋酸甲酯,分析純,湖南匯虹化工試劑有限公司;異丁醇,分析純,阿拉丁試劑有限公司;A-16陽離子交換樹脂。
1.2 實驗方法和步驟
實驗室在間歇攪拌釜中進行,反應器為250mL三口燒瓶,中間采用機械攪拌控制轉速,機械攪拌轉速0~2000 r/ min,反應器的兩側分別裝有溫度計和取樣口。實驗溫度采用恒溫水浴控制,控制精度為±0.5℃[5]。
實驗開始時開啟恒溫水浴槽,稱取一定量的乙酸異丁酯和催化劑樹脂,加入到三口燒瓶中,開啟機械攪拌器,然后將甲醇放入到恒溫水浴槽中預熱,待二者都達到指定的溫度后,將甲醇迅速加入到三口燒瓶中。以甲醇的加入時間為反應開始時間,此后每隔一定時間取樣分析,當反應液內各組分濃度趨于不變時,表明反應達到平衡,停止實驗[5]。
1.3 分析方法
采用島津GC2010氣相色譜儀進行樣品定性定量分析,采用校正面積歸一法進行定量。色譜操作條件:FID檢測器;進樣口溫度:250℃,檢測器溫度:250℃,載氣:N2,色譜柱型號 HP-FFAP,30m×0.25mm×0.25μm,起始柱溫40℃保持3min,5℃/min升到100℃,再以15℃/min升至205℃。
2 實驗結果和討論
2.1 外擴散的影響
對于間歇攪拌釜式反應器,一般來說外擴散的影響隨著攪拌速率的增大將逐漸減少直至可以忽略[6]。為確定適宜的攪拌速度,可采用不同的轉速重復進行同一實驗,若經過相同的反應時間,反應轉化率不再隨攪拌轉速改變,說明外擴散的影響己基本消除[6]。催化劑粒徑0.6~0.8 mm,其它工藝條件為溫度75℃,醇酯物質的量比為2∶1,催化劑用量為乙酸異丁酯質量的12%,改變攪拌速度并計算不同攪拌速度下甲醇轉化率,實驗結果見圖1。從圖1可知,攪拌速率從400 r/min增至600 r/min時,甲醇的轉化率增大;當攪拌速率從600 r/min增至800 r/min時,甲醇的轉化率幾乎無變化。說明當實驗的攪拌速率大于600 r/min時,反應的外擴散影響可以忽略。
2.2 內擴散的影響
影響內擴散的因素中最顯著的是催化劑顆粒的大小。篩選幾種不同粒徑范圍的催化劑,分別用這幾種不同粒徑范圍的催化劑在同等實驗條件下進行實驗,如果這幾種粒徑范圍的催化劑的催化效果基本是相同,則可認為實驗中所用粒徑范圍的樹脂可以忽略其內部傳質阻力[6],內擴散影響基本消除。在攪拌速率為600 r/min,反應溫度 75℃,醇酯物質的量比為2∶1的條件下,催化劑用量為乙酸異丁酯質量的12%,考察不同粒徑范圍的催化劑對甲醇轉化率的影響,從圖2的結果中可知,不同粒徑范圍下的甲醇反應速率相差很小。說明當催化劑粒徑小于0.8 mm時,反應的內擴散影響基本可忽略。

圖1 轉速對甲醇轉化率的影響

圖2 催化劑粒徑對甲醇轉化率的形響
2.3 溫度的影響
溫度是影響化學反應速率的一個最敏感的因素,一般來說,化學反應速率隨溫度的升高而增加[6]。在催化劑粒徑0.6~0.8mm,攪拌速率600 r/min,催化劑用量為乙酸異丁酯質量的12%,醇酯物質的量比2∶1的條件下,考察反應溫度對甲醇轉化率的影響。由圖3的實驗結果可知,反應溫度升高,反應速率加快,符合可逆吸熱反應的規律。

圖3 溫度對甲醇轉化率的影響
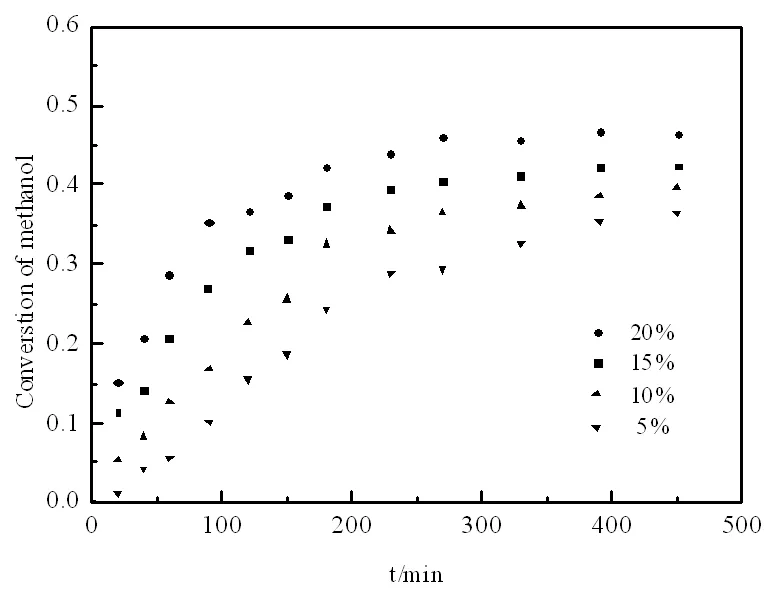
圖4 催化劑用量對甲醇轉化率的形響
2.4 催化劑用量的影響
在攪拌速率為600 r/min,醇酯物質的量比為2∶1、反應溫度為72℃的條件下,考察實驗中催化劑加入量對甲醇轉化率的影響。
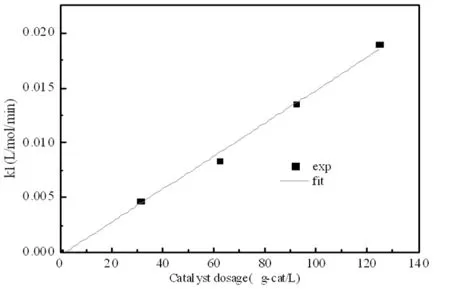
圖5 催化劑質量分數對正反應速率的影響
從圖4的結果中可知,反應速率隨著催化劑量的增加而逐漸加快,達到平衡所需要的時間逐漸縮短。反應中的催化劑濃度影響阿倫尼烏斯方程中的指前因子A,從而影響反應速率常數k,為描述催化劑量與反應速率常數的關系,將催化劑濃度與正反應速率常數作圖[6]。由圖5可知:正反應速率常數與催化劑用量呈線性關系。 k1=1.5059×10-4mcat
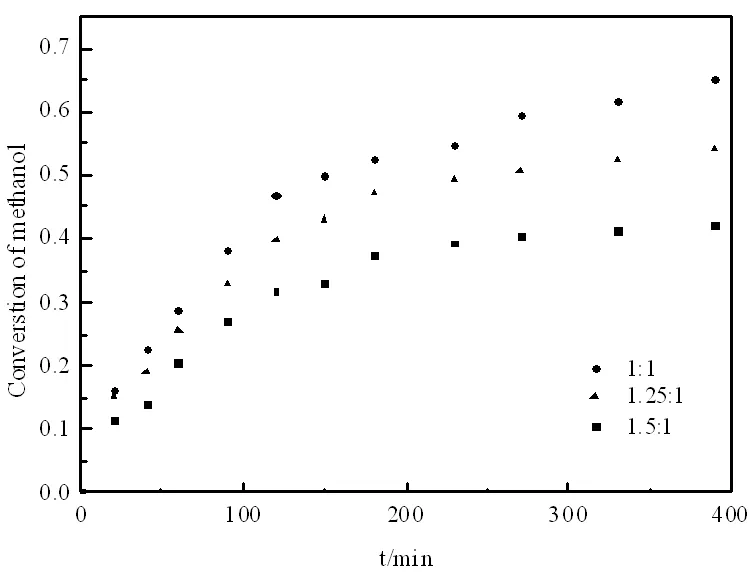
圖6 醇酯物質的量比對甲醇轉化率的影響
2.5 原料醇酯物質的量比的影響
在其它條件為攪拌速率為600 r/min,反應溫度75℃,催化劑用量為乙酸異丁酯質量的12%,考察原料醇酯物質的量比對甲醇轉化率的影響。從圖6中可知:甲醇的平衡轉化率隨著醇酯物質的量比的減小而逐漸提高。
3 動力學模型
3.1 動力學反應級數
以A-16陽離子交換樹脂為催化劑的該酯交換反應為液固非均相催化反應,包括反應物從液相主體擴散到催化劑外表面,再沿外表面擴散到內表面,在催化劑內表面上吸附并反應,反應產物從內表面上脫附并擴散到外表面,再由外表面擴散到液相主體[6]。在忽略內、外擴散影響的前提下,實際反應過程僅受吸附、表面反應和脫附的控制[7]。該反應是可逆反應,正反應為甲醇和乙酸異丁酯反應生成異丁醇和乙酸甲酯,逆反應則相反。
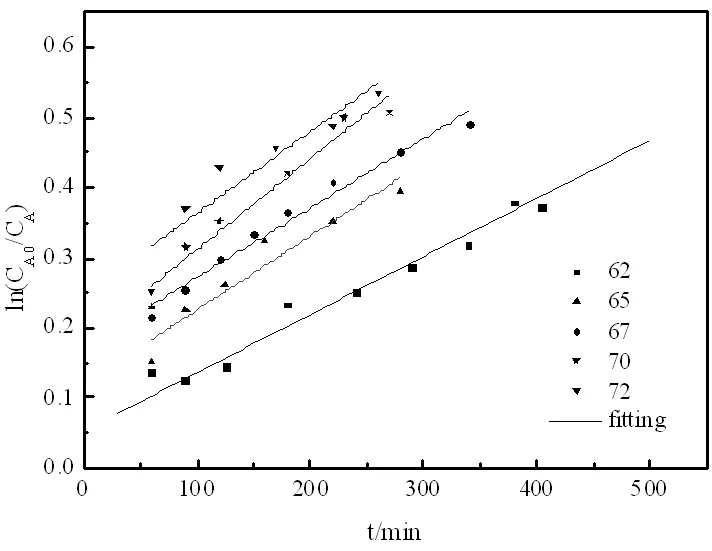
圖7 甲醇的圖

逆反應級數的確定,等物質的量的乙酸甲酯與異丁醇在75℃條件下實驗,計算得到數據作圖如圖9。
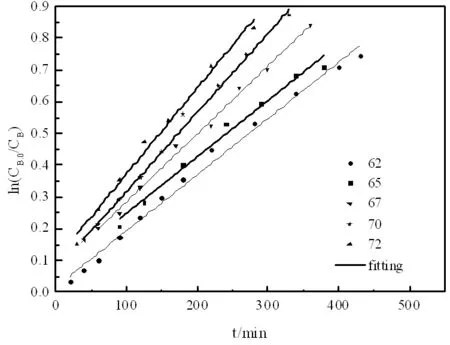
圖8 乙酸異丁酯的圖
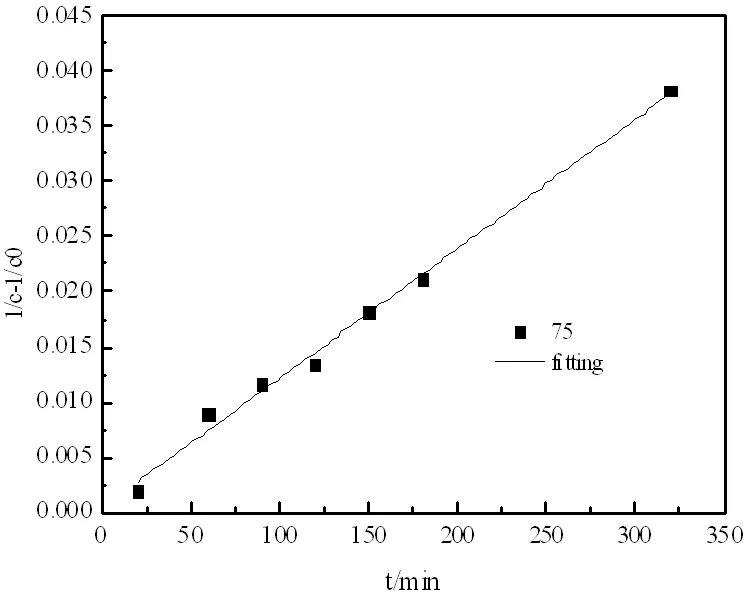
圖9 逆反應的圖
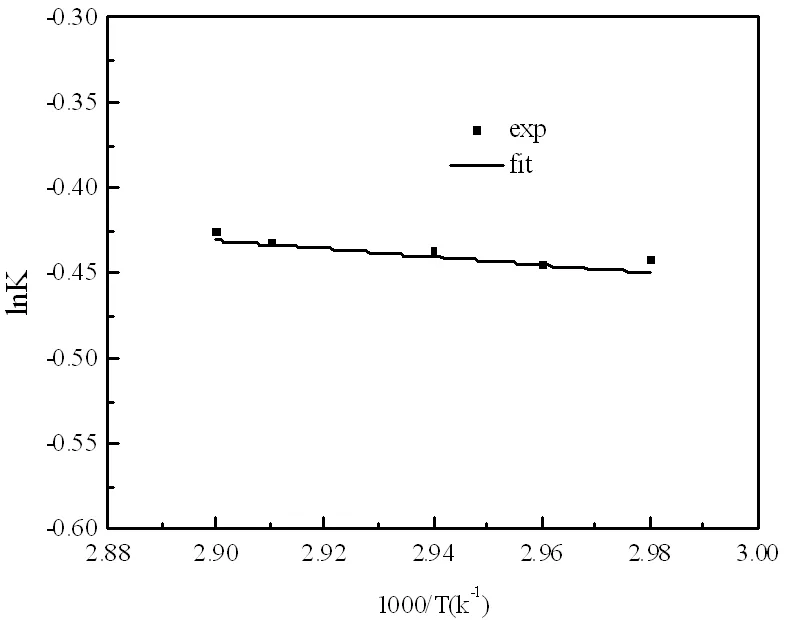
圖10 反應平衡常數與溫度的關系圖
3.2 動力學方程的計算
從以上動力學反應級數的分析可知:該酯交換反應為可逆二級反應。因此,乙酸異丁酯與甲醇酯交換的反應速率可以用擬均相模型描述為:
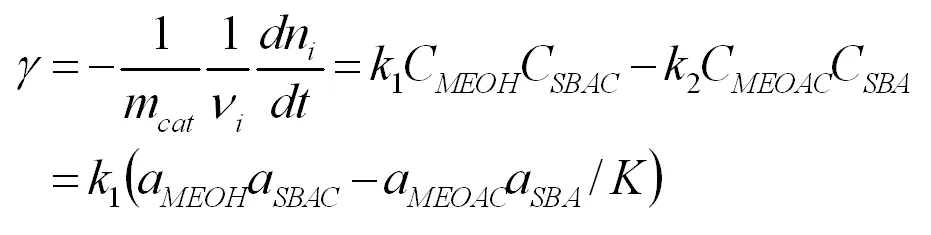
其中K為反應平衡常數,反應平衡常數可以由混合物的反應平衡組成得到。
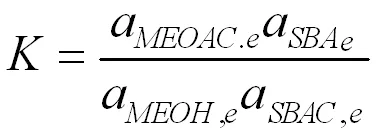

通過計算得到各溫度下的反應速率常數k,根據阿倫尼烏斯方程,對lnk與1/T進行線性回歸,見圖11。

圖11 反應速率與溫度的關系
正逆反應速率常數k1和kz的值可用阿倫尼烏斯方程描述如下,它是溫度和催化劑用量的函數:

通過計算得到正逆反應均為二級反應,通過計算得到正逆反應的指前因子和活化能見下表:

反應iAi/(L/mol/min/g-cat)Ea,i/(J/mol)正反應12.78×10462276逆反應-12.23×10459956
得到該酯交換的動力學方程為:
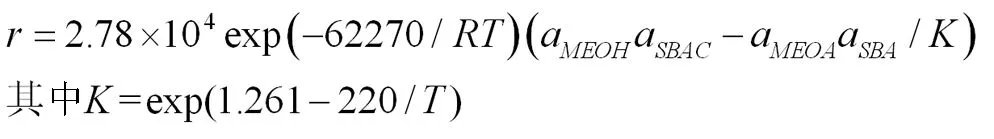
4 結論
本文研究了以陽離子交換樹脂作為催化劑,乙酸異丁酯與甲醇酯交換反應的動力學,得到如下結論:
(1)乙酸異丁酯與甲醇的酯交換反應,正逆反應均為二級反應, 正逆反應的活化能分別為 Ea1+=42.276 kJ/mol 和 Ea1=39.956 kJ/ mol。
(2)反應平衡常數與溫度的方程為 ,反應平衡常數隨溫度的升高逐漸增大,該反應為吸熱反應。
(3)乙酸異丁酯與甲醇酯交換的動力學方程為:

