基于299例結直腸癌異時肺轉移患者建立的預后評估模型
李春香 劉恒昌 趙志勛 關旭 姜爭
結直腸癌(colorectal cancer,CRC)的治療結果取決于遠端轉移和局部復發,在接受根治性切除的CRC患者中,仍然有10%~20%發生肺轉移[1-3]。盡管新型化療方案不斷涌現,手術技術持續發展,如靶向治療和胸腔鏡技術等, CRC肺轉移患者的預后仍不樂觀[4-5]。
CRC患者的預后主要取決于是否出現切除后原位復發或遠處復發[6-7]。為了最大限度從治療中獲益,人們致力于研究高復發風險患者的特征。許多已發表的回顧性研究記錄了發達國家CRC肺轉移患者的臨床和病理特征及治療模式[8-10],并且發現了幾種可能導致治療失敗的臨床病理因素。然而,來自發展中國家的肺轉移患者腫瘤特征和預后信息相對較少。亞洲的CRC肺轉移患者的臨床病理特征與世界其他地區不盡相同[11]。由于社會經濟條件的限制,大多數Ⅳ期CRC患者無法接受標準化治療,特別是一些肺轉移灶少的患者,這對于CRC同時性肺轉移的患者是不利的。
在本項單中心的回顧性研究中,我們收集了近20年來患有CRC異時性肺轉移患者的臨床和病理學資料。本研究的重點是闡明影響預后和治療決策的因素,確定潛在的預測因素并構建一個簡單的模型來評估肺轉移的風險。
材料與方法
一、一般資料
連續收集1984年1月至2011年2月期間在哈爾濱醫科大學附屬第二醫院接受了CRC肺轉移治療的484例患者的臨床病理資料,并簽署知情同意書。在排除切緣狀態或病理報告不明患者(n=18)、無完整隨訪記錄患者(n=13)和同時肺轉移患者(n=154)后,最終有299名患者納入本研究。
肺轉移的選擇標準:對于存活患者,組織活檢或細針穿刺活檢確認診斷;對于無法進行細胞學或組織學診斷的患者,化療后密切隨訪和/或CT掃描的動態變化以確保診斷正確,結直腸癌多學科治療團隊對此進行討論,其中包括至少一名專業放射科醫師;所有切除的標本均經病理證實為CRC異時肺轉移。
二、隨訪
隨訪監測包括血清癌胚抗原(carcinoembryonic,CEA)水平、每3個月進行一次的胸部X線檢查、每6個月進行一次胸部CT掃描,持續5年。根據患者的病情和原發癌切除的間隔,每6至12個月進行一次腹部CT掃描和結腸鏡檢查。
三、統計學分析
無病間期(disease-free interval,DFI)為手術日期到首次發現肺部轉移日期。總生存期(overall survival,OS)為初始手術日期到死亡或最后隨訪日期。通過Kaplan-Meier方法構建生存曲線,并且將單變量存活分布進行比較。對所有可能預測DFI和OS的因素進行單變量分析,然后將在單變量分析中發現的因素進行多變量分析(Cox比例風險模型)。
為構建評估分類/連續變量合適模型,應用多變量邏輯回歸來評估所有分類變量對結直腸癌風險的影響,并且使用每個獨立變量的系數構建邏輯函數。建立評分系統。通過受試者特征(ROC)曲線分析評估建立的評分系統的性能,并計算曲線下面積(AUC)以檢測預測準確性。為創建包括所有獨立預測變量的風險評估模型,使用等高線圖來預測個體風險。P<0.05被認為差異具有統計學意義。所有統計分析均使用統計程序Stata 8.0版(Stata Corporation,College Station,TX,USA)進行。
結 果
一、患者和腫瘤特征
患者手術時中位年齡為55歲(25~85歲),以男性為主(58.5%),大多數原發腫瘤位于直腸(74.9%)。病理結果顯示114例(38.1%)患者淋巴結陽性,35例(11.7%)肺標本陽性或縱隔淋巴結轉移。299例患者原發灶切除后中位生存期為23個月。切除的肺轉移瘤的平均直徑為2.58 cm。僅11例患者(3.7%)接受了轉移灶切除術。289例患者(96.7%)進行了化療,其中268例患者是原發灶切除后6個月內接受輔助化療,137例患者在確診轉移后接受輔助或新輔助化療。29名患者接受新輔助化療,其中,4名患者初始無法切除,新輔助化療后轉為可切除。
患者中位總生存時間為37個月。大多數肺轉移發生在隨訪的前5年內,手術后OS達到14.5年(圖1A)。3年、5年和10年DFI分別為27.5%(95%CI21.8%~33.6%),8.7%(95%CI5.5%~12.9%)和0.9%(95%CI0.2%~3.0%)。
二、預后因素分析
單變量分析表明,與DFI密切相關的因素是年齡(P=0.040)、病理分期(P<0.001)、化療(P=0.032)和原發灶的手術R分類(P=0.015)。腫瘤殘留、老年和分期較晚是肺轉移發生的風險因子,沒有接受化療的患者的DFI略高于其他患者。當在Cox模型中輸入四個變量作為協變量時,手術時患者年齡(HR:1.371,P=0.014)、病理分期(HR:1.115,P<0.001)、化療(HR:1.735,P=0.005)和原發灶的手術R分類(HR:1.181,P=0.049)是DFI的獨立影響因素。性別、原發癌部位或CEA水平等不影響DFI(P>0.05)。見表1。
影響OS的關鍵因素是肺門或縱隔淋巴結轉移(P=0.015),轉移瘤切除術(P=0.018)和DFI(P<0.001)。與影響DFI的因素相比,年齡并不是OS的影響因素。進一步多變量分析顯示,轉移灶是否切除影響患者的OS和DFI,而肺門或縱隔淋巴結轉移不是獨立的預后因素。見表2。
三、復發預測模型的建立與評價
除化療和腫瘤殘留外,老年和原發腫瘤分期與轉移風險增加有關(圖1B)。風險模型中的線性變量——年齡對預后具有影響,但是原發灶手術R分類、病理分期和化療與CRC復發風險具有非線性關聯。多變量邏輯回歸用于創建評估系統,評估這些變量的影響。得分估計為R;R=eL/(1+eL),其中該值通過多變量邏輯回歸分析得出,具體數值見表3。
L的公式:L=0.937+0.040×R分類+0.016×病理分期+(-0.129)×化療
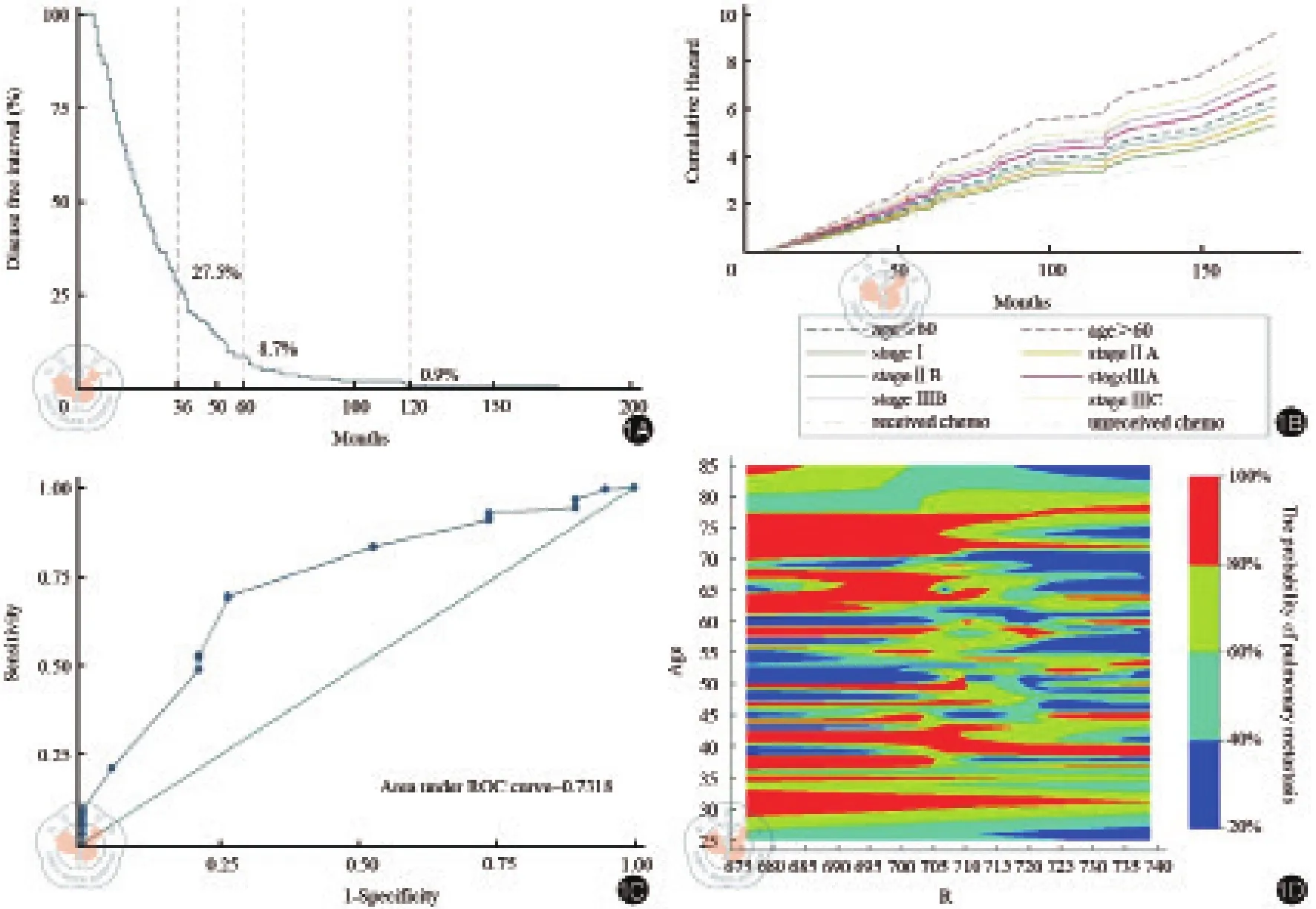
圖1 Contour圖,等高線圖。1A:全部研究人群的無病間隔;1B:估計累積危害,按手術時年齡,病理分期和是否接受化療分層;1C:接收機工作特性(ROC)曲線評估復發預測模型的判別能力;1D:用于估計肺轉移風險的等值線圖;紅色區域描繪高風險,藍色區域風險低;與每種顏色相關的百分比表明手術后肺轉移的可能性
因此,我們可以使用相應臨床和病理參數來計算每個CRC患者的R值。通過ROC分析和精確度的計算來評估分值。ROC曲線是體現靈敏度和特異性相互關系的圖形表示,針對所有可能的閾值計算,ROC曲線上的每個操作點代表在給定閾值下的靈敏度和特異性的組合[12]。在本研究中,ROC分析顯示,區分的最佳截斷值為0.710。作為診斷準確度的度量的AUC是0.732(CI:0.670~0.791,P<0.05)(圖1C)。當截止值設定為0.710時,Youden指數(靈敏度+特異度-1)達到最大值(0.430)。敏感度為69.4%;特異度為73.7%;預測準確率為65.1%。隨后,為了開發一種包括得分和年齡的新型風險分層方法,我們創建了一個等高線圖,將兩個變量視為連續變量。與每種顏色相關的百分比表示在手術后的前10年內肺轉移的可能性。例如,評分(R)為0.70的51歲患者的10年肺轉移風險為20~40%(圖1D)。
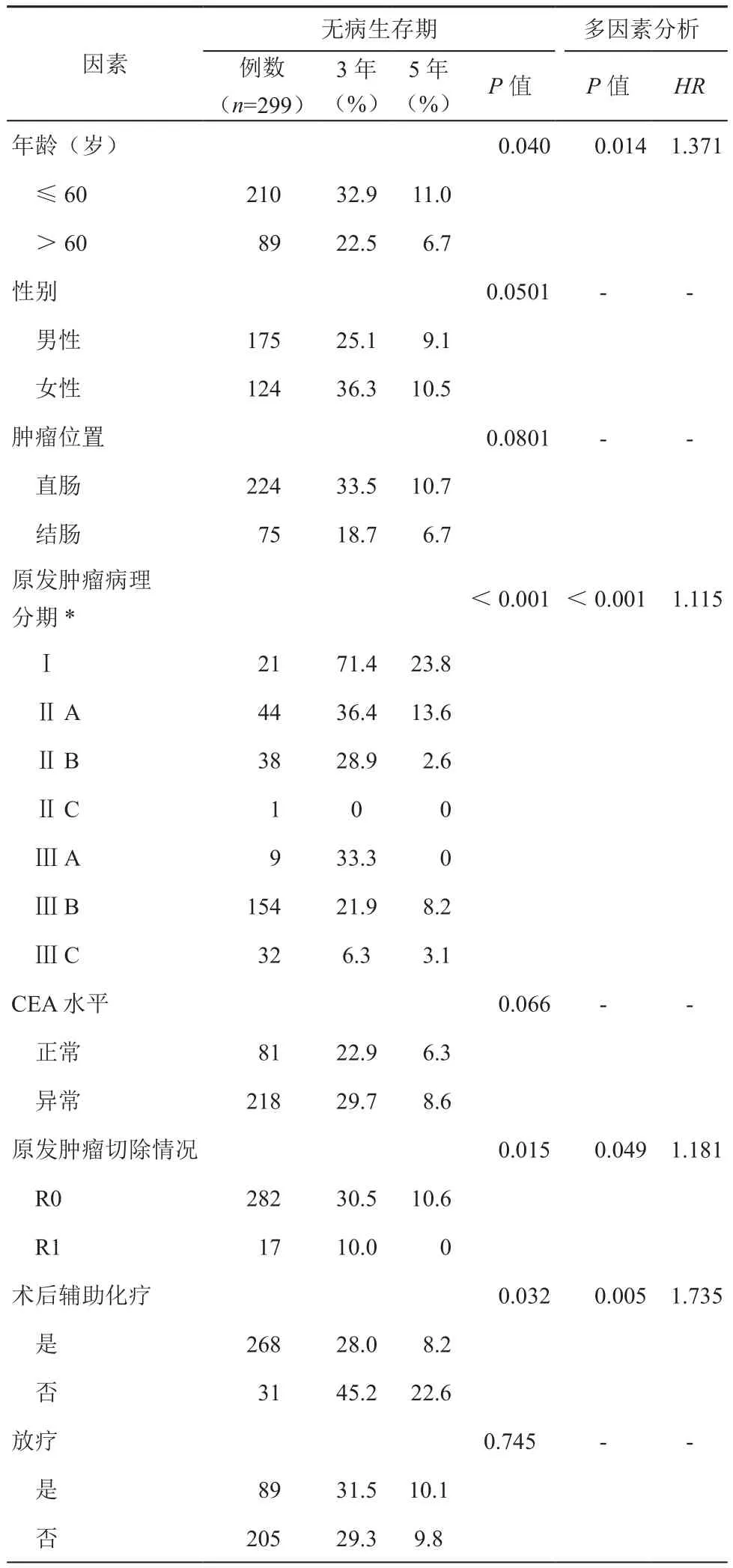
表1 影響肺轉移的單因素和多因素分析
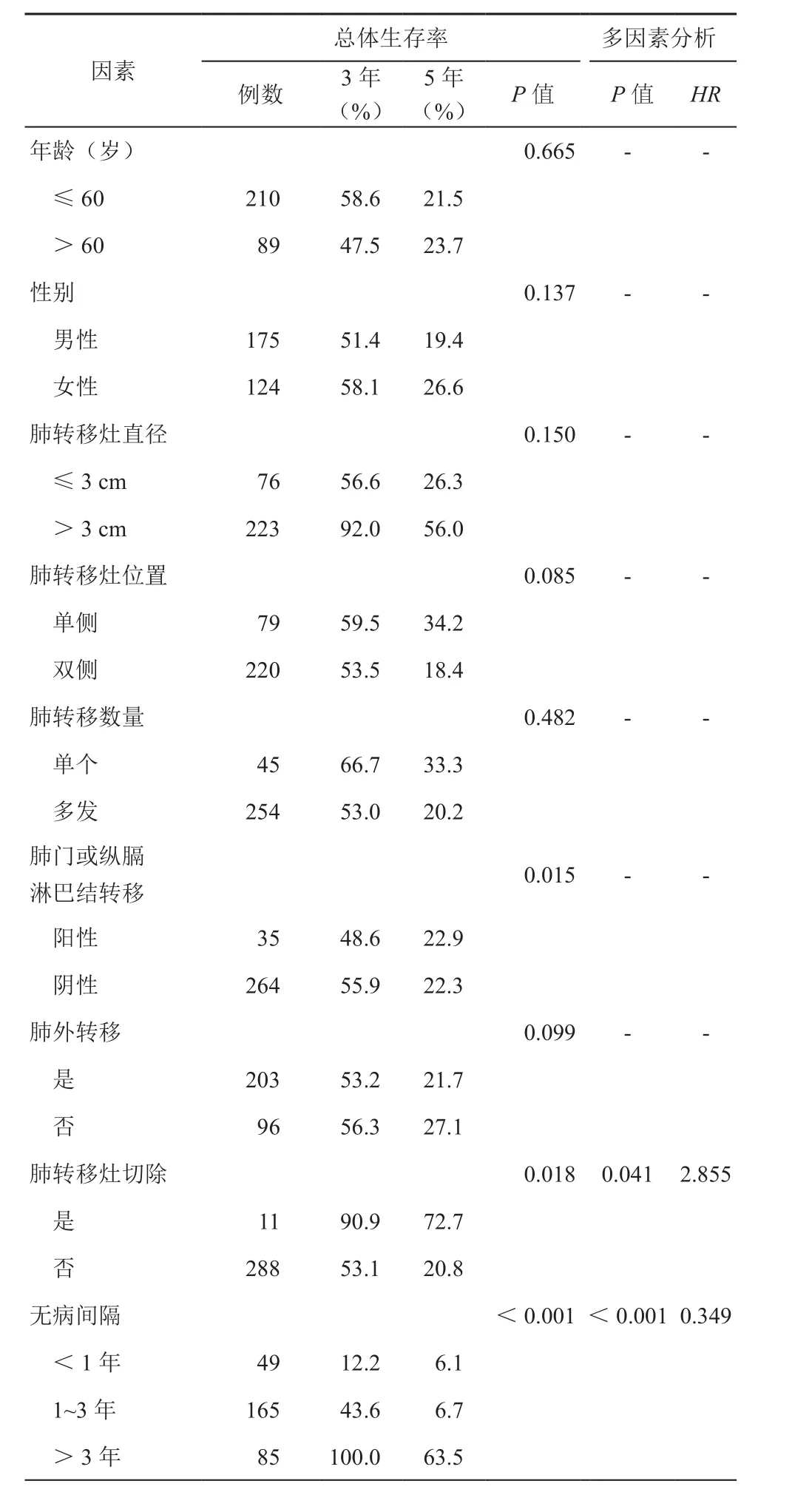
表2 影響總體生存率的單因素和多因素分析
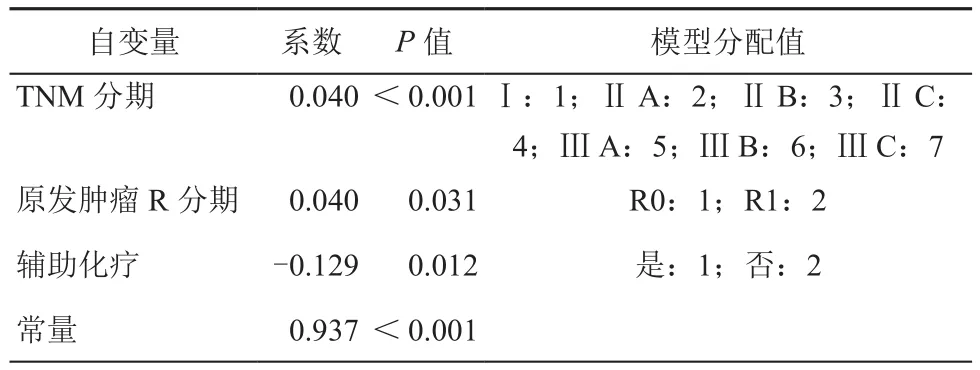
表3 復發預測模型的多元邏輯回歸結果及參數
討 論
CRC患者的預后主要取決于是否出現切除后原位復發或遠處轉移。超過一半的CRC患者切除后出現轉移,主要發生在肝臟和肺部[13]。對于結、直腸癌肺轉移灶,目前的主流觀點認為,手術切除是治療單發轉移性肺結節的首選方法。然而,只有10%的CRC肺轉移患者能夠接受根治性的切除術[14-15]。因此,我們需要確定更多相關的預后因素,最大限度篩選可能從預防和/或治療中獲益的肺轉移高風險患者。在本研究中,我們回顧性分析CRC異時性肺轉移數據,目的在于確定該特殊群體的風險因素。
本研究證實,原發癌發生時患者年齡、病理分期、化療和原發灶手術的R分類是決定DFI的獨立因素,轉移灶切除和DFI是OS獨立預后因素。Welter等[16]發現腫瘤累及淋巴結對生存有很大影響。轉移性淋巴結的存在影響CRC患者的預后,許多研究表明轉移淋巴結的位置和數量會影響預后[17-19]。在這項研究中,我們還注意到原發癌的病理分期是肺轉移最重要的預后因素。有兩個過程使淋巴結轉移和遠處轉移之間存在聯系:一是腫瘤細胞滲入淋巴結的血管結構,導致血行播散;二是淋巴結的傳出淋巴管最終進入體循環。基于上述假設,CRC肺轉移是進一步全身擴散的前兆[20],這與本研究中相當大比例的患者患有多器官轉移的事實相符合。
治療后的腫瘤狀態由原發灶腫瘤殘留(R)分類描述:R0,無殘留腫瘤;R1,微觀殘留腫瘤。對于那些作為手術切除候選者的患者,R分類是最重要的因素。只有那些可以完成R0切除的患者才有可能被治愈。我們的結果表明,殘余腫瘤的狀態與肺轉移有統計學相關性。手術切緣腫瘤檢測的不準確引起的未完全切除導致更高的局部復發率,最終導致肺轉移。值得注意的是,R分類不僅受診斷時腫瘤的生物學和解剖學范圍影響,還受到與治療相關因素(例如手術方法,主刀醫生和化療等)的影響。
我們將老年(>60歲)確定為CRC腫瘤復發的危險因素。這一發現已在一些研究[21-22]中得到證實。Aslam等[23]發現年齡小于50歲的患者的中位生存期顯著延長。中位生存時間以10歲為間期持續下降,對于80歲以上的患者,中位生存時間僅為6.7個月。我們認為,由于老年患者容易發生轉移性疾病的并發癥及其他疾病,最終的死因很可能歸于CRC,在延誤治療的同時,也影響生存數據調查的準確性。盡管我們的研究結果顯示腫瘤復發隨著年齡的增長而增加,但兩個年齡組的總生存率相當。我們進一步分析了DFI和OS之間的關系,發現DFI在60歲后,有隨著年齡增長而縮短的趨勢,并且隨著DFI的減少,OS也相應縮短(圖2)。我們關注CRC肺轉移患者的預后,認為DFI也是危險因素之一。這一結果與之前發表DFI與生存率呈正相關的研究相一致[24-26]。

圖2 散點圖矩陣評估年齡,DFI和OS之間的關系
遠處轉移是決定CRC患者預后的重要因素,在該研究中,我們也得到了類似的結果。然而,由于社會經濟條件的限制,許多肺轉移瘤患者最終放棄了治療。若樣本量較小,可能會影響研究結果的可信度,所以擴大樣本量,并進一步評估是非常必要的。盡管化療策略在過去十年中已經快速發展,但它仍然是復發的獨立預測因子。而我們的研究結果發現化療與復發風險之間存在反比關系,這可能是因為通常僅病理分期較晚的患者才接受化療。
在本研究中,我們確定了CRC異時性肺轉移患者的預后因素。為了評估CRC肺轉移的風險,我們構建一個預后等高線圖,其可用于患者咨詢。這些發現可以指導這一特殊群體的預后管理。首先,為了選擇高危肺轉移患者并最大化輔助治療的收益,這些獨立的預后標志物可能有助于鑒別CRC的高風險表型。其次,可以對這部分患者制訂更加密集的隨訪策略,特別是對于低收入群體。
綜上,年齡、病理分期、化療和原發灶的陽性切緣與異時性肺轉移發生密切相關。基于這些因素,本研究中構建的簡單風險概率評估模型有助于促進CRC患者防治的全程管理。
致謝
本研究得到了哈爾濱醫科大學附屬第二醫院病理科的幫助

