腹部無輔助切口經陰道取標本的全腹腔鏡全胃切除術(GC-NOSES Ⅷ式)(附視頻)
王松 于剛 趙旭 劉金超
眾多研究結果顯示,與開腹全胃切除術相比較,腹腔鏡全胃切除術具有創傷小、恢復快、切口美觀等優勢,且在安全性和近、遠期療效方面并不劣于開腹手術,因此得到了廣泛開展[1]。腹部無輔助切口經陰道取標本的腹腔鏡全胃切除術(GCNOSES Ⅷ式)是經自然腔道取標本手術(natural ori fice specimen extraction surgery,NOSES)技術在腹腔鏡全胃切除術中的應用,在全腔鏡下完成全胃切除、淋巴結清掃及消化道重建,經自然腔道取出標本,避免腹壁切口,減輕手術創傷,且操作視野更加廣闊,重建時更容易判斷腸管遠近端方向,可有效避免在輔助小切口下暴露不足、吻合后腸管扭轉、吻合口張力過大等問題,在手術的安全性方面優勢明顯,得到業內廣泛認可。《胃癌經自然腔道取標本手術專家共識(2019版)》于2019年8月正式發布,對胃癌NOSES的理論體系以及臨床實踐多個方面進行了全面闡述,為該技術的規范開展提供了參考依據和行業準則[2]。GC-NOSES手術需要熟練的腹腔鏡操作技術及默契的團隊配合,尤其是侵犯齒狀線的食管胃結合部癌更具挑戰性,能夠常規開展此手術的醫院較少。現將本中心行腹部無輔助切口經陰道取標本的腹腔鏡全胃切除術經驗以及其中一例病例報道如下。
一、患者資料
患者女性,66歲,因“進食梗噎感2月”入院,查體:BMI 19.8 kg/m2,腹肌軟,上腹部壓痛,無反跳痛,腸鳴音正常。胃鏡示距門齒37 cm至40 cm見潰瘍病變,管腔狹窄,超細胃鏡勉強通過,40 cm達賁門,見一火山口樣潰瘍病變,表面潰爛,覆蓋污苔,取活檢(圖1),病理結果示腺癌。CT示食管胃結合部、胃體癌(圖2),未見肺部、腹腔等遠處轉移。上消化道造影示食管受累約3 cm(圖3)。
完善術前檢查后,提交MDT小組討論,考慮患者無遠處轉移,建議行手術治療。鑒于腫瘤下緣達胃體中下部,近端胃手術難以滿足切除范圍,需行全胃切除術;手術難點在于腫瘤侵犯食管下段,經腹膈肌食管裂孔路徑行腹腔鏡下食管空腸吻合難度大。
術中行腹部無輔助切口經陰道取標本的全腹腔鏡全胃切除術,手術器械為常規腹腔鏡器械,手術時間310 min。術中胃鏡聯合腹腔鏡精確定位腫瘤上緣,保證上切緣安全。患者于術后第2天進流質飲食,逐漸過渡到正常飲食,術后第5天拔除引流管。術后腹部疼痛輕微(VAS評分3分),無陰道異常流血及分泌物,無腹脹等不適,無吻合口漏、出血、梗阻、感染等并發癥發生,術后第10天出院。術后病理分期:pT3N2M0 IIIA。
二、手術操作方法
患者取分腿仰臥位,Trocar 的布置采用五孔法,術者站于患者左側,助手站于右側,扶鏡手站于兩腿之間。
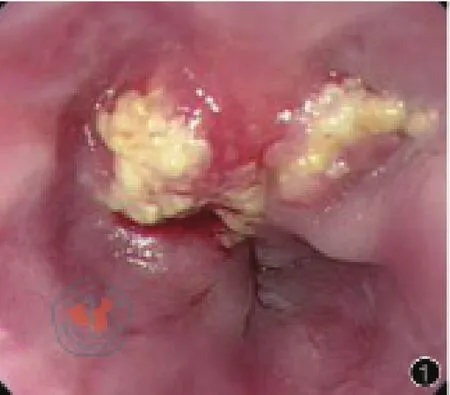
圖1 胃鏡所見
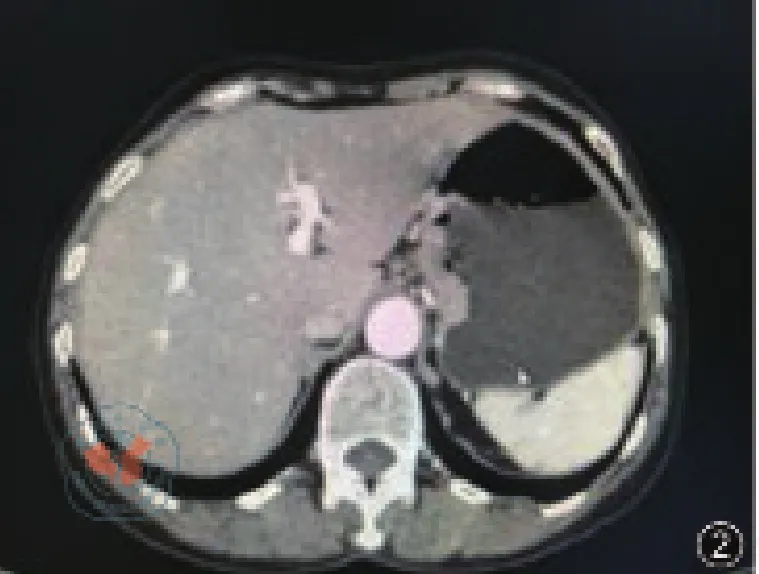
圖2 CT
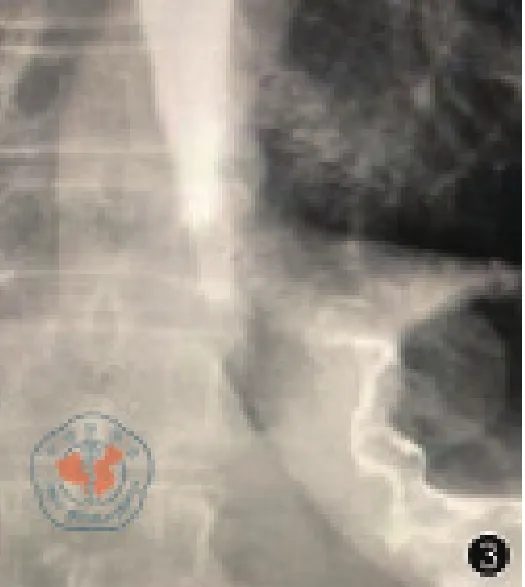
圖3 上消化道造影
全腹腔鏡全胃切除術具體操作步驟:
腹腔鏡探查及淋巴結清掃操作:(1)腹腔鏡探查,排除腹腔種植轉移及其他病變;(2)剝離橫結腸系膜前葉,分離胃結腸韌帶;(3)清掃第6組淋巴結:將胃竇部向上提起,顯露胃結腸靜脈干,離斷根部胃網膜右靜脈;繼續沿胰頭表面分離,打開胃胰韌帶,顯露胃十二指腸動脈,裸化胃網膜右動脈,根部離斷,清掃第6組淋巴結;(4)清掃第4、10組淋巴結:進入網膜囊,顯露胰尾,定位脾血管,松解結腸脾曲,分離大網膜與脾下極的粘連,保護胰尾,顯露胃網膜左動、靜脈,在其發出供應脾下極的分支后離斷,清掃第4sb組淋巴結,并進一步清掃脾門區淋巴結。將胃及大網膜向左側牽拉,繼續向上方分離,切斷胃短血管,清掃4sa組淋巴結;(5)清掃第8a、12a、5組淋巴結:暴露肝總動脈,將胰腺向左下牽拉,沿肝總動脈前方及上緣分離,清掃第8a組淋巴結。沿胃十二指腸動脈及肝總動脈充分顯露胃右動脈及肝固有動脈,繼續向上分離肝固有動脈前方及外側,清掃第12a組淋巴結。于胃右動、靜脈根部夾閉后離斷,清掃第5組淋巴結;(6)在幽門遠端2 cm處用45 mm切割縫合器離斷十二指腸,于肝總動脈、胃十二指腸動脈及胰腺上緣夾角處打開門靜脈前方筋膜,顯露門靜脈,將肝總動脈向前腹壁挑起。沿門靜脈前方分離,清掃門靜脈與肝固有動脈間淋巴結。沿門靜脈內緣向上分離至肝門部,將肝總動脈向右下牽拉,清掃肝固有動脈內側及門靜脈內側淋巴脂肪組織;(7)清掃第11p、7、9組淋巴結:將大網膜置于肝臟下方,助手抓持胃胰皺襞,將胃翻向上方。緊貼胰腺上緣分離,暴露脾動脈近端,清掃第11p組淋巴結。由左向右清掃,顯露腹腔動脈干,分離胃左動、靜脈,在根部夾閉后離斷,清掃第7、9組淋巴結;(8)沿脾動脈向遠端分離,切斷胃后血管,清掃第11d組淋巴結;(9)清掃胃小彎淋巴結:緊貼胃壁小彎側,采用超聲刀分層切開,清掃胃小彎淋巴結;(10)游離食管下段,沿胸主動脈前壁清掃110組、112組淋巴結。緊貼胃壁小彎側,采用超聲刀分層切開,切斷迷走神經前干和后干,清掃第1組及第2組淋巴結;(11)術中胃鏡定位腫瘤上緣,距離腫瘤上緣3 cm用45 mm切割縫合器切斷食管,將標本置入標本袋中,暫置于左下腹,待經陰道取標本。
消化道重建:食管近斷端左右兩側分別縫合一針倒刺線,用超聲刀自食管斷端中央切開,距Treitz韌帶約20 cm處離斷空腸,遠端空腸與食管行Overlap法吻合。2針倒刺線連續縫合加固,關閉共同開口。食管-空腸吻合后,距離食管空腸吻合口40 cm空腸對系膜側開孔,近端空腸與遠端空腸使用45 mm直線切割閉合器行側側吻合,4-0可吸收線間斷縫合關閉共同開口。
經陰道取標本操作:(1)改患者體位為頭低足高右傾30°的膀胱截石位,調整腹腔鏡顯示器于患者足側(如圖4所示);觀察孔調整為左側腋前線肋緣下戳卡孔,方向調整為向足側操作,術者站于患者右側,術者操作孔更換為臍下戳卡孔和右側鎖骨中線平臍戳卡孔(如圖5所示);(2)顯露并消毒會陰部,用碘伏紗布反復消毒陰道;分別于陰道后穹窿切開前、切開后、標本取出后、縫合完畢后用蒸餾水、稀碘伏溶液(1 000 mg/L)、生理鹽水徹底沖洗盆腔;(3)經陰道置入壓腸板,將陰道后穹窿頂起,橫行切開約5 cm;(4)自陰道或腹部戳孔置入切口保護套,表面用碘伏紗布擦拭潤滑,用卵圓鉗抓取標本,經切口保護套將標本拉出,注意保持氣腹壓力,后將切口保護套平穩拖出;(5)用3-0倒刺線2根,連續加固縫合陰道后穹窿切口,確保縫合嚴密。
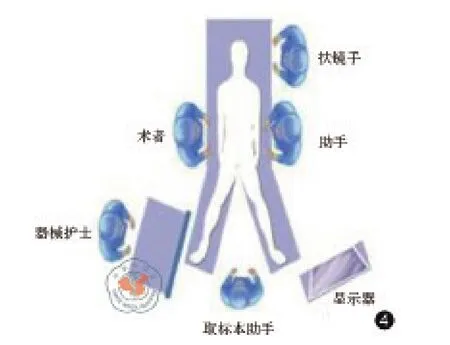
圖4 取標本時手術者站位及顯示器位置
具體手術操作可見手術視頻。圖6為經陰道取標本,圖7~8為術后標本照片,圖9~10為術后腹部外觀照片。
三、討論
胃癌是全球最常見的惡性腫瘤之一,根據GLOBCAN的統計數據,2018年全球胃癌新發病例約103.3萬例,死亡病例約78.3萬例,中國胃癌發病例數和死亡例數分別占全球胃癌發病和死亡的42.6%和45.0%,在全球183個國家中發病率位于第5位、死亡率位于第6位[3]。我國胃癌患者Ⅰ期胃癌和Ⅳ期胃癌分別占19.5%和9.7%,Ⅱ~Ⅲ期胃癌占比高達70.8%。根據腫瘤直徑大小分類,腫瘤直徑小于5 cm的胃癌患者約占一半[4],因此適合行NOSES手術的胃癌患者約30%。但限于目前國內外胃癌NOSES的開展情況,實際接受胃癌NOSES的患者數量非常少。
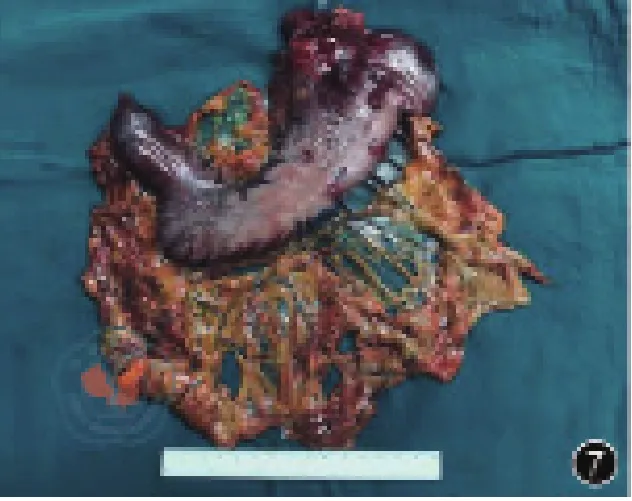
圖7 術后標本照片
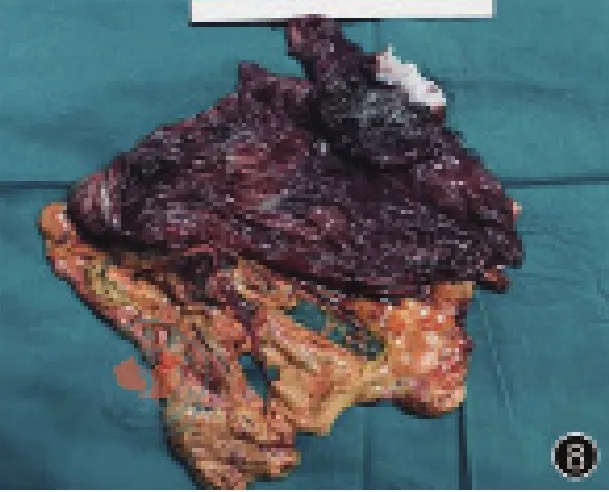
圖8 術后標本剖開照片
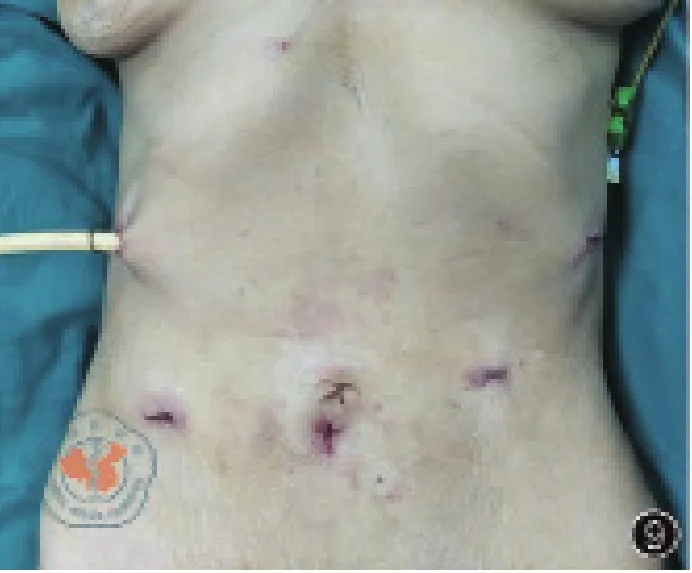
圖9 手術結束時腹部照片
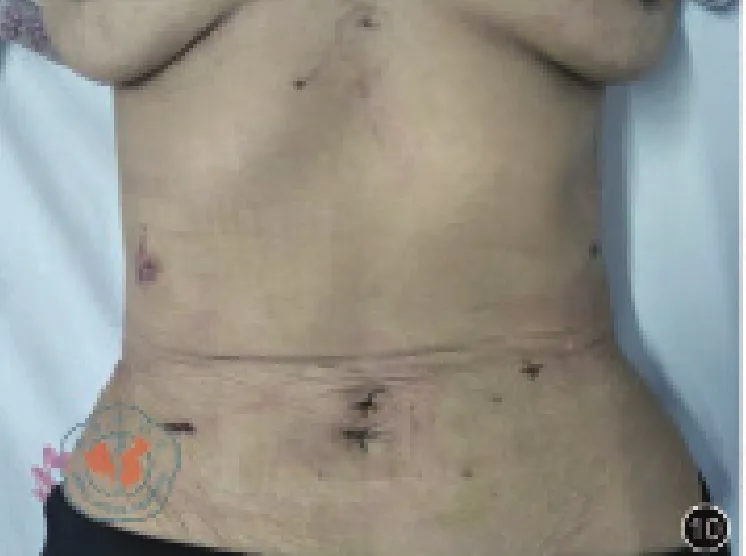
圖10 術后10天腹部照片

圖11 腹腔鏡輔助手術患者腹部照片
D2根治術是胃癌根治手術的金標準,隨著外科切除重建技術的不斷提高、腹腔鏡設備的進步,目前腹腔鏡胃癌手術已能達到與開腹手術相同的D2淋巴結清掃水平,消化道重建亦能在腔鏡下完成(即全腹腔鏡胃癌手術)。全腹腔鏡下胃癌根治術消化道重建是近年來研究的熱點之一,雖然其操作難度大,但具有創傷更小、視野更好、操作空間相對更大等優點,并且能夠在腹腔鏡下近距離觀察吻合口,判斷吻合質量、吻合口大小及有無出血等情況[5]。隨著結直腸NOSES手術的逐漸成熟,胃癌NOSES可行性及安全性的初步探索也得到了越來越多的肯定。
全腹腔鏡下全胃切除術難點有以下幾方面:(1)腫瘤位置高,淋巴結清掃、消化道重建困難大,選擇合適的手術路徑尤其重要,《食管胃結合部腺癌外科治療中國專家共識(2018版)》指出可選擇的手術路徑包括經左胸單切口、上腹右胸兩切口、上腹左胸兩切口、頸胸腹三切口、左胸腹聯合切口以及經腹食管裂孔徑路,專家組建議食管受累<3 cm者首選經腹膈肌食管裂孔路徑,≥3 cm者經上腹右胸路徑[6]。我們的經驗是經腹食管裂孔徑路,在懸吊肝臟的基礎上,懸吊食管裂孔,保證充分顯露極為重要;(2)由于食管空腸吻合口位置高,吻合的質量決定手術的成敗,仔細分離、裁剪小腸系膜,在不損傷腸管血供的前提下,保證無張力吻合;(3)腫瘤位置高,術中胃鏡可幫助準確定位腫瘤近端邊界,保證上切緣的安全,吻合完成后檢查食管空腸吻合的質量。
在全腹腔鏡根治性全胃切除術的安全性有了充分的保障后,經自然腔道取標本與之相結合,沒有增加手術難度,消除了腹壁取標本切口,微創優勢進一步擴大。圖11與圖9、圖10展示的腹腔鏡輔助手術與NOSES手術腹部照片,明顯可以看出NOSES手術在腹部外觀方面的優勢。NOSES手術主要強調經自然腔道完成標本取出,胃癌NOSES屬于切除拖出式,沒有改變常規經腹入路的手術操作,其實質是切口的移位,將腹壁切口移位至較為隱蔽且缺乏痛覺的陰道或直腸。與腹壁切口相比,陰道切口、直腸切口具有位置隱蔽、無可見疤痕、疼痛輕等多種優勢,且減少了腹壁切口相關并發癥風險、降低了患者心理負面影響,更符合損傷效益比原則[7]。與D2遠端胃切除術、近端胃切除術相比,D2全胃切除術因不裁剪網膜,標本橫徑更大,因而取標本的難度相對更高,術前需精確評估,保證取標本過程的順利進行。目前仍有不少醫生心理上對經陰道取標本、經肛門取標本存在“偏見”,但是筆者認為只要掌握好適應證和術中操作技巧,經陰道取標本、經肛門取標本NOSES術有其存在的意義和價值。胃癌NOSES切除、重建操作位于上腹部,取標本過程需將標本轉運至下腹部,標本轉運過程中保證無瘤是至關重要的,筆者認為將切除標本置入無菌標本袋中轉運是非常有必要的。經自然腔道取標本輔助工具的合理選擇可以有效的保護好切口,降低自然腔道切開后的并發癥發生風險,提高經自然腔道取標本的成功率。但目前尚無具有明顯優勢的工具可供選擇,筆者團隊使用的是自制軟質的塑料通道。
陰道后穹窿在腹腔鏡下容易暴露與識別,在解剖上無大的血管和神經通過,此處切開對性生活不會造成明顯影響[8],經陰道更容易取出較大標本,且縫合后并發癥發生率低,其安全性、損傷效益比更高。劉金超等[9]報道了38例經自然腔道取標本的完全腹腔鏡胃腫瘤切除術的病例,并未發生直腸或陰道后穹窿切開后并發癥,初步證實了該術式的安全性,其指出只要做好術前準備、熟練掌握手術技巧,NOSES與無菌、無瘤原則并無相悖之處。經陰道取標本主要限制在陰道后穹窿切開長度,而經肛門取標本主要限制在肛門。我們在取標本操作時,在保證無菌無瘤無瘤原則下,預先在無菌保護套內部涂抹碘伏溶液起潤滑作用,用卵圓鉗抓取距離腫瘤較遠一側的胃壁正常組織,循序漸進將胃標本沿縱軸向體外牽拉,這樣可將切除胃組織牽拉成近似管狀,并減少腫瘤破裂風險,利于標本的取出;當標本最大徑通過自然腔道最狹窄的部分后,剩余部分及大網膜等組織則可順利取出。經肛門取標本在無菌要求、取標本過程、縫合切口等方面比經陰道取標本操作要求更高,風險更大。經肛門取標本時,更容易發生直腸撕裂,應避免暴力牽拉。關閉直腸前壁切口時應用2條3-0倒刺線連續加固縫合,盡可能降低腸漏的風險,而陰道后穹窿切口連續全層縫合一次即可。
結直腸腫瘤NOSES目前已成熟開展,其優勢明顯,NOSES手術腹壁無輔助切口,最大程度保留腹壁功能,患者術后疼痛輕、恢復快,對腹部外觀的滿意度高,同時降低切口感染、切口裂開、切口疝等近遠期并發癥發生率[10]。胃癌NOSES可借鑒其成功的經驗,對于食管胃結合部腺癌行經自然腔道取標本的全胃切除術,需嚴格掌握適應證,術前準確評估腫瘤位置、大小、浸潤深度等,保證無菌無瘤操作及患者安全。NOSES手術正處于不斷完善過程中,目前開展的D2全胃NOSES病例數量仍較少,隨訪時間短,尚無大宗病例報道,還需要更多的同道開展相關臨床研究,觀察其遠期療效。

掃碼觀看手術視頻

