芽孢桿菌ZYCHH-01發酵條件優化及其抑菌物質的研究
韓旭東,張玉蒼 *,李瑞松,徐從英
(1.海南大學 熱帶島嶼資源先進材料教育部重點實驗室,海南 海口 570228;2.海南大學 化學工程與技術學院,海南 海口 570228)
食品加工過程中,食源性病菌容易污染食品致使其成品存在食用風險[1],尋找高效、低成本的抑制食源性病菌生長的方法對食品產業的發展與安全顯得尤為重要。生物抑菌法因操作簡單、抑制率高、安全性能好等優勢而備受青睞[2-3]。以尼生素為代表的抑制物質因具有良好的抑菌特性而備受食品加工廠關注,但其在酸性環境才能起到良好的抑菌作用[4],因而發展其他細菌所產的抑菌物質是十分有必要[5]。
目前,關于芽孢桿菌產抑菌物質及其性能的研究較少,但其抑菌物質在抑菌活性和pH抗性等方面卻能表現出多樣性[6-7]。部分芽孢桿菌屬在歷史上被長期應用于食品和動物飼料的添加劑,并且具有良好的安全性[8]。傳統的芽孢桿菌如枯草芽孢桿菌和地衣芽孢桿菌已經獲得歐洲食品安全局(European Food Safety Authority,EFSA)的安全認證以及美國食品和藥物管理局(food and drug administration,FDA)的安全認證[9-10]。芽孢桿菌屬的抑菌物質具有良好的穩定性和廣泛的抑菌譜,因此開發新的芽孢桿菌抑菌物質是有必要的[11-12],同時在開發新的芽孢桿菌細菌素也需要對其安全性進行嚴格的測評。
以芽孢桿菌ZYCHH-01為試驗菌株,對其發酵過程的培養基pH值、接種量、發酵溫度、發酵時間進行探討,測定細菌濃度和抑菌物質抑菌圈,通過響應面法進行優化,建立模型分析最佳發酵條件,并對芽孢桿菌ZYCHH-01產抑菌物質的熱穩定性、pH穩定性、耐儲存性、酶的敏感性、有機溶劑和表面活性劑穩定性以及對不同細菌活性進行分析,為芽孢桿菌屬產抑菌物質的大量制備提供依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
芽孢桿菌(Bacillus)ZYCHH-01、金黃色葡萄球菌(Staphylococcus aureus)(ATCC 29523)、鼠傷寒沙門氏菌(Salmonella typhimurium)(CMCC 20115)、單增李斯特菌(Listeria monocytogenes)(ATCC 19115),指示菌株大腸桿菌(Escherichia coli)(ATCC 25922):保存于海南大學熱帶島嶼資源先進材料教育部重點實驗室。
1.1.2 試劑
氯化鈉、甲醇、乙醇、乙腈、丙酮、異丙醇、Tween 20、Tween 80(均為分析純):西隴化工股份有限公司;蛋白胨(生化試劑):北京雙旋微生物培養基制品廠;葡萄糖、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、尿素(urea)、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)(均為分析純):廣州化學試劑廠;乳酸鏈球菌素、木瓜蛋白酶、蛋白酶K(30 U/mg)、堿性蛋白酶(200 U/mg)、中性蛋白酶(50 U/mg)、胰蛋白酶(10 000 U/mg)、α-淀粉酶(50 U/mg)、纖維素酶(50 U/mg)(均為生化試劑):上海麥克林生化科技有限公司。
1.1.3 培養基
種子培養基、指示菌活化培養基均為牛肉膏蛋白胨液體培養基,調pH7.0~7.2。
發酵培養基:牛肉膏3 g,蛋白胨10 g,氯化鈉5 g,葡萄糖4 g,豆粕粉4 g,定容至1 000 mL。
固體培養基:牛肉膏3 g,蛋白胨10 g,氯化鈉5 g,技術瓊脂粉15 g,定容至1 000 mL,調pH7.0~7.2。
1.2 儀器與設備
DH8-D全溫振蕩器:蘇州培英實驗設備有限公司;SPX-200-Ⅱ生化培養箱:上海躍進醫療器械有限公司;H1850R臺式高速冷凍離心機:湖南湘儀實驗室儀器開發有限公司;UV-3300PC型紫外可見分光光度計:上海美譜達儀器有限公司;seven compact pH計:梅特勒-托利多儀器(上海)有限公司。
1.3 實驗方法
1.3.1 指示菌液的制備
接種1環大腸桿菌至50 mL種子培養基中,于37 ℃、190 r/min條件下培養24 h。
1.3.2 無菌上清液的制備
接種1%芽孢桿菌ZYCHH-01至發酵培養基中,37 ℃、190 r/min培養24 h,4 ℃、12 000 r/min離心30 min,取上清液,用0.22 μm濾膜過濾菌體,4 ℃條件下保存。
1.3.3 抑菌物質抑菌圈測定
取100 μL指示菌液涂布于固體培養基中,輕置內徑為6 mm,外徑8 mm的牛津杯于固體培養基表面,并加入100 μL無菌上清液,4 ℃靜置4 h后,37 ℃靜置培養24 h,測量并記錄抑菌圈直徑的大小。
1.3.4 細菌濃度的測定
將發酵好的芽孢桿菌ZYCHH-01發酵液,用紫外可見分光光度計于波長600 nm處測量其吸光度值。
1.3.5 單因素試驗
分別接種(1%、2%、3%、4%、5%)種齡24 h芽孢桿菌ZYCHH-01至(pH值分別為5、6、7、8、9)的發酵培養基中,分別在(28 ℃、31 ℃、34 ℃、37 ℃、40 ℃)條件下、190 r/min分別培養(6 h、9 h、12 h、15 h、18 h、21 h、24 h、27 h、30 h、33 h、36 h),測定發酵液細菌濃度,取無菌上清液,測定抑菌圈大小。
1.3.6 Box-Behnken試驗響應面優化
根據單因素優化結果,選取發酵溫度(A)、培養基pH值(B)、發酵時間(C)3個影響較大的因素為試驗因素,以抑菌圈直徑(Y)為響應值,采用Design-Expert 8.0.6設計3因素3水平Box-Behnken響應面試驗,試驗因素及編碼水平見表1。

表1 響應面試驗因素與水平Table 1 Factors and levels of response surface experiments
1.3.7 最小抑菌濃度的測定
以無菌上清液為試驗組,10 000 IU/mL的乳酸鏈球菌素為陽性對照組,采用二倍稀釋法將試驗組和陽性對照組分別稀釋為1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128,測定實驗組和陽性對照組抑菌圈的大小。
1.3.8 抑菌物質活性穩定性測定
不同pH下的熱穩定性:將不同pH的無菌上清液分別在20 ℃、40 ℃、60 ℃、80 ℃、100 ℃條件下處理30 min,待恢復至室溫,分別測定抑菌圈的大小。
酶對抑菌物質穩定性的影響:在無菌上清液和無菌生理鹽水中分別加入質量濃度均為1.0 mg/mL的木瓜蛋白酶(pH7)、蛋白酶K(pH7)、堿性蛋白酶(pH9)、中性蛋白酶(pH7)、胰蛋白酶(pH8)、α-淀粉酶(pH7)、纖維素酶(pH6),37 ℃溫育3 h,以含有酶的生理鹽水為對照組,測定抑菌圈大小。
有機溶劑和表面活性劑對于抑菌物質的影響:將體積分數10%的甲醇、乙醇、乙腈、丙酮、異丙醇以及0.1 g/L的Tween 20、Tween 80、EDTA、SDS、Urea分別加入無菌上清液中,室溫溫育5 h,以加入生理鹽水的上清液和無菌上清液為對照組,測定抑菌圈大小。
儲藏時間對抑菌物質活性的影響:將無菌上清液分裝在12根離心管內,4 ℃分別儲存0、2 d、4 d、6 d、8 d、10 d、12 d、14 d、16 d、18 d、20 d、22 d,測定抑菌圈的大小。
抑菌物質對不同細菌的活性:分別接種大腸桿菌(ATCC 25922)、金黃色葡萄球菌(ATCC 29523)、鼠傷寒沙門氏菌(CMCC 20115)、單增李斯特菌(ATCC 19115)至種子培養基,37 ℃、190 r/min培養24 h作為指示菌,測定無菌上清液對指示菌的抑菌圈大小。
2 結果與分析
2.1 培養條件優化
2.1.1 培養基pH對抑菌物質活性的影響
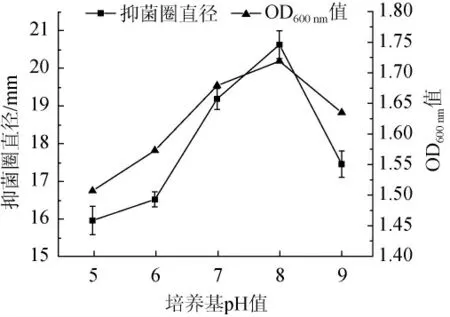
圖1 培養基pH值對抑菌物質活性的影響Fig.1 Effect of medium pH on antibacterial substances activity
由圖1可知,當培養基pH值為5時細菌濃度和抑菌物質活性較低,隨著pH值升高細菌濃度和抑菌物質活性提高顯著。pH值為8時,抑菌圈直徑最大,直徑為20.62 mm,細菌濃度和抑菌物質活性達到峰值。pH值為9時,細菌濃度和抑菌物質活性下降明顯。可能由于過酸或者過堿環境都會影響細菌的增殖代謝,導致抑菌物質活性較低,或因不同pH值條件下細菌對抑菌物質的吸附不同,從而影響抑菌物質的活性[13]。因此,培養基最佳發酵pH值為8。
2.1.2 接種量對抑菌物質活性的影響

圖2 接種量對抑菌物質活性的影響Fig.2 Effect of inoculum on antibacterial substances activity
由圖2可知,接種量為1%時,細菌濃度和抑菌物質活性較高,隨著接種量的增加,細菌濃度和抑菌物質活性升高,接種量為3%時,抑菌圈最大,直徑為20.67 mm,細菌濃度和抑菌物質活性達到峰值。接種量過大時,細菌濃度和抑菌物質活性略有下降,由于細菌生長到一定階段,培養基內的營養物質消耗過快,使抑菌物質的產生受菌體細胞群體感應調節,導致抑菌物質活性降低[14]。因此,最佳接種量為3%。
2.1.3 發酵溫度對抑菌物質活性的影響

圖3 發酵溫度對抑菌物質活性的影響Fig.3 Effect of fermentation temperature on antibacterial substances activity
由圖3可知,發酵溫度為28 ℃時,細菌濃度和抑菌物質活性較小,隨著發酵溫度升高,細菌濃度和抑菌物質活性增大;發酵溫度為37 ℃時,細菌濃度和抑菌物質活性最高,抑菌圈最大,直徑為20.84 mm;發酵溫度為40 ℃時,細菌濃度和抑菌物質活性明顯降低。因為細菌在增殖和代謝時有多種酶參與,當發酵溫度過高或過低時酶的活性降低,細菌增殖代謝速度減緩,使抑菌物質合成受到抑制[15]。因此,最佳發酵溫度為37 ℃。
2.1.4 發酵時間對抑菌物質活性的影響
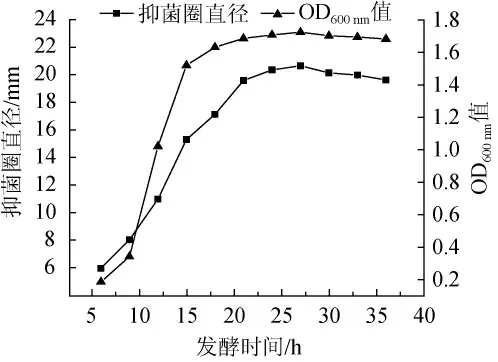
圖4 發酵時間對抑菌物質活性的影響Fig.4 Effect of fermentation time on antibacterial substances activity
由圖4可知,芽孢桿菌ZYCHH-01發酵6 h時,細菌濃度和抑菌物質活性很低,細菌濃度和抑菌物質活性隨著發酵時間延長增加顯著。發酵時間18~27 h時,細菌濃度和抑菌物質活性緩慢提升。發酵時間為27 h時,細菌濃度和抑菌物質活性最高;發酵時間27 h后,細菌濃度和抑菌物質活性持續下降。由于菌株生長時會產生少量的抑菌物質,隨著細菌進入穩定期,抑菌物質活性明顯提升,細菌發酵時間過長,進入衰亡期,部分菌體自溶釋放的蛋白酶降解部分抑菌物質,或者發酵液中有害產物積累過多,導致細菌濃度降低,抑菌物質活性降低,抑菌圈直徑下降[16]。因此,最佳發酵時間為27 h。
2.2 Box-Behnken響應面優化試驗結果
利用Design-Expert 8.0.6設計3因素3水平Box-Behnken響應面試驗結果見表2,方差分析見表3。以抑菌圈直徑(Y)為響應值,以發酵溫度(A)、培養基pH值(B)、發酵時間(C)為因子,進行擬合分析,得到回歸方程:Y=20.59-2.42A-0.63B+0.34C+0.19AB+0.017AC+0.04BC-2.96A2-1.56B2-0.75C2。

表2 中心組合試驗設計與結果Table 2 Design and results of center combination experiments

表3 回歸模型方差分析Table 3 Variance analysis of regression model
由表3可知,各因素影響順序為A>B>C,即發酵溫度>培養基pH>發酵時間,回歸模型中A、A2、B2均為極顯著水平(P<0.01),B、C、C2均為顯著水平(P<0.05),交互項AB、BC、AC均不顯著,模型P值<0.000 1,失擬項P值0.240 8>0.05,失擬不顯著,說明回歸方程極顯著。其中決定系數R2=0.995 7、調整決定系數R2Adj=0.990 2,說明此回歸方程擬合度高,故此模型可用來對芽孢桿菌ZYCHH-01產抑菌物質條件優化分析。

圖5 發酵溫度、培養基pH值、發酵時間交互作用對抑菌圈直徑影響的響應曲面與等高線Fig.5 Response surface plots and contour lines of effects of interaction between fermentation temperature,medium pH and fermentation time on inhibition zone diameter
由圖5可知,根據回歸方程所得到的響應曲面,分別反映了發酵溫度,培養基pH,發酵時間三個因素之間的交互作用對抑菌圈直徑大小的影響。每組響應曲面開口向下,表明在此曲面內有最大點。回歸方程的二次項系數均為負值,響應值存在極大值。因此芽孢桿菌ZYCHH-01產抑菌物質最優條件:發酵溫度35.75 ℃,培養基pH值7.78,發酵時間27.65 h,此條件下抑菌圈直徑最大為21.20 mm。
為提高試驗的方便性和可靠性,將最佳培養條件修正為發酵溫度36 ℃,培養基pH值7.8,發酵時間27.5 h。按照修正后條件進行試驗,抑菌圈直徑大小平均值為21.12 mm,與預測值21.20 mm相近。預測值和實際值的良好擬合,證明該模型真實有效。
2.2 最小抑菌濃度的測定

表4 不同上清液稀釋度的抑菌濃度Table 4 Inhibitory concentration of supernatant with different dilution
由表4可知,上清液和乳酸鏈球菌素抑菌圈大小隨著濃度的降低而減小,上清液稀釋1∶64時,抑菌圈直徑為6.02 mm,當稀釋1∶128時,上清液無抑菌活性;此時,陽性對照組乳酸鏈球菌素濃度為78.13 IU/mL,仍有較好的抑菌活性。因此,最小抑菌濃度為上清液稀釋1∶64。
2.3 抑菌物質的特性
2.3.1 不同pH條件下的熱穩定性
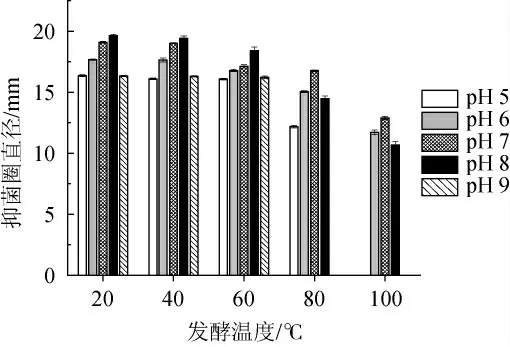
圖6 不同pH值和發酵溫度對抑菌物質活性的影響Fig.6 Effect of different pH and fermentation temperature on antibacterial substances activity
由圖6可知,芽孢桿菌ZYCHH-01所產的抑菌物質活性隨著處理溫度的升高而降低,在20~60 ℃時,抑菌物質均有活性,pH值為8時抑菌圈最大,抑菌活性最高。在80 ℃時,pH值為9的抑菌物質完全失活,抑菌物質在pH值為7抑菌圈最大活性最高,在100 ℃時,pH值為5和9的抑菌物質完全失活,由于高溫使抑菌物質的構象發生改變[17],導致其完全失活,抑菌物質在pH值為7抑菌圈最大活性最高。在pH值為6~8內經高溫處理后,抑菌物質仍保有較好的活性,因此該抑菌物質具有良好的熱穩定性和較好的耐酸堿性。
2.3.2 酶對抑菌物質穩定性的影響
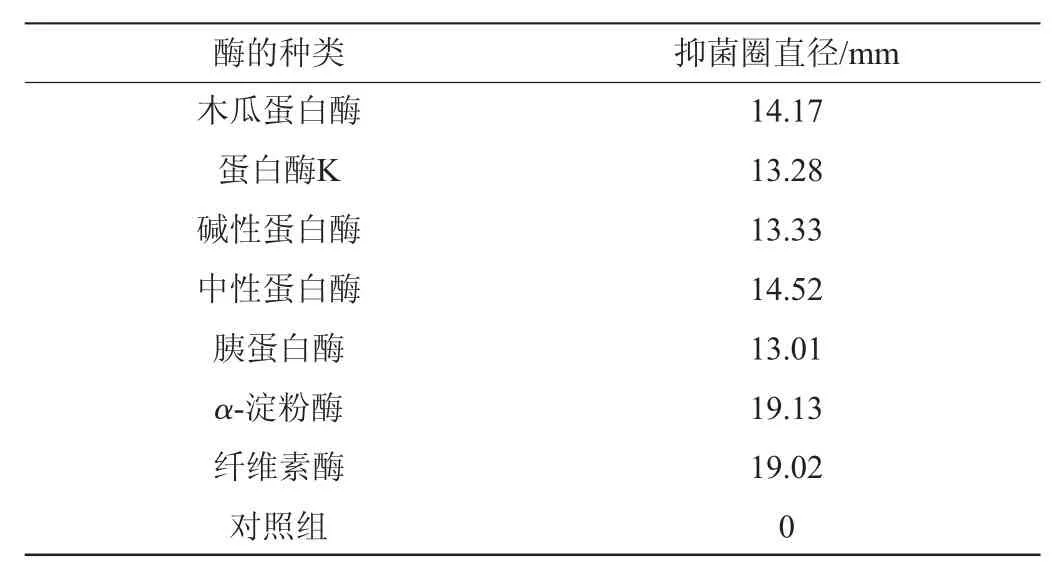
表5 酶對抑菌物質活性的影響Table 5 Effect of enzyme on antibacterial substances activity
由表5可知,經蛋白酶處理后的抑菌物質活性明顯降低,與α-淀粉酶和纖維素酶處理后的試驗組和對照組作對比,表明該抑菌物質中含有蛋白質或者肽,但仍有部分抗菌活性,可能存在多糖或者脂類等其他具有抗菌作用的代謝產物[18],或因蛋白酶的濃度較低處理時間較短導致部分活性蛋白沒有失活[19]。
2.3.3 有機溶劑和表面活性劑對抑菌物質活性的影響

表6 有機溶劑和表面活性劑對抑菌物質活性的影響Table 6 Effect of organic solvents and surfactants on antibacterial substances activity
由表6可知,有機溶劑對抑菌物質的活性影響不顯著,說明該抑菌物質在有機溶劑中有良好的穩定性。Tween 80、Tween 20對抑菌物質的活性基本沒有影響,添加EDTA后,抑菌活性提升明顯,推測EDTA改變了細菌細胞膜的滲透性從而增加了對抑菌物質的敏感性[20],增強了抑菌活性,SDS、Urea破壞了抑菌物質中蛋白的氫鍵和疏水鍵,從而破壞了蛋白質的結構,使抑菌物質失活或者活性降低[21]。
2.3.4 儲藏時間對抑菌物質活性的影響
由圖7可知,將無菌上清液在4 ℃條件儲存,冷藏時間0~6 d,抑菌物質活性較高,隨著時間延長,抑菌物質活性呈先下降后趨于穩定的趨勢,18 d后,抑菌物質仍具有活性且趨于穩定,可能是部分抑菌物質在無菌上清液中發生了氧化,使抑菌活性降低。
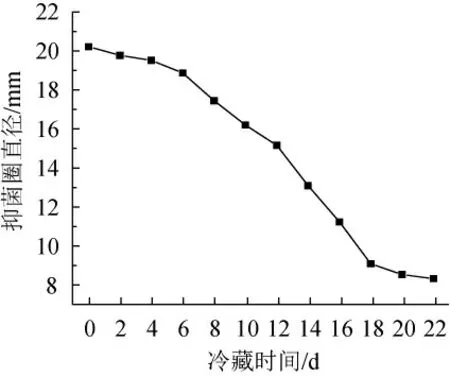
圖7 儲藏時間對抑菌物質活性的影響Fig.7 Effect of storage time on antibacterial substances activity
2.3.5 抑菌物質對不同細菌的活性

表7 抑菌物質對細菌抑菌活性Table 7 Antibacterial activity of antibacterial substances against bacteria
由表7可知,對大腸桿菌的活性顯著,同時對其他3種常見的食源性病菌均有較好的活性。表明此抑菌物質對部分食源性病菌有良好的抑制作用。
3 結論
通過單因素試驗,確定芽孢桿菌ZYCHH-01產抑菌物質最佳單因素條件為培養基pH 8,接種量3%,發酵溫度37 ℃,發酵時間27 h。在單因素試驗的結果上,利用響應面法對其產抑菌物質條件進行優化,確定最佳發酵條件為培養基pH 7.8,接種量3%,發酵溫度36 ℃,發酵時間27.5 h。在此優化條件下,抑菌圈直徑為21.12 mm。采用二倍稀釋法測定最小抑菌濃度為上清液稀釋1∶64。對菌株產的抑菌物質進行研究,發現抑菌物質對蛋白酶敏感,對α-淀粉酶和纖維素酶不敏感,推測抑菌物質中含有蛋白質或肽。抑菌物質活性pH范圍大且在pH6~8環境中具有良好的熱穩定性,經100 ℃處理后,仍有較好活性,較耐存儲,有機試劑和部分表面活性劑對其影響較小,SDS、Urea對其抑菌活性降低影響顯著,但與EDTA共同作用抑菌活性提升明顯,對食源性病菌有良好的抑菌活性。

