功能化間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的制備及其對U(Ⅵ)的吸附行為研究
許玉歷,張 康,肖方竹,王 成,羅佳琦,劉 永,4,彭國文,,4,*
(1.南華大學 化學化工學院,湖南 衡陽 421001;2.南華大學 資源環境與安全工程學院,湖南 衡陽 421001;3.南華大學 公共衛生學院,湖南 衡陽 421001;4.南華大學 湖南省鈾尾礦庫退役治理工程技術研究中心,湖南 衡陽 421001)
新能源在我國經濟可持續發展和國防建設中占有重要的地位,而核能作為一種低碳環保的新能源,具有明顯的優勢。但在核燃料循環及核技術應用過程中會產生大量的放射性廢水。鈾作為放射性廢水中的一種主要元素[1-3],如果排放到環境中將對人類和其他物種構成嚴重威脅[4-5],因此必須得到妥善處理。另外,從含鈾廢水中對U(Ⅵ)進行回收利用對緩解我國鈾資源的供需矛盾具有重大的現實意義。目前,含鈾廢水的主要處理方法有化學沉淀法、離子交換法[6]、吸附法[7-8]、液液萃取法等,其中,吸附法由于易操作和成本低,是一種優良的方法[9]。
杯芳烴是由苯酚單元通過亞甲基相連的環狀低聚物,是繼冠醚、環糊精之后的第3代超分子主體化合物[10-11],它既具有冠醚的空穴結構和空間延展性,又具有環糊精的親水疏水等優點,因此杯芳烴有幾個明顯的特點:空腔可調節、構象可變換、易于對其上下沿進行化學改性和修飾等。正是由于杯芳烴獨特的性能,使得其作為繼環糊精和冠醚之后的第3代超分子化合物,在分子(離子)識別、膜傳輸、金屬離子的分離和回收、酶模擬、化學傳感器、光電材料等領域展現了具大的應用潛力[12-15]。目前,已有不少國內外研究人員將合成的杯芳烴類衍生物作為吸附劑應用于含鈾廢水的處理,但對杯[4]芳烴同時進行上沿羧基化和下沿硫化得到間羧基苯偶氮基杯[4]芳烴對稱硫醚類化合物用于含鈾廢水的處理還鮮有文獻報道。
本文擬采用化學合成法,制備一種新型的吸附劑材料間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物,通過儀器分析對合成的新材料進行結構表征,并探討其對U(Ⅵ)的吸附行為。
1 實驗
1.1 主要儀器和試劑
SHT型數顯恒溫攪拌電熱套,山東省鄄城新華電熱儀器有限公司;AL104 電子天平,梅特勒-托利多儀器(上海)有限公司;UV-Vis 8500型紫外-可見分光光度計,上海天美科學儀器有限公司;pHS-3C型精密pH計,上海雷磁儀器廠;SHZ-D(Ⅲ)循環水式真空泵,臺州求精真空泵有限公司;DF205電熱鼓風干燥箱,北京中興偉業儀器有限公司;IR Prestige-21型傅里葉變換紅外光譜儀,日本島津公司。
對叔丁基苯酚,99%,化學純,阿拉丁生化科技股份有限公司;間氨基苯甲酸,分析純,天津市科密歐化學試劑有限公司;鈾標準溶液,采用文獻[12]方法配制(根據實驗需要稀釋成對應濃度);脫叔丁基杯[4]芳烴參照文獻[16]合成。其他試劑均為分析純。
1.2 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的合成
間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的合成路線示于圖1。
首先向燒杯中加入10 mL質量分數為6%的氫氧化鈉溶液,再加入1.7 g間氨基苯甲酸,水浴加熱直至溶解,然后冷卻至室溫,加入0.7 g亞硝酸鈉溶解;在攪拌下分批滴加到冰水和濃硫酸混合液中,溫度保持在0 ℃以下,在冰浴中反應15 min后加入0.2 g尿素攪拌15 min;再將混合液緩慢滴加到混有1.8 g對叔丁基杯[4]芳烴的80 mL N,N-二甲基酰胺(DMF)中(冰水浴),用質量分數為25%的醋酸鈉調節pH=6~7,溶液由磚紅色逐漸變成大紅色,有大量泡沫產生;在冰水浴中反應1.5 h后,用濃鹽酸調節pH<1,在室溫下靜置過夜,然后抽濾,干燥后得暗紅色固體粗產品,產率為86%,將粗產品溶解到50 mL碳酸氫鈉溶液中,再加入1 g活性炭加熱攪拌至60 ℃趁熱抽濾,收集濾液,用濃鹽酸酸化沉淀,抽濾,固體真空干燥得暗紅色固體(產物a),產率為77%。
稱取1.8 g產物a、1 g無水K2CO3,移取3 mL 1,3-二溴丙烷(98%)、38 mL CH3CN加入到100 mL單口圓底燒瓶中,在N2保護下,70 ℃磁力攪拌加熱回流48 h后,冷卻至室溫,真空旋轉蒸至剩余少量溶劑和固體殘余物,向殘余物中加入稀鹽酸和CHCl3(各20 mL)。水洗至中性,萃取分離有機相,并加入無水MgSO4干燥后過濾,加20 mL甲醇靜置得產物b,產率68.5%。
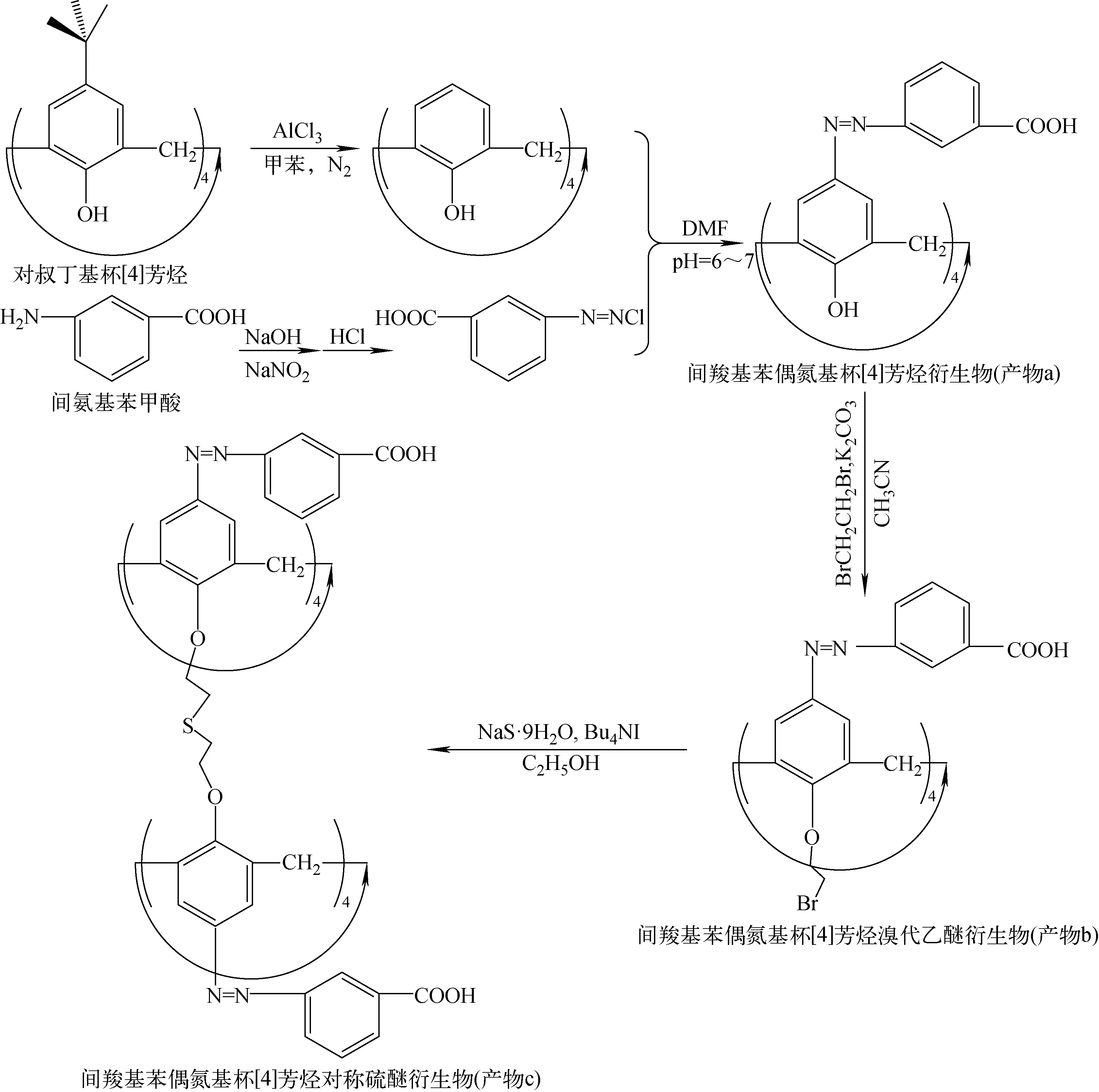
圖1 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的合成路線Fig.1 Synthesis route of m-carboxyphenyl azo calix[4]arene symmetrical sulfide derivative
稱取1.2 g產物b、1.45 g四丁基碘化銨和0.48 g Na2S·9H2O,加入10 mL蒸餾水和25 mL無水乙醇于100 mL單口圓底燒瓶中,在N2保護下,70 ℃磁力攪拌加熱回流12 h后,冷卻至室溫,真空旋轉蒸發,有機相用飽和NaCl溶液洗滌至中性后,用蒸餾水洗去殘余的NaCl,再用無水MgSO4干燥后過濾,加入20 mL甲醇靜置得最終產物c,產率為69.3%。
1.3 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對鈾的吸附
在一系列50 mL具塞錐形瓶中加入10 mL一定濃度的鈾標準溶液,再加入一定量的間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物,用0.05 mol/L HCl和0.05 mol/L NaOH調節溶液pH值,將具塞錐形瓶置于25 ℃恒溫水浴搖床內以250 r/min恒溫振蕩吸附4 h,靜置5 min分層,移取1 mL上清液,加入10 mL比色管中,再在比色管中依次加入1 mL 0.05%的偶氮胂Ⅲ、適量醋酸-醋酸鈉緩沖溶液(pH=4)定容,振蕩搖勻后靜置10 min。用紫外可見分光光度計在波長652 nm處分別測其吸光度,并根據以下公式計算相應的吸附率P(%)和吸附容量qt(mg/g)。
(1)
(2)
其中:c0為鈾初始濃度,mg/L;ct為t時刻鈾的剩余濃度,mg/L;V為所用鈾溶液體積,L;m為吸附劑質量,g。
2 結果與討論
2.1 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的結構表征
1) FT-IR分析

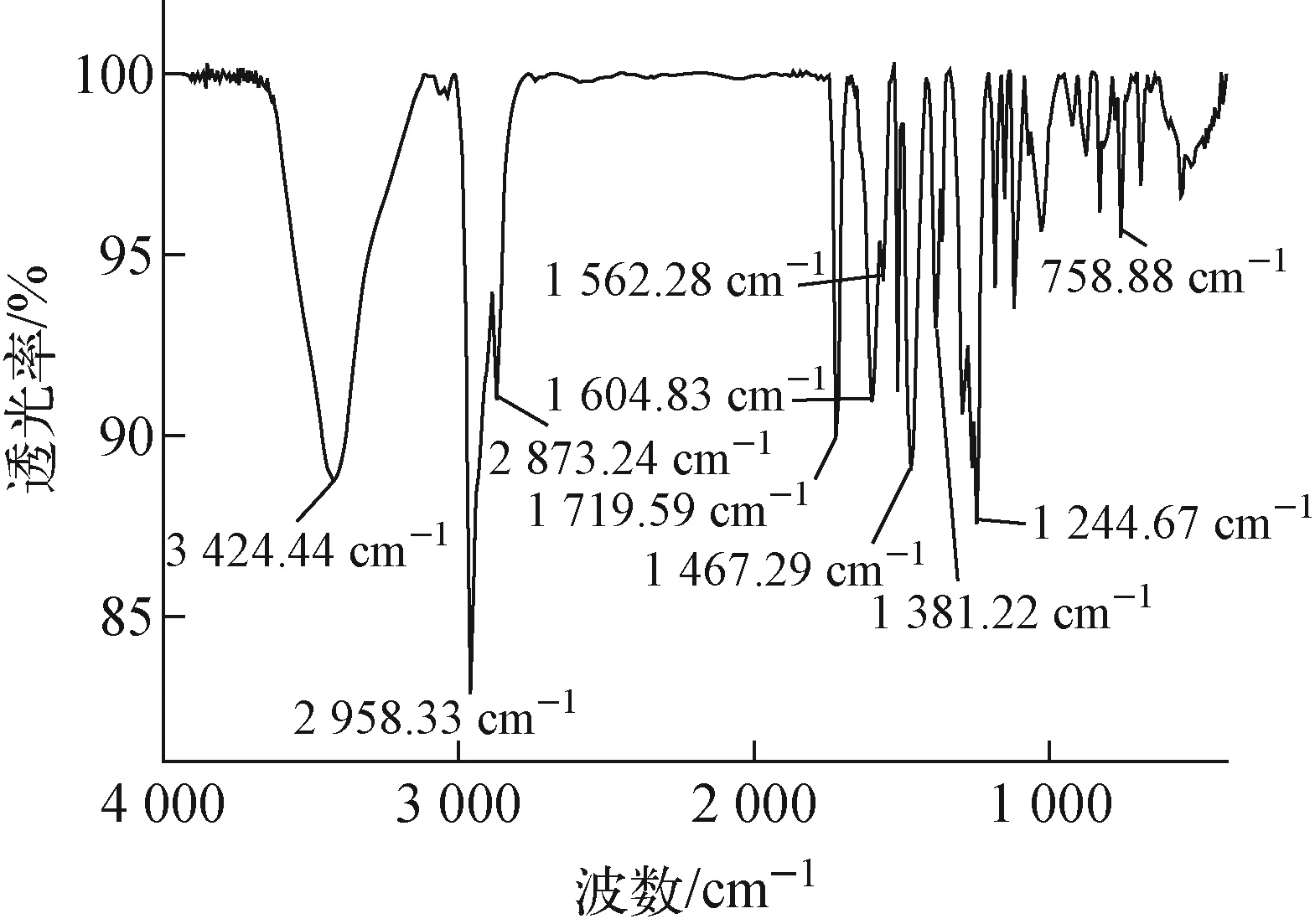
圖2 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的FT-IR譜Fig.2 FT-IR spectrum of m-carboxyphenyl azo calix[4]arene symmetrical sulfide derivative
2)1H NMR分析
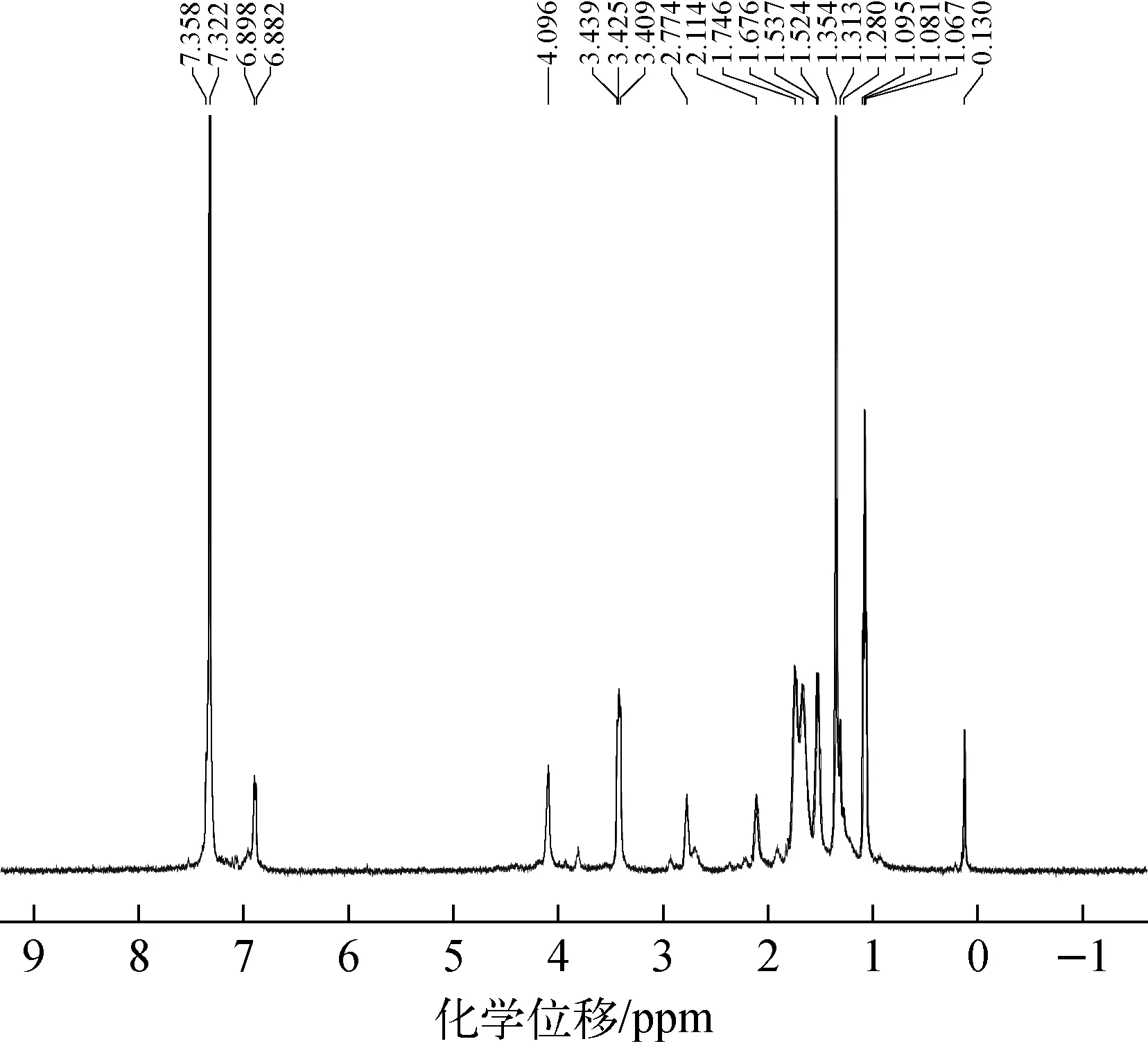
圖3 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的1H-NMR譜Fig.3 1H-NMR spectrum of m-carboxyphenyl azo calix[4]arene symmetrical sulfide derivative
間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的1H-NMR譜示于圖3。從圖3可知,6.882~7.358 ppm處對應苯環上的氫,3.409~4.096 ppm處對應亞甲基上的氫,1.746~1.067 ppm處對應叔丁基上的氫。由此可知,該物質具備間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物的基本官能團[18]。
2.2 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對U(Ⅵ)吸附效果的影響因素分析
1) 初始pH值
c0=10 mg/L、m=10 mg、T=25 ℃、t=4 h條件下,初始pH值對吸附的影響示于圖4。
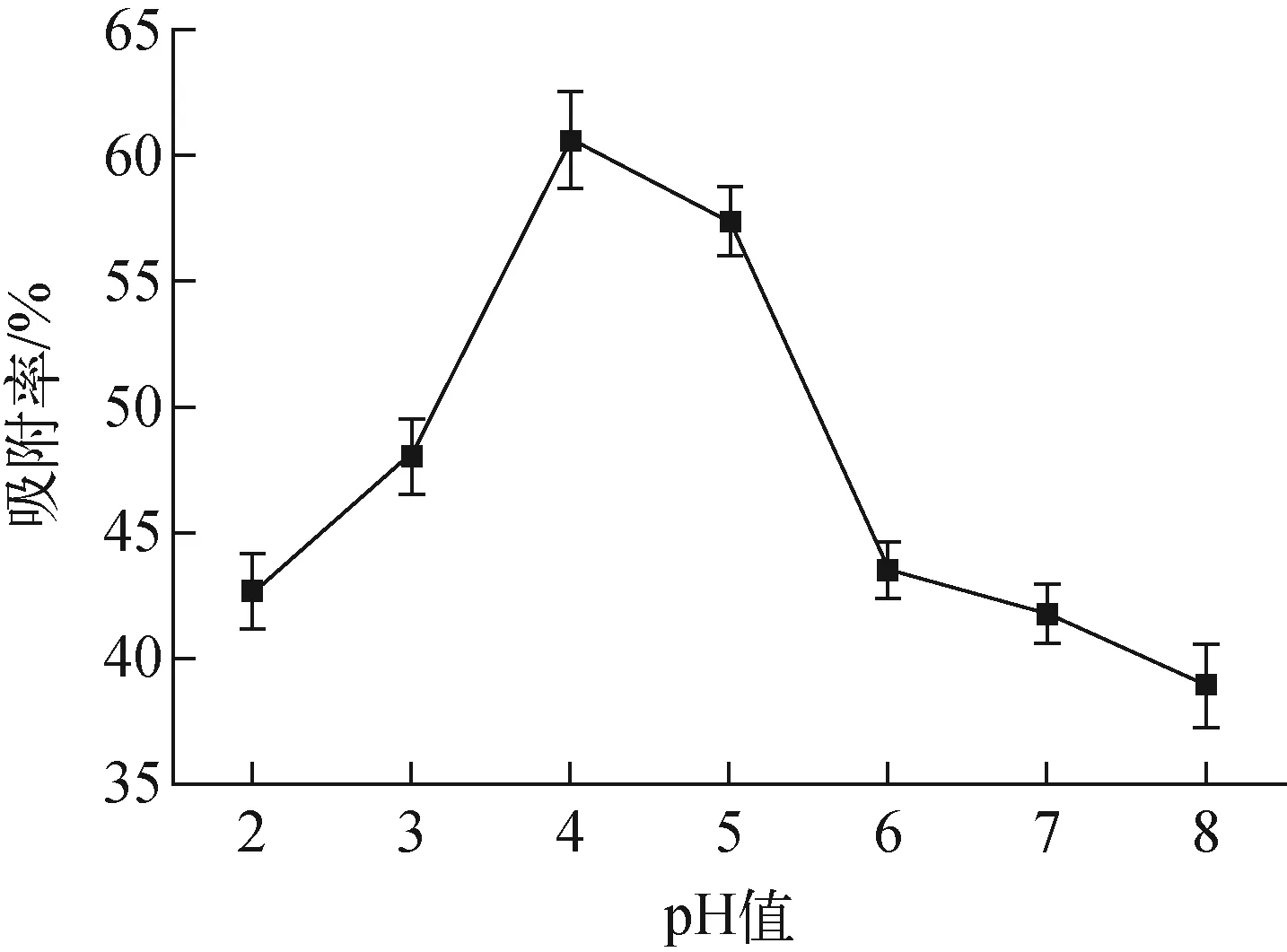
圖4 初始pH值對吸附的影響Fig.4 Effect of initial pH on adsorption
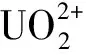
2) 吸附劑用量
c0=10 mg/L、T=25 ℃、t=4 h、初始pH=4條件下,吸附劑用量對吸附的影響示于圖5。
從圖5可看出,吸附率隨吸附劑用量的增加而提高。這可能是因為隨吸附劑濃度的增加,相應地也增加了吸附活性位點和空穴,從而使吸附率上升;當吸附劑用量增加到一定程度時,如趨近于10 mg時,吸附趨于平衡狀態,吸附率無明顯上升,綜合考慮,吸附劑最佳用量為10 mg。
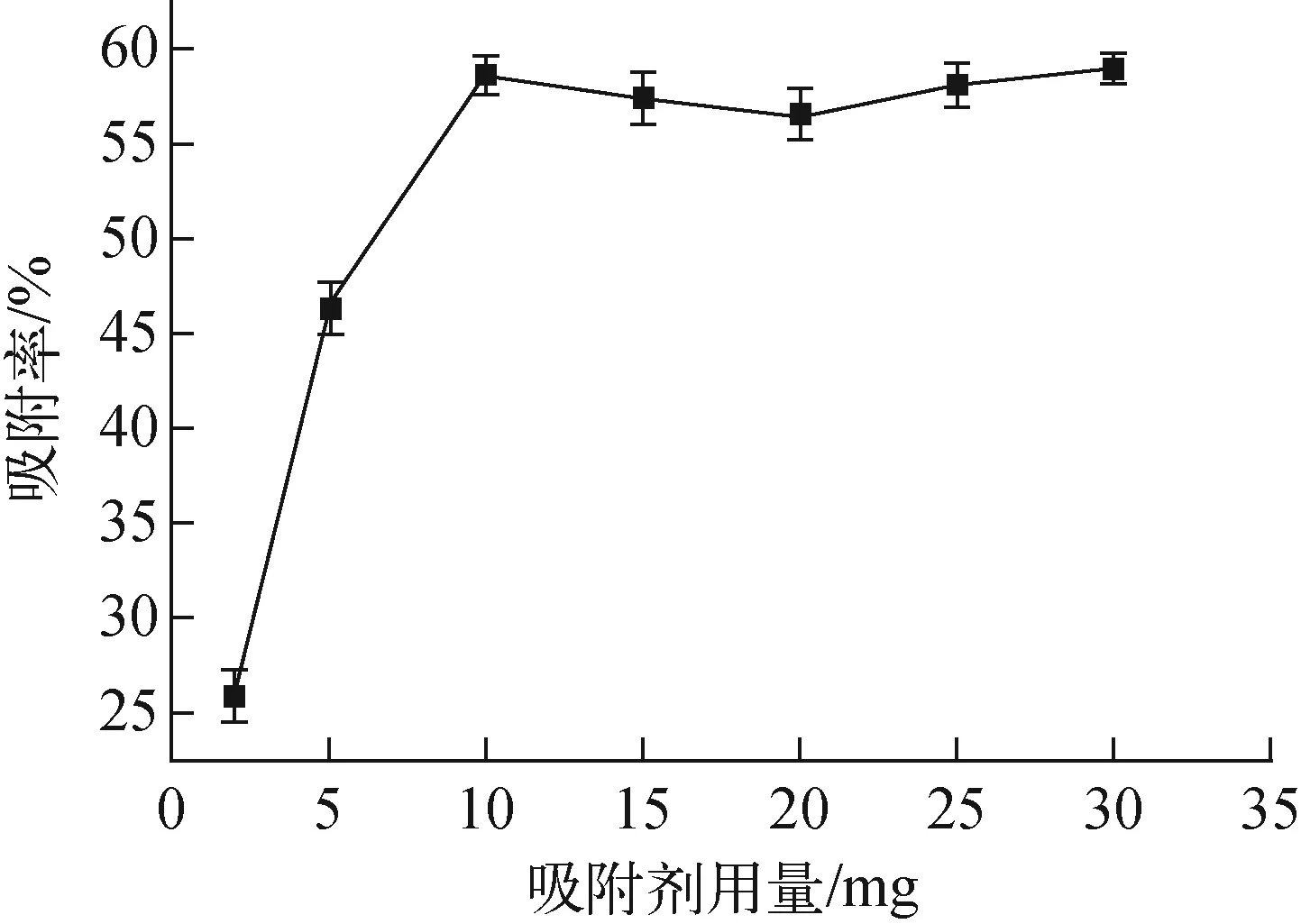
圖5 吸附劑用量對吸附的影響Fig.5 Effect of dosage of adsorbent on adsorption
3) 鈾初始濃度
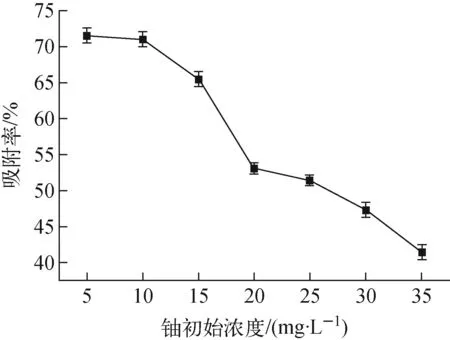
圖6 鈾初始濃度對吸附的影響Fig.6 Effect of initial concentration of uranium on adsorption
m=10 mg、T=25 ℃、t=4 h、初始pH=4條件下,鈾初始濃度對吸附的影響示于圖6。從圖6可看出,隨鈾初始濃度的增加,吸附劑對鈾的吸附率逐漸減小。這可能是由于在不同濃度但體積相同的溶液中添加相同質量的吸附劑,當鈾初始濃度較低時,吸附劑與鈾酰離子能充分接觸,吸附率較高。但一定質量下的吸附劑其活性位點有限,當吸附達到平衡時,吸附位點逐漸飽和,之后隨著鈾初始濃度的增高,吸附劑對鈾的吸附率則降低。綜合考慮,最佳的鈾初始濃度為10 mg/L。
4) 吸附動力學
c0=10 mg/L、m=10 mg、T=25 ℃、初始pH=4條件下,吸附時間對吸附的影響示于圖7。
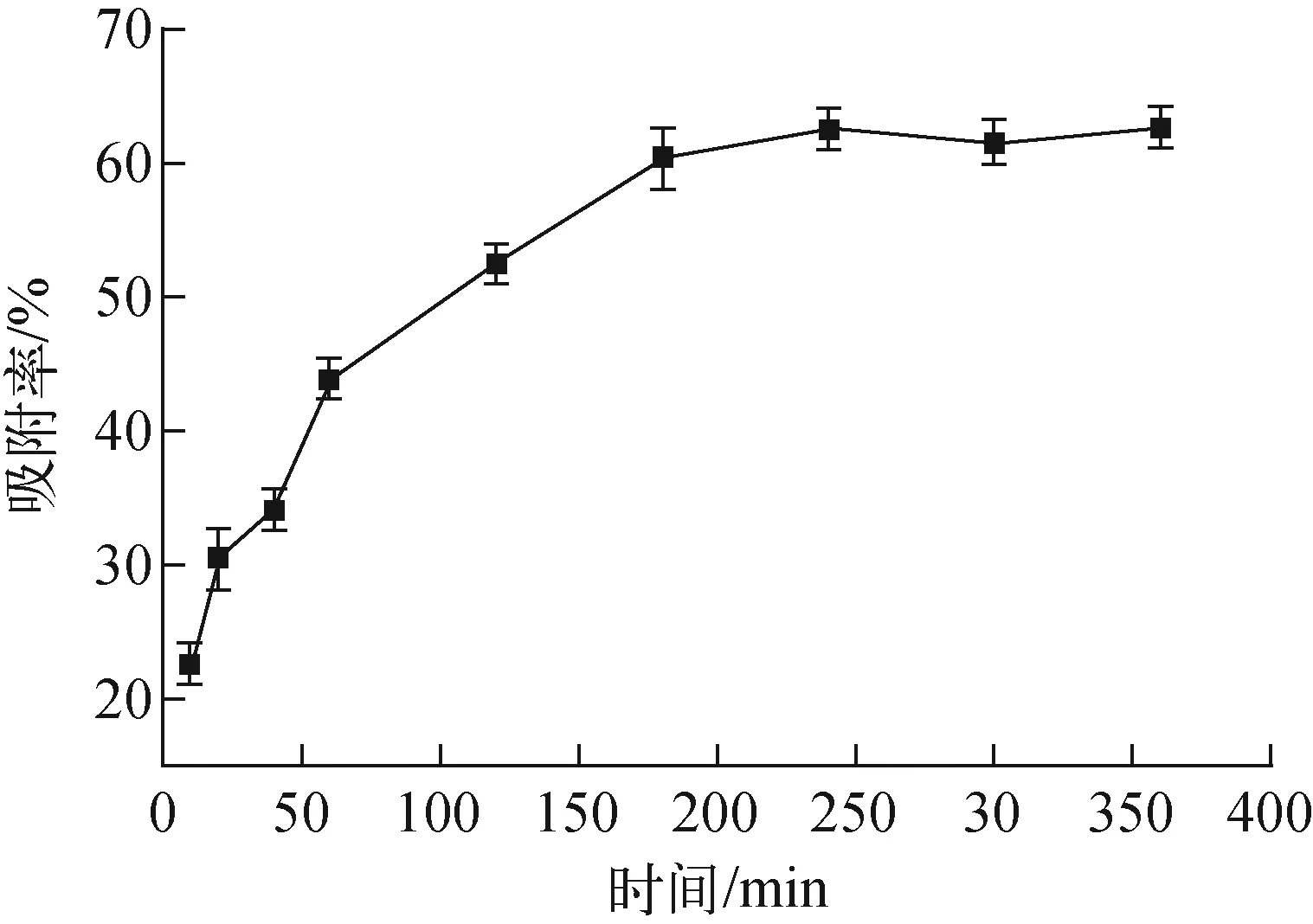
圖7 吸附時間對吸附的影響Fig.7 Effect of adsorption time on adsorption
由圖7可看出,間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對U(Ⅵ)的吸附率隨時間的增加而增大,在0~4 h內,隨時間的增加吸附率快速增大,這是因為剛加入吸附劑時,U(Ⅵ)吸附位點數量多,而溶液中U(Ⅵ)的濃度也較大,因此兩者之間的結合概率增加;隨著吸附時間的延長,在吸附時間接近4 h時,吸附劑上與U(Ⅵ)的吸附位點接近飽和,直到4 h時達到平衡。
為進一步探討間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對U(Ⅵ)的吸附動力學,在c0=10 mg/L、m=10 mg、T=25 ℃、pH=4條件下,采用準一級動力學模型和準二級動力學模型對吸附數據進行線性擬合分析。
準一級動力學擬合方程為:
(3)
準二級動力學擬合方程為:
(4)
其中:k1為準一級反應吸附速率常數,min-1;k2為準二級反應吸附速率常數,g/(mg·min);qe為平衡吸附容量,mg/g。
準一級、準二級動力學模型擬合參數列于表1。

表1 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對U(Ⅵ)的吸附動力學參數Table 1 Kinetic parameter for adsorption of U(Ⅵ) by m-carboxyphenyl azo calix[4]arene symmetrical sulfide derivative
由表1可見,準一級動力學模型的擬合系數R2=0.857 7,小于準二級動力學模型的R2=0.988 3,因此間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對U(Ⅵ)的吸附特性更符合準二級動力學模型,說明該吸附過程主要以化學吸附為主。
5) 吸附溫度
c0=10 mg/L、m=10 mg、t=4 h、初始pH=4條件下,吸附溫度對吸附的影響示于圖8。
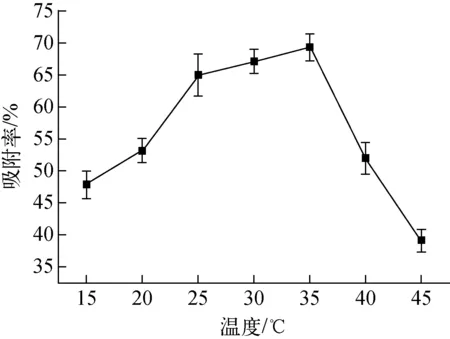
圖8 溫度對吸附的影響Fig.8 Effect of temperature on adsorption
從圖8可看出,隨著溫度的升高,吸附率逐漸上升,這可能是由于升高溫度后,反應體系內紊亂程度上升,吸附劑與U(Ⅵ)的碰撞概率增大,使得吸附率上升。溫度達到35 ℃時,吸附率達到峰值,此時再升高溫度,吸附率不再升高反而下降,這可能是由于高溫條件下吸附劑活性有所降低,考慮到現實環境中的自然因素,選25 ℃作為實驗溫度。
6) 吸附等溫線分析
為進一步研究間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對U(Ⅵ)的吸附過程,采用Langmuir和Freundlich吸附等溫模型擬合間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對U(Ⅵ)的等溫吸附過程。
Langmuir吸附等溫模型為:
(5)
Freundlich吸附等溫模型為:
(6)
其中:qmax為單層飽和吸附容量,mg/g;ce為平衡時溶質的濃度,mg/L;b為Langmuir吸附常數,L/mg;k為Freundlich吸附常數;1/n為不均勻因子。
分別對ce/qe-ce和lgqe-lgce作圖,結果示于圖9。
從圖9可看出,由Langmuir吸附等溫模型所得相關擬合系數R2=0.984 8。而由Freundlich吸附等溫模型所得相關擬合系數R2=0.928 8。由于Langmuir吸附等溫模型的R2大于Freundlich吸附等溫模型的R2,且Langmuir吸附等溫模型的qmax與實驗值非常接近,表明該吸附過程更符合Langmuir吸附等溫模型,即吸附劑通過其表面的吸附位點對金屬離子進行吸附,形成單分子吸附層,且被吸附的離子間無相互作用。則說明間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物對U(Ⅵ)的吸附以單層吸附為主。
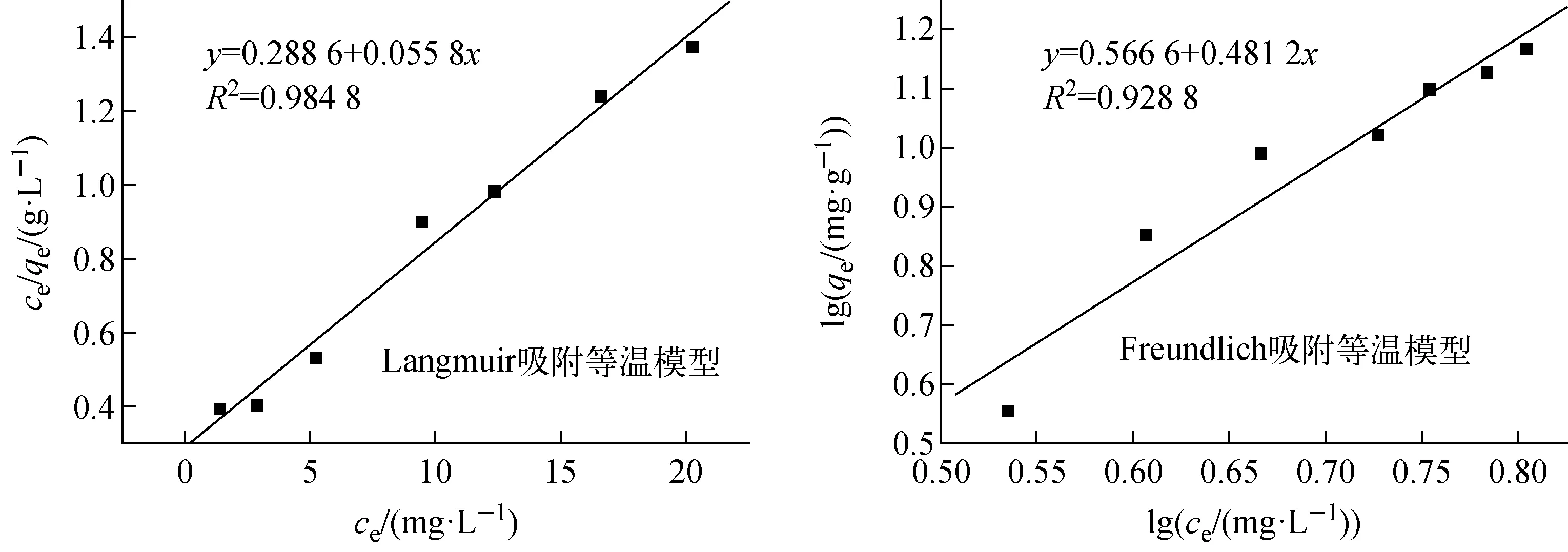
圖9 間羧基苯偶氮基杯[4]芳烴對稱硫醚衍生物吸附U(Ⅵ)的吸附等溫線Fig.9 Adsorption isotherm for adsorption of U(Ⅵ) by m-carboxyphenyl azo calix[4]arene symmetrical sulfide derivative
3 結論


