基于16S rRNA基因序列鑒定秘魯莖柔魚和澳洲雙柔魚
田瀟然 呂世鑫 陳玉春 王洪濤


摘 要:通過對秘魯莖柔魚及澳洲雙柔魚的線粒體16S rRNA基因片段進行聚合酶鏈式反應(polymerase chain reaction,PCR)擴增和序列比對,確定2 種柔魚品種的特異性位點,并由此設計品種特異性引物。利用多重PCR體系對秘魯莖柔魚和澳洲雙柔魚進行快速、準確地鑒定和區分,并對該體系的靈敏度進行檢驗。結果表明:在多重PCR體系下,秘魯莖柔魚和澳洲雙柔魚分別擴增出長度400、229 bp的品種特異性條帶,2 種柔魚的混合樣品則同時擴增出長度400、229 bp的條帶;且該多重PCR體系可以檢測澳洲雙柔魚中1%秘魯莖柔魚的摻入,檢測限為0.1 ng。
關鍵詞:秘魯莖柔魚;澳洲雙柔魚;16S rRNA;多重聚合酶鏈式反應
Abstract: The aim of this study is to establish a rapid and accurate method for molecular discrimination of two squid species, Nototodarus gouldi and Dosidicus gigas. The fragments of mitochondrial 16S rRNA were amplified by polymerase chain reaction (PCR) from the genomic DNA of each squid species. Polymorphic sites were determined by multiple sequence alignments and species-specific primers were designed. Multiplex PCR was conducted for molecular identification of the two squid species with the species-specific primer pairs. Multiplex PCR results showed that specific amplicons of 400 and 229 bp were generated from D. gigas and N. gouldi, respectively. Both 400 and 229 bp amplicons were obtained from the mixtures of the two species. The sensitivity test results showed that the method could detect D. gigas adulteration at 1% in N. gouldi with a limit of detection of 0.1 ng.
Keywords: Dosidicus gigas; Nototodarus gouldi; 16S rRNA; multiplex polymerase chain reaction
頭足類(Cephalopoda)為軟體動物門(Mollusca)的重要類群,現存總類800余種[1],是海洋中最大的食物資源之一。頭足類水產品一直以來都屬于全世界重點開發的海洋漁業資源,近幾十年來,世界頭足類捕撈量在海洋捕撈漁業中的份額呈現持續增長趨勢[2]。頭足類海產品數量龐大,種類豐富,目前已經進行商業性開發的主要有柔魚類(Ommastrephidae)、槍烏賊類(Loliginidae)、烏賊類(Sepiidae)和章魚類(Octopodidae)等,其中,柔魚類的開發比重最大[3]。柔魚類生長周期短,味道鮮美,富含蛋白質和多種人體必需氨基酸,營養價值很高[4],可食用部分可達80%以上,素有“窮人的鮑魚”之稱。莖柔魚(Dosidicus gigas)亦稱“秘魯莖柔魚”,柔魚科(Ommastrephidae)、莖柔魚屬(Dosidicus)[5]。
廣泛分布于中部太平洋以東海域,尤其在秘魯沿岸及外海資源豐富[6-7]。秘魯莖柔魚生長速度快、體型較大、世界范圍內產量較高,是全球最重要的經濟頭足類資源之一[8]。據聯合國糧食及農業組織(Food and Agriculture Organization,FAO)統計,2003—2012年世界秘魯莖柔魚的年平均產量達到77.84 萬t[9]。澳洲雙柔魚(Nototodarus gouldi)亦稱“澳大利亞魷”,只分布于澳大利亞東南部和西部海域以及新西蘭海域[10],目前開發力度不大,年最高產量不足萬噸,因此價值較高。
秘魯莖柔魚營養豐富,但是由于體內非蛋白氮(nonprotein nitrogen,NPN)和某些游離氨基酸的存在,會散發出氨的氣味,且肉質偏苦[11]。因此,秘魯莖柔魚的市場價值遠遠低于相對稀少的澳洲雙柔魚。往往會有不法商販為了追求更高的經濟利益,而將秘魯莖柔魚假冒或摻入澳洲雙柔魚中進行市場銷售。傳統的柔魚鑒定方式主要是通過形態學特征,如大小的差異、形狀的不同及色澤的多變來加以區分和鑒定[12-13],但在不同環境生長、處于不同發育階段、經歷不同加工方式的同種柔魚之間,外觀形態也會產生很大差異。并且為了保證遠洋柔魚的鮮度,一般制成凍品或半成品保存[14],或是通過加工成柔魚丁、柔魚圈、柔魚絲和烤柔魚片等柔魚制品進行市場流通[15]。形態學鑒定適合整條魚的物種鑒定,一旦進行了切片、絞碎等工藝,形態學特征徹底缺失以后,柔魚的鑒定將變得異常困難[16]。因此,尋求一種高效、快速鑒別澳洲雙柔魚和秘魯莖柔魚的方法顯得尤為重要。
DNA分子標記技術由于具有特異性好、靈敏度高、操作簡單且重復性好等優勢,已被越來越多地運用到物種鑒定中,它能夠反映不同物種個體或種群之間基于基因組的某些差異特征,是DNA分子水平上遺傳多樣性的直接反映[17-18]。在魚類基因組序列中,核基因和線粒體基因為常用的兩大類分子標記,但由于核基因中存在大量內含子等非編碼序列,因此很難找到合適的分子來進行標記。線粒體基因組作為獨立存在于高等動物細胞核外唯一的遺傳物質,基因排列結構緊密,進化速度快,嚴格母系遺傳且在細胞質中大量存在,相對簡單且適合運用于DNA分子標記生物學研究。本研究通過聚合酶鏈式反應(polymerase chain reaction,PCR)技術擴增秘魯莖柔魚和澳洲雙柔魚的線粒體16S rRNA基因片段,并進行測序和分析,根據2 種柔魚品種測序結果序列之間單核苷酸多態性(single nucleotide polymorphism,SNP)位點的差異,設計品種特異性引物,從而通過多重PCR體系對2 種柔魚單獨樣品和混合樣品進行區分和鑒定。
1 材料與方法
1.1 材料與試劑
秘魯莖柔魚和澳洲雙柔魚由某公司提供,產地分別為秘魯和澳大利亞。
海洋動物組織基因組DNA提取試劑盒(DP324-02)天根生化科技(北京)有限公司;2×Premix DNA polymerase、Agarose、100 bp PlusII DNA Ladder(BM321)、雙蒸水 北京全式金生物技術有限公司;無水乙醇(分析純) 天津市富宇精細化工有限公司。
1.2 儀器與設備
TG18W臺式高速微量離心機 長沙湘智離心機儀器公司;T100TM PCR儀 美國Bio-Rad公司;DYY-10C電泳儀 北京六一儀器廠;Microchemi 4.2凝膠成像
系統 以色列DNR公司。
1.3 方法
1.3.1 基因組DNA的提取
以所選秘魯莖柔魚和澳洲雙柔魚的冷凍樣品作為原料,剪取肌肉組織保存于95%乙醇中。取保存樣品肌肉組織30 mg左右,剪碎后置于已滅菌的研缽內,混合液氮研磨至粉末狀,采用海洋動物組織基因組DNA提取試劑盒進行提取,所得基因組DNA于-20 ℃條件下保存備用。
1.3.2 PCR擴增與測序
對于所提取2 種柔魚基因組DNA片段,針對海洋動物線粒體16S rRNA基因序列,使用16S rRNA通用引物進行PCR擴增[19]。用于擴增線粒體16S rRNA基因的通用引物由英濰捷基(上海)貿易有限公司合成,序列分別為16SF:5-CGCCTGTTTAACAAAAACAT-3和16SR:5-CCGGTCTGAACTCAGATCACGT-3。
PCR反應總體系為20 μL:模板DNA 10 ng、2×Premix DNA polymerase 10 μL、正向及反向引物各2 μL(0.5 μmol/L),加滅菌雙蒸水至20 μL。PCR反應條件:94 ℃預變性4 min,94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸30 s,共33 個循環,72 ℃延伸5 min。
PCR擴增結束后,通過混有熒光染料溴化乙錠(ethidium bromide,EB)的1%瓊脂糖凝膠電泳對PCR產物進行檢測,并將在凝膠成像系統觀測下條帶清晰、明亮且單一的產物送至英濰捷基(上海)貿易有限公司北京實驗室進行正反雙向測序。
1.3.3 特異性引物設計
測序完成獲得原始序列數據后,將正向、反向引物數據導入SeqMan軟件,去除兩端不可信部分后進行人工拼接,秘魯莖柔魚和澳洲雙柔魚得到長度分別約為552、553 bp的16S rRNA基因序列(Genbank登錄號分別為GU324169和GQ365324)。通過GenBank數據庫下載得相應柔魚的線粒體16S rRNA基因序列,并在數據庫中進行Nucleotide Blast比對,根據序列相似度對樣品的物種進行鑒別,再次確保所選樣品物種與標簽一致。通過Clustal X軟件對測序結果進行多序列對比和分析,并用Primer Premier 5軟件設計秘魯莖柔魚和澳洲雙柔魚的品種特異性引物。
1.3.4 多重PCR鑒定
以秘魯莖柔魚和澳洲雙柔魚的雙位點特異性引物為正向引物,利用Primer Premier 5軟件篩選二者的反向引物。篩選反向引物時注意3 條引物的退火溫度保持接近,并避免模板錯配及引物間二聚體的產生,確定利用16SR作為反向引物。利用3 條引物對2 種柔魚的模板DNA及混合樣品進行多重PCR擴增。多重PCR反應總體系為20 μL:模板DNA 10 ng、2×Premix DNA polymerase 10 μL、正向引物DGF 1 μL(0.5 μmol/L)、正向引物NGF 1 μL(0.5 μmol/L)、反向引物16SR 2 μL(0.5 μmol/L),加滅菌雙蒸水至20 μL。PCR反應條件:94 ℃預變性4 min,94 ℃變性30 s,54 ℃退火30 s,72 ℃延伸30 s,共33 個循環,72 ℃延伸5 min。多重PCR擴增結束后,通過混有熒光染料EB的1%瓊脂糖凝膠電泳,在凝膠成像系統中對多重PCR產物進行檢測。
1.3.5 靈敏度測定及市售樣品檢測
為測定該多重PCR體系的靈敏度,將DNA模板總量設置為10 ng,以2 種柔魚的混合樣品為模板,其中秘魯莖柔魚DNA的質量分數依次為0%、1%、2%、10%及50%。同時分別對市售的2 種秘魯莖柔魚和2 種澳洲雙柔魚樣品進行檢測,以驗證本方法在實際中應用的可行性。多重PCR反應條件如1.3.4節所述。擴增結束后,在凝膠成像系統中對多重PCR產物進行檢測。
2 結果與分析
2.1 16S rRNA序列比對
通過線粒體16S rRNA通用引物擴增出的秘魯莖柔魚和澳洲雙柔魚基因序列長度分別約為552、553 bp,并上傳至GenBank數據庫。由圖1可知:對2 種柔魚品種的擴增基因序列進行比對后,第173和174號位秘魯莖柔魚顯示為T、C堿基,而澳洲雙柔魚則為C、T堿基,根據這2 個錯配堿基設計秘魯莖柔魚的正向特異性引物DGF;第345、346、347號位秘魯莖柔魚顯示為A、A、T堿基,而澳洲雙柔魚則為G、G、C堿基,根據這3 個錯配堿基設計澳洲雙柔魚的正向特異性引物NGF。
2.2 特異性引物設計結果
根據秘魯莖柔魚的SNP位點,設計其正向特異性引物DGF(5-GAAGGTTAATCTGTCTCCATC-3),利用通用引物16SR作為反向引物;根據澳洲雙柔魚的SNP位點,設計其正向特異性引物NGF(5-TATGATTAATAACTTCCTTAGGC-3),同樣利用通用引物16SR作為反向引物。2 種柔魚的品種特異性引物在16S rRNA基因序列中的相對位置如圖1所示。
2.3 多重PCR鑒定結果
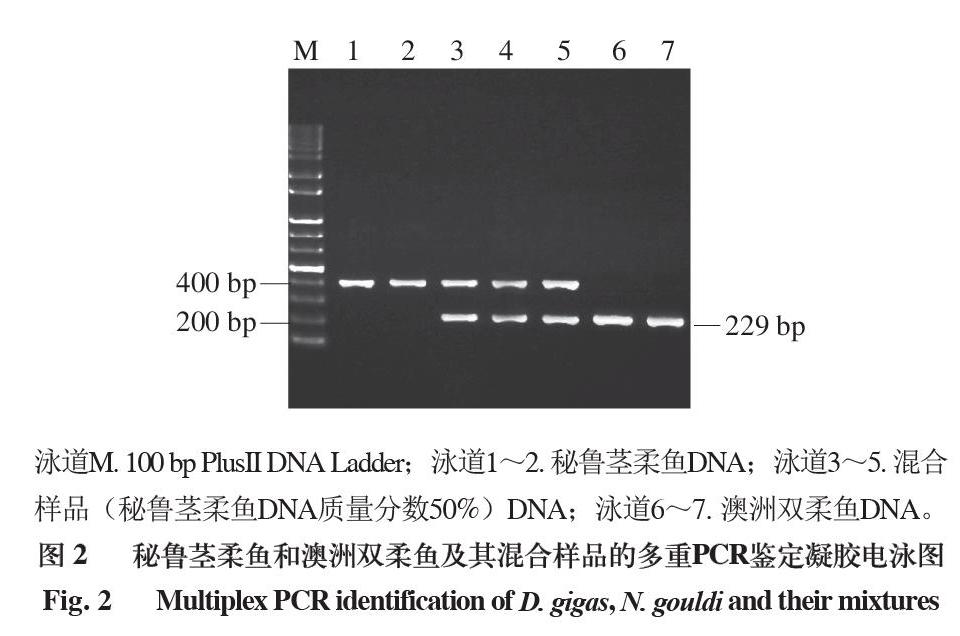
以秘魯莖柔魚和澳洲雙柔魚的基因組DNA及混合樣品DNA作為模板,利用秘魯莖柔魚的特異性引物DGF、澳洲雙柔魚的特異性引物NGF及16SR 3 條引物進行多重PCR擴增。在凝膠成像系統中對多重PCR產物進行檢測。
泳道M. 100 bp PlusII DNA Ladder;泳道1~2. 秘魯莖柔魚DNA;泳道3~5. 混合樣品(秘魯莖柔魚DNA質量分數50%)DNA;泳道6~7. 澳洲雙柔魚DNA。
由圖2可知,經過多重PCR擴增后,秘魯莖柔魚和澳洲雙柔魚DNA分別擴增出各自的品種特異性條帶,同時,2 種柔魚的混合樣品DNA同時擴增出2 種特異性條帶。將2 種條帶切膠回收后進行克隆測序,測得2 種特異性條帶的序列及長度與圖1中2 種柔魚的序列完全一致,長度分別為400、229 bp。由此可見,2 種柔魚的特異性引物對相應柔魚品種產生了絕對特異性。
對秘魯莖柔魚和澳洲雙柔魚的多個樣品進行重復性實驗后,檢測結果穩定可靠,重復性好。表明利用秘魯莖柔魚和澳洲雙柔魚特異性引物所建立的多重PCR體系不僅可以有效鑒定2 個柔魚品種,也能對其混合樣品進行快速、有效地區分與鑒定。
2.4 靈敏度測定結果
泳道M. 100 bp PlusII DNA Ladder;泳道1~5. 混合樣品DNA,其中秘魯莖柔魚DNA質量分數依次為0%、1%、2%、10%、50%;泳道6~7. 市售秘魯莖柔魚DNA;泳道8~9. 市售澳洲雙柔魚DNA。
由圖3可知,秘魯莖柔魚和澳洲雙柔魚的混合樣品均產生2 條特異性條帶,其中秘魯莖柔魚的特異性條帶長度為400 bp,澳洲雙柔魚的特異性條帶長度為229 bp,且隨著混合樣品中秘魯莖柔魚DNA含量的增加,秘魯莖柔魚的特異性條帶亮度也逐漸增強。表明該多重PCR體系可以檢測澳洲雙柔魚中1%秘魯莖柔魚的摻入,檢測限為0.1 ng。在市售的2 種秘魯莖柔魚和2 種澳洲雙柔魚樣品檢測中發現,1 種澳洲雙柔魚樣品存在摻入秘魯莖柔魚現象,而其他3 種柔魚樣品均可正確檢測其樣品來源。因此,本方法靈敏度高,可對市場上的柔魚原料來源進行準確檢測。
3 結 論
通過16S rRNA基因序列確定的品種特異性引物建立多重PCR體系,一管多檢,有效減少了試劑消耗和操作時間。在秘魯莖柔魚、澳洲雙柔魚混合DNA樣品中,目標DNA也能高效擴增并且不受非目標DNA的干擾,可以在同一個PCR反應中同時對秘魯莖柔魚、澳洲雙柔魚的單獨樣品及混合樣品進行有效區分和鑒定,大大提高了檢測效率,滿足了相關柔魚類品種的檢測需要。進行多次重復性檢測后,實驗結果重復性好、準確率高,方法具有操作簡單、檢測時間短、無污染、應用廣泛等優點。
對于魚類水產品的物種鑒定,伴隨著當今現代分子生物學技術的蓬勃發展,基于DNA分子水平的鑒定方法愈發展現出巨大的潛力。常見的DNA分子標記技術有簡單重復序列(simple sequence repeats,SSR)[20-21]、
限制性片段長度多態性(restriction fragment length polymorphism,RFLP)[22]、擴增片段長度多態性(amplified fragment length polymorphism,AFLP)[23]、隨機擴增多態性DNA(randomly amplified polymorphic DNA,RAPD)[24]和DNA條形碼(DNA Barcoding)[25-27]等。其中,SSR分子標記需經過聚丙烯酰胺凝膠電泳,且電泳條帶緊密,區分往往不太明顯;RFLP分子標記作為最早的分子標記技術,需用限制性內切酶對DNA進行消化,并使用放射性標記探針,操作復雜繁瑣,且DNA消耗量大;AFLP分子標記也需對DNA進行限制性內切酶雙酶切處理,再進行人工拼接,擴增片段常需要經過聚丙烯酰胺凝膠電泳和銀染等手段進行分離檢測,操作繁雜;RAPD分子標記為顯性遺傳,存在共遷移問題,并且實驗重復性較差;DNA條形碼技術需要對每次PCR擴增出的片段進行測序處理,比較準確,但也耗費較多時間。相較于其他方法,本方法簡單高效,針對秘魯莖柔魚和澳洲雙柔魚的未知樣品,只需DNA提取、PCR擴增和凝膠電泳3 步即可完成鑒定,鑒定成本較低且結果差異明顯。本方法從分子水平上對秘魯莖柔魚、澳洲雙柔魚的單獨樣品及其混合樣品進行檢測,范圍更加廣泛,結果更加準確,為我國柔魚品種真偽鑒別提供了新依據,起到規范市場和保護消費者利益的作用,也為我國柔魚產業的健康發展和相關制度的實施提供了技術支持。
參考文獻:
[1] ALLCOCK A L, LINDGREN A, STRUGNELL J M. The contribution of molecular data to our understanding of cephalopod evolution and systematics: a review[J]. Journal of Natural History, 2015, 49(21/24): 1373-1421. DOI:10.1080/00222933.2013.825342.
[2] ARKHIPKIN A I, BIZIKOV V A, DOUBLEDAY Z A, et al. Techniques for estimating the age and growth of molluscs: cephalopoda[J]. Journal of Shellfish Research, 2018, 37(4): 783-792. DOI:10.2983/035.037.0409.
[3] 陳新軍. 世界頭足類資源開發現狀及我國遠洋魷釣漁業發展對策[J]. 上海海洋大學學報, 2019, 28(3): 321-330. DOI:10.12024/jsou.20181102445.
[4] 宋旻鵬, 汪金海, 鄭小東. 中國經濟頭足類增養殖現狀及展望[J]. 海洋科學, 2018, 42(3): 149-156. DOI:10.11759/hykx20180128001.
[5] 陳新軍, 劉必林, 王堯耕. 世界頭足類[M]. 北京: 海洋出版社, 2009: 190-194.
[6] WALUDA C M, YAMASHIRO C, ELVIDGE C D, et al. Quantifying light-fishing for Dosidicus gigas in the eastern Pacific using satellite remote sensing[J]. Remote Sensing of Environment, 2004, 91(2):?129-133. DOI:10.1016/j.rse.2004.02.006.
[7] 章寒, 鄭基, 虞聰達, 等. 東太平洋赤道海域莖柔魚主要生物學特性比較研究[J]. 中國水產科學, 2019, 26(4): 745-755. DOI:10.3724/SP.J.1118.2019.19010.
[8] IB??EZ C M, SEP?LVEDA R D, ULLOA P, et al. The biology and ecology of the jumbo squid Dosidicus gigas (cephalopoda) in Chilean waters: a review[J]. Latin American Journal of Aquatic Research, 2015, 43(3): 402-414. DOI:10.3856/vol43-issue3-fulltext-2.
[9] Food and Agriculture Organization. The state of world fisheries and aquaculture 2016: contributing to food security and nutrition for all[M]. Rome: FAO, 2016.
[10] BRALEY M, GOLDSWORTHY S D, PAGE B, et al. Assessing morphological and DNA-based diet analysis techniques in a generalist predator, the arrow squid Nototodarus gouldi[J]. Molecular Ecology Resources, 2010, 10(3): 466-474. DOI:10.1111/j.1755-0998.2009.02767.x.
[11] PALAFOX H, C?RDOVA-MURUETA J H, NAVARRETE DEL TORO M A, et al. Protein isolates from jumbo squid (Dosidicus gigas) by pH-shift processing[J]. Process Biochemistry, 2009, 44(5):?584-587. DOI:10.1016/j.procbio.2009.02.011.
[12] 蘇杭. 幾何形態測量學法在大洋性頭足類種間及種群鑒別中的應用[D]. 上海: 上海海洋大學, 2016: 29-62.
[13] 張靜, 李淵, 宋娜, 等. 我國沿海棱鳀屬魚類的物種鑒定與系統發育[J]. 生物多樣性, 2016, 24(8): 888-895. DOI:10.17520/biods.2016079.
[14] 顧仲朝, 吳媛, 王萍亞, 等. 頭足類水產品揮發性鹽基氮變化規律的研究[J]. 食品工業, 2018, 39(3): 173-177.
[15] 曲映紅, 陳新軍, 陳舜勝. 我國魷魚加工利用技術研究進展[J].?上海海洋大學學報, 2019, 28(3): 357-364. DOI:10.12024/jsou.20190102498.
[16] 王嘉鶴, 陳雙雅, 陳偉玲, 等. DNA檢測方法在魚類物種鑒定中的應用[J]. 海南大學學報(自然科學版), 2012, 30(3): 293-298. DOI:10.3969/j.issn.1004-1729.2012.03.022.
[17] 陳星, 高子厚. DNA分子標記技術的研究與應用[J]. 分子植物育種, 2019, 17(6): 1970-1977.
[18] 施文瑞, 王磊, 陳軍平, 等. 魚類性別特異性DNA分子標記研究進展[J]. 水產科學, 2018, 37(6): 862-866. DOI:10.16378/j.cnki.1003-1111.2018.06.023.
[19] SIMON C, FRATI F, BECKENBACH A, et al. Evolution, weighting, and phylogenetic utility of mitochondrial gene sequences and a compilation of conserved polymerase chain reaction primers[J]. Annals of the Entomological Society of America, 1994, 87(6):?651-701. DOI:10.1093/aesa/87.6.651.
[20] LIU Lianwei, CHEN Xinjun, XU Qianghua, et al. Development of 39 polymorphic microsatellite markers for the jumbo squid Dosidicus gigas using Illumina paired-end sequencing[J]. Conservation Genetics Resources, 2014, 6(3): 673-676. DOI:10.1007/s12686-014-0179-7.
[21] 隋宥珍, 劉連為, 陳新軍. 三種柔魚類SSR標記的通用性檢測[J]. 浙江海洋學院學報(自然科學版), 2015, 34(6): 532-536. DOI:10.3969/j.issn.1008-830X.2015.06.006.
[22] MCKEOWN N J, ROBIN J P, SHAW P W. Species-specific PCR-RFLP for identification of early life history stages of squid and other applications to fisheries research[J]. Fisheries Research, 2015, 167: 207-209. DOI:10.1016/j.fishres.2015.02.007.
[23] HAN Zhiqiang, LIN Longshan, SHUI Bonian, et al. Genetic diversity of small yellow croaker Larimichthys polyactis revealed by AFLP markers[J]. African Journal of Agricultural Research, 2009, 4(7):
605-610. DOI:10.1021/jf900470c.
[24] ROCCO L, VALENTINO I V, SCAPIGLIATI G, et al. RAPD-PCR analysis for molecular characterization and genotoxic studies of a new marine fish cell line derived from Dicentrarchus labrax[J]. Cytotechnology, 2014, 66(3): 383-393. DOI:10.1007/s10616-013-9586-y.
[25] HEBERT P D N, CYWINSKA A, BALL S L, et al. Biological identifications through DNA barcodes[J]. Proceedings of the Royal Society B: Biological Sciences, 2003, 270: 313-321. DOI:10.1098/rspb.2002.2218.
[26] WARD R D, ZEMLAK T S, INNES B H, et al. DNA barcoding Australias fish species[J]. Philosophical Transactions of the Royal Society B-Biological Sciences, 2005, 360: 1847-1857. DOI:10.1098/rstb.2005.1716.
[27] KATUGIN O N, CHICHVARKHINA O V, ZOLOTOVA A O, et al. DNA barcoding for squids of the family Gonatidae (Cephalopoda: Teuthida) from the boreal North Pacific[J]. Mitochondrial DNA Part A, 2017, 28(1/2): 41-49. DOI:10.3109/19401736.2015.1110792.

