一株α-淀粉酶產生菌的分離、鑒定及產酶條件研究
曹丹,彭浩,2,*,蘭阿峰,2,解修超,2,鄧百萬,2,趙航軻,2
(1.陜西理工大學生物科學與工程學院,陜西漢中723000;2.陜西省食藥用菌工程技術研究中心,陜西漢中723000)
淀粉酶能夠水解淀粉生成葡萄糖、麥芽糖以及其它低聚糖,按結構的不同可以分為α-淀粉酶、β-淀粉酶、糖化酶以及異淀粉酶4 種[1]。其中,α-淀粉酶(液化酶)能夠分解直鏈淀粉和支鏈淀粉分子內部的α-1,4糖苷鍵而產生葡萄糖和少量麥芽糖及麥芽三糖[2]。α-淀粉酶存在于自然界各種動植物以及微生物中,被廣泛應用于食品工業、醫藥工業、紡織業、畜牧業以及環保領域[3]。
α-淀粉酶是我國工業生產中產量最高的酶制劑產品,產量約占我國整個酶制劑產品產能的一半以上[4]。近年來,雖然我國投產的淀粉酶品種和產能在不斷增加,但在菌種及生產工藝上與國外相比尚有一定差距[5]。由于進行產酶基因工程菌株構建存在成本高,難度大等問題。因而,目前產酶菌株仍然以分離野生菌株后馴化為主,需要不斷從自然界中分篩選性能優異的菌株,為淀粉酶的工業生產帶來新的活力[6-7]。
隨著制酶工業的發展,對高產淀粉酶產生菌的選育已經成為研究熱點。土壤蘊含著大量的微生物資源,尤其富含產生各種酶類的細菌[8-9]。本文從富含淀粉酶產生菌的不同土壤環境中分離篩選高產淀粉酶菌株,并對其產酶條件進行初步研究,以期為相關工業生產奠定理論及應用基礎。
1 材料與方法
1.1 樣品采集
試驗所用樣品采集時間為2018 年3 月,采集地點為陜西省漢中市勉縣天元面粉廠廠區、陜西理工大學食堂廚余垃圾傾倒處和陜西省漢中市康田農業園區菜園土壤樣品,采集深度為5 cm~15 cm 共計9 份土壤樣品于4 ℃保存。
1.2 培養基
1)初篩培養基:蛋白胨 10.0 g,牛肉膏 3.0 g,NaCl 5.0 g,可溶性淀粉2.0 g,瓊脂粉20.0 g,加蒸餾水至1 000 mL,pH 值自然,121 ℃,滅菌 20 min[10];
2)種子培養基:蛋白胨 10.0 g,牛肉膏 3.0 g,NaCl 5.0 g,加蒸餾水至 1 000 mL,pH 值自然,121 ℃,滅菌20 min[11];
3)發酵培養基:無水氯化鈣 8.0 g,可溶性淀粉10.0 g,磷酸氫二鈉8.0 g,硫酸銨 8.0 g,加蒸餾水至1 000 mL,pH 值:7.0~7.2,121 ℃,滅菌 20 min[12];
1.3 菌株的分離和篩選
1)平板初篩:在無菌條件下,將采集的土壤樣品稱取25 g 加入到225 mL 裝有若干玻璃珠的無菌水中制備菌懸液,80 ℃水浴鍋中保持20 min,去除不耐熱的非芽孢桿菌,水浴后靜置5 min[13]。依次做10 倍梯度稀釋液至 10-6,分別移取 10-4、10-5和 10-6的稀釋液各200 μL,涂布于初篩培養基上,(36±1)℃培養 24 h~48 h 后,觀察菌落生長情況,并滴加0.05%碘液測定菌落周圍透明圈直徑(H)以及菌落直徑(C),計算其比值[14]。
2)搖瓶復篩:將初篩獲得的菌株接種于100 mL 種子培養基中,(36±1)℃,130 r/min 振蕩培養 48 h 后,以5%接種量將上述種子液接種于100 mL 液體發酵培養基中,相同的條件培養48 h,發酵液以5 000 r/min離心10 min 取上清,測定其酶活力[15]。
1.4 酶活力測定
1.4.1 麥芽糖標準曲線的繪制
以麥芽糖為參照物質,按3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)法繪制標準曲線[16]。
1.4.2 淀粉酶酶活力測定
取1 mL 稀釋后的酶液于試管中,加入1 mL 磷酸氫二鈉-檸檬酸緩沖液配制含1%可溶性淀粉的底物溶液,40 ℃ 保溫 10 min,加入 2 mL DNS 試劑,煮沸顯色10 min,于540 nm 波長處測定吸光度值,根據標準曲線計算酶活力單位[17]。[酶活力單位定義:在40 ℃,pH 6.0 條件下,每分鐘從1 mL 1 %的可溶性淀粉溶液中釋放出1 mmol 麥芽糖的酶量定義為一個酶活力單位(U/mL)[18]]。
1.5 菌株鑒定
1.5.1 傳統形態學和生理生化鑒定
通過平板培養觀察其菌落形態,并進行革蘭氏染色和芽孢染色觀察其特征[19];參照文獻[20]進行相關生理生化試驗。
1.5.2 16S rDNA 序列分析
將提取的菌株總DNA 經瓊脂糖凝膠電泳檢測后,使用16S rDNA 通用引物進行聚合酶鏈式反應(polymerase chain reaction,PCR)擴增[21]。引物由上海生工生物工程有限公司提供,其正向引物(27F):5'-AGTTTGATCCTGGTCAG-3';反向引物(1492R):5'-GGTTACCTTGTTACGACTT - 3';擴增程序為:94 ℃,5 min;94 ℃,30 s;55 ℃~65 ℃,30 s;72 ℃,2 min;共計30 個循環;72 ℃ 延伸 10min,擴增引物 4 ℃保存[22-24]。將產物送交上海生工生物工程有限公司測序,將測得序列提交NCBI 數據庫進行Blast 同源比對,使用MEGA5.0 軟件分析,Neighbor-Joining 法構建菌株系統進化樹,確定菌株的分類地位[25]。
1.6 菌株的產酶條件優化
1.6.1 最佳產酶條件單因素試驗設計
選擇6 種碳源(可溶性淀粉、糊精、玉米淀粉、麩皮、蔗糖和葡萄糖),6 種氮源(蛋白胨、硝酸銨、牛肉粉、酵母膏、牛肉粉+蛋白胨和酵母膏+蛋白胨),6 種無機鹽(硫酸錳、硝酸鉀、硫酸鎂、硝酸鈉、無水氯化鈣和硫酸亞鐵),分別等量代替發酵培養基中的碳源、氮源和無機鹽,配制不同發酵培養基發酵培養后測定發酵液酶活力,根據酶活力大小篩選出最佳碳源、氮源和無機鹽。
1.6.2 正交試驗設計
根據單因素試驗篩選出的培養基成分,設計正交試驗,見表1,確定最佳培養基配方。
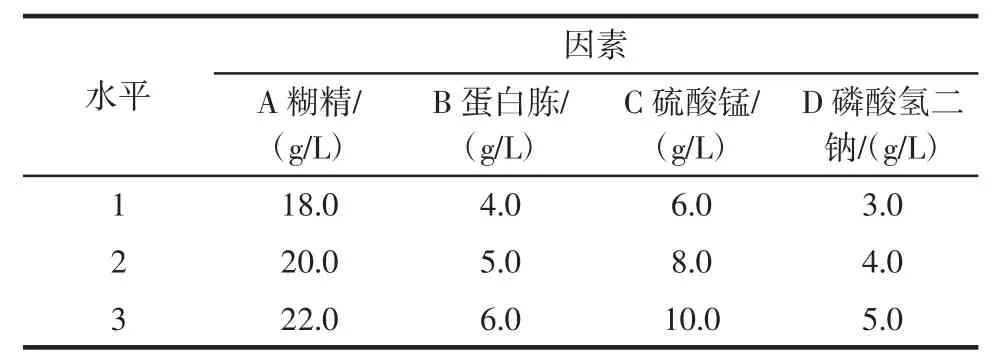
表1 產淀粉酶菌株培養基組分優化的正交試驗方案Table 1 Orthogonal test protocol for optimization of medium components for amylase producing strains
1.6.3 培養條件單因素試驗設計
以優化后的培養基為基礎進行單因素試驗,分別分析不同初始 pH 值(5.5、6.0、6.5、7.0 和 7.5)、培養時間(24、48、72、96 h 和 120 h)、轉速(100 、110、120、130 r/min 和 140 r/min)和培養溫度(28、31、34、37 ℃和40 ℃)對菌株產酶能力的影響。
2 結果與分析
2.1 菌株的分離和初篩
將1.3 中的土壤稀釋液涂布于初篩平板培養后,根據菌落形態和顯微形態的差異,共獲得產淀粉酶菌株173 株。分別測定菌株直徑1 mm 時透明圈直徑(H)與菌落的直徑(C)比值,即H/C 值,篩選出1 株淀粉酶產生能力較強的菌株,編號MF04,具體見圖1。其H/C值為4.37,酶活力值為32.5 U/mL。
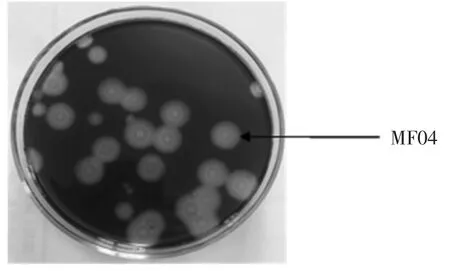
圖1 菌株MF04Fig.1 Strain MF04
2.2 形態學觀察及生理生化試驗結果
革蘭氏染色和芽孢染色形態如圖2、圖3 所示。

圖2 革蘭氏染色形態Fig.2 Gram staining morphology
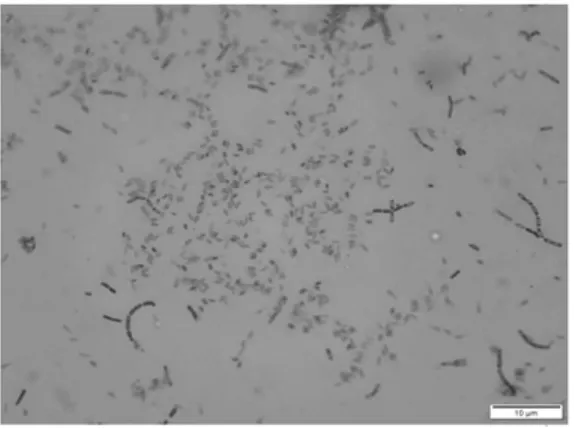
圖3 芽孢染色形態Fig.3 Spore staining morphology
通過平板培養后觀察菌株MF04 菌落呈現乳白色,不透明,菌落大,表面粗糙,有褶皺,不規則,挑起呈絲狀。菌體大小約(1.0~1.2)×(3.0~5.0)μm,長桿狀。經革蘭氏染色和芽孢染色,鑒定其為革蘭氏陽性細菌,芽孢可見,長約1.5 μm,呈橢圓形。對菌株MF04 進行生理生化試驗,菌株MF04 與枯草芽孢桿菌,蠟狀芽孢桿菌的生理生化特征類似,結果如表2 所示。

表2 生理生化試驗鑒定結果Table 2 Physiological and biochemical test identification results
2.3 分子生物學鑒定結果
菌株MF04 經16S rDNA 通用引物PCR 擴增后,用瓊脂糖凝膠電泳檢測結果見圖4。
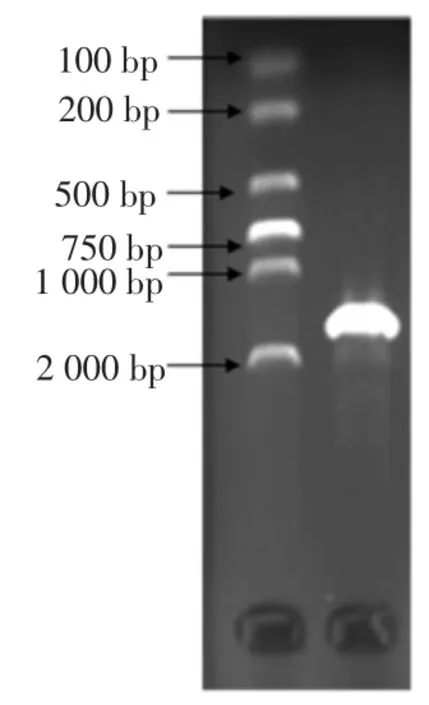
圖4 菌株MF04 16S rDNA 電泳檢測結果Fig.4 Results of strain MF04 16S rDNA electrophoresis
結果表明,菌株MF04 與蠟狀芽孢桿菌,枯草芽孢桿菌,蘇云金芽孢桿菌等的16S rDNA 都具有高度相似性,同源性均為99 %,構建系統發育樹,如圖5 所示,分析其與Bacillus cereus strain 親緣關系最近。
2.4 產酶條件研究
2.4.1 單因素試驗結果
碳源、氮源、無機鹽離子對菌株MF04 產酶活力的影響見圖6、圖7 和圖8。
培養基中不同碳源、氮源和無機鹽對菌株產酶能力的影響較大,當碳源為2%糊精,氮源為0.5%蛋白胨,無機鹽為0.4%硫酸錳時,菌株MF04 的產酶能力最強,酶活力最高,為48.2 U/mL。

圖5 菌株MF04 16S rDNA 序列系統發育樹Fig.5 Strain MF04 16S rDNA sequence phylogenetic tree
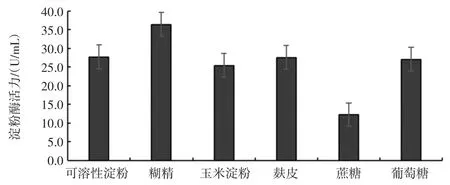
圖6 不同碳源對菌株MF04 產酶活力的影響Fig.6 Effect of different carbon sources on enzyme activity of strain MF04
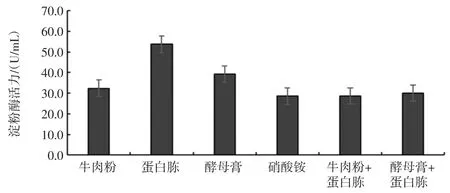
圖7 不同氮源對菌株MF04 產酶活力的影響Fig.7 Effect of different nitrogen sources on enzyme activity of strain MF04
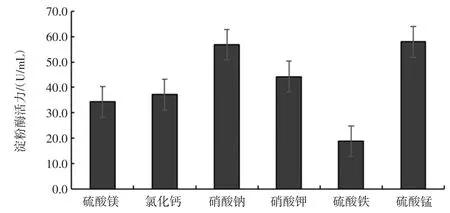
圖8 無機鹽離子對菌株MF04 產酶活力的影響Fig.8 Effect of inorganic salt ions on enzyme activity of strain MF04
2.4.2 正交試驗結果
根據單因素試驗結果進行四因素三水平正交試驗,結果見表3。
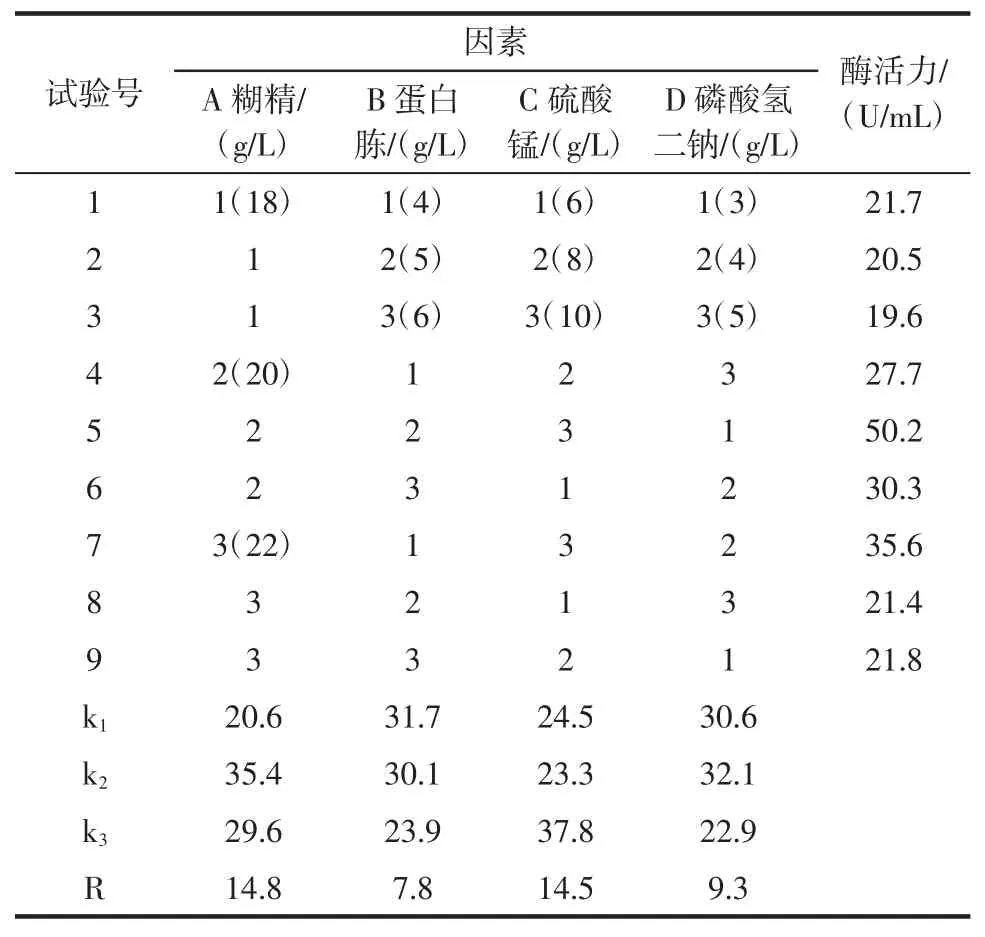
表3 產淀粉酶菌株培養基組分優化的正交試驗結果Table 3 Orthogonal test results of optimization of medium components for amylase producing strains
結果顯示:碳源糊精(A)對菌株產酶能力的影響最大,其次為無機鹽硫酸錳(C)、磷酸氫二鈉濃度(D)以及氮源(B),即 A>C>D>B;對應的最佳組合為 A2B1C3D2,即配方為 20.0 g/L 糊精,4.0 g/L 蛋白胨,10.0 g/L 硫酸錳和4.0 g/L 磷酸氫二鈉時,其產酶能力顯著高于其他組合,酶活力最高為56.2 U/mL。
2.4.3 發酵條件的優化
初始pH 值、培養時間、培養溫度、轉速對菌株MF04產酶能力的影響結果見圖9、圖10、圖11 和圖12。
單因素結果顯示在發酵液初始pH 6.0,發酵時間為72 h,發酵溫度為37 ℃,轉速為130 r/min 時產酶能力最佳,酶活力最高,達到60.2 U/mL。

圖9 初始pH 值對菌株MF04 產酶能力的影響Fig.9 Effect of initial pH on enzyme production capacity of strain MF04
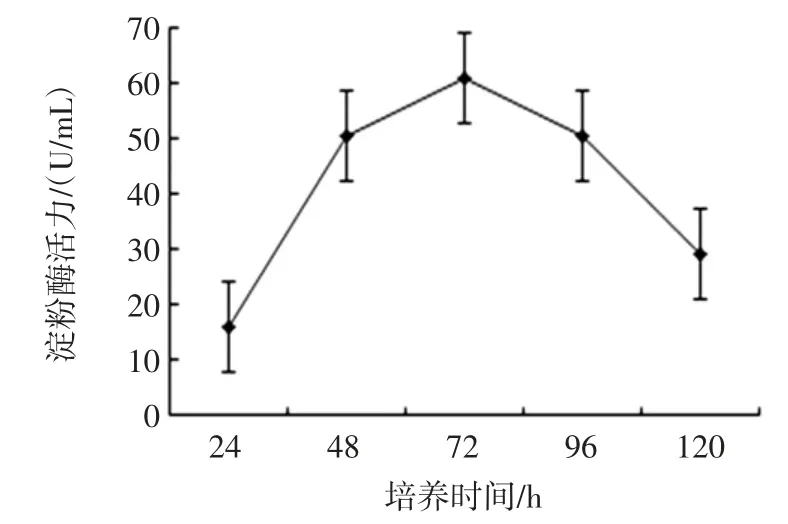
圖10 培養時間對菌株MF04 產酶能力的影響Fig.10 Effect of culture time on enzyme production ability of strain MF04
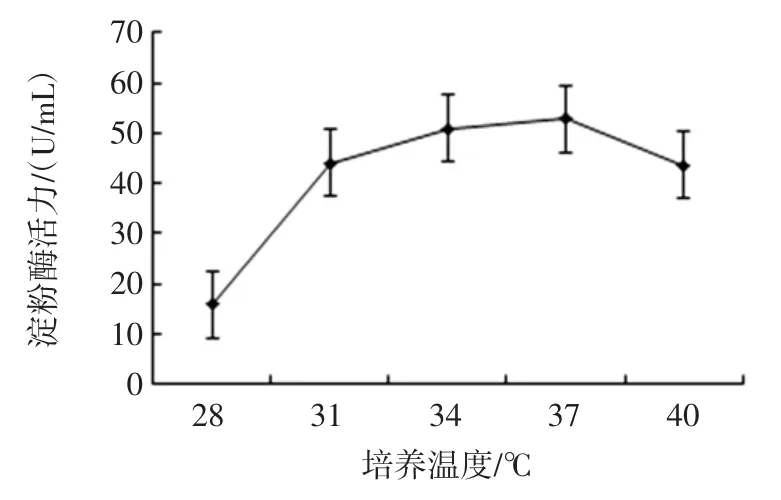
圖11 培養溫度對菌株MF04 產酶能力的影響Fig.11 Effect of culture temperature on enzyme production ability of strain MF04
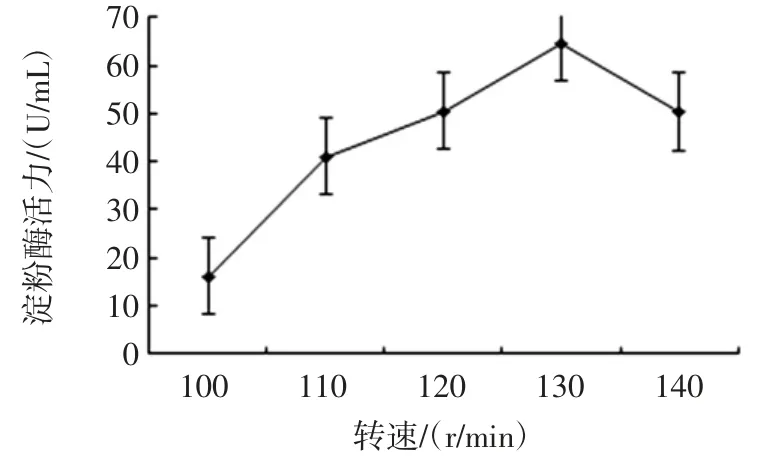
圖12 轉速對菌株MF04 產酶能力的影響Fig.12 Effect of rotation speed on enzyme production ability of strain MF04
2.4.4 驗證試驗
將菌株MF04 接種于優化后的發酵培養基中,37 ℃,130 r/min,發酵培養72 h,測定發酵液酶活力為58.5 U/mL,與理論值接近。
3 結論
對從面粉廠、菜園以及食堂附近采集的土壤樣品中產淀粉酶的菌株通過平板初篩和搖瓶復篩,分離純化獲得173 株產淀粉酶菌株。根據H/C 比值和淀粉酶活力測定初步篩選出產淀粉酶能力較強的菌株1株,命名為MF04。通過形態學、生理生化試驗以及16S rDNA 鑒定,將其歸為芽孢桿菌屬蠟狀芽孢桿菌(Bacillus cereus)。目前,淀粉酶工業生產中選用的菌株主要以枯草芽孢桿菌和蠟狀芽孢桿菌為主,還包括解淀粉芽孢桿菌和地衣芽孢桿菌等[26]。利用L3(94)正交試驗對該菌株的最適產酶培養基及培養條件進行初步優化,確定最佳培養基為:2%糊精,0.6%磷酸氫二鈉,0.5%蛋白胨和0.5%硫酸錳;最適培養條件為:初始pH 6.0,發酵溫度為37 ℃,轉速130 r/min,發酵時間72 h。在上述培養基及培養條件下,使菌株MF04 的產淀粉酶能力較優化前提高了85.2%。
以土壤為材料進行產淀粉酶菌株的分離篩選一直被研究人員關注。張麗靖等[27]從富含淀粉的土壤中篩選得到一株酸性α-淀粉酶產生菌B6,原始菌株產α-淀粉酶的酶活力達到30.2 U/mL,經優化后其產α-淀粉酶酶活力為33.4 U/mL,提高了10.6%;趙淑琴等[28]對土壤中產淀粉酶菌株的研究中篩選得到1 株高產淀粉酶菌株LZ-10,經優化后酶活力達到41.6 U/mL;馬曉梅等[29]對土壤中產淀粉酶菌株的研究中篩選得到高產淀粉酶菌株MSP13,經優化后α-淀粉酶酶活力為45.02 U/mL。而在本研究中對產淀粉酶菌株MF04 進行產酶培養基及培養條件的優化試驗后,可使該菌株的產酶活力達到60.2 U/mL,較優化前提高了85.2%,產酶活力均高于同類研究。
本研究對不同土壤中的產淀粉酶菌株進行分離篩選,對其中1 株產α-淀粉酶的菌株進行產酶條件的優化研究,使其產酶能力有了大幅提高,這可為淀粉酶的工業生產提供一定支撐。

