輸尿管軟鏡碎石術治療鑄型腎結石經皮腎鏡碎石術后殘石的臨床研究
尹永華,張華杰,文博
(廣州醫科大學附屬深圳沙井醫院 泌尿外科,廣東 深圳 518104)
鑄型腎結石是泌尿外科常見疾病,主要治療方法為經皮腎鏡碎石術(percutaneous nephrolithotomy,PCNL),該方法治療效果確切、結石清除率高[1],但一期手術無可避免出現術后殘石等問題。目前,治療鑄型腎結石PCNL術后殘石常為二期PCNL手術,該術式結石清除率高、手術時間短[2]。鑄型腎結石術后殘石位置較復雜,二期PCNL難以經原通道處理所有結石,常需重新建立單個或多個經皮腎通道,但建立多個經皮腎通道易出現術中術后大出血、術后發熱和術后疼痛等并發癥[3]。因此,需要更為安全的手術方式治療鑄型腎結石PCNL術后殘石。輸尿管軟鏡碎石術(retrograde intrarenal surgery,RIRS)為治療腎結石的新方法,其清石效率較高,同時具有術中術后并發癥少和術后恢復快的優勢[4]。本文回顧性分析本院68例鑄型腎結石PCNL術后殘石患者的臨床資料,比較二期PCNL與RIRS治療鑄型腎結石PCNL術后殘石的安全性及有效性,為臨床治療鑄型腎結石PCNL術后殘石提供一定的依據。
1 資料與方法
1.1 一般資料
回顧性分析本院2015年7月-2018年8月68例鑄型腎結石行PCNL術后殘石患者的臨床資料,根據患者及家屬的選擇分為兩組。PCNL組是二期手術方式為PCNL的36例患者,RIRS組是二期手術方式為RIRS的32例患者。兩組患者的基本情況包括患者年齡、性別、體質指數(body mass index,BMI)、術前CT確診為單側腎結石、殘石數目(僅考慮殘石直徑≥0.6 cm)、一期術后殘石主要分布位置、一期術后最大殘石直徑、術前血紅蛋白測定。入準標準:患者一期PCNL術后3或4 d復查CT提示術后殘石≥0.6 cm,二次手術前常規復查血常規、肝腎功能、電解質、凝血功能以及尿培養和尿常規,合并感染者予以抗感染治療2周至尿培養陰性。見表1。
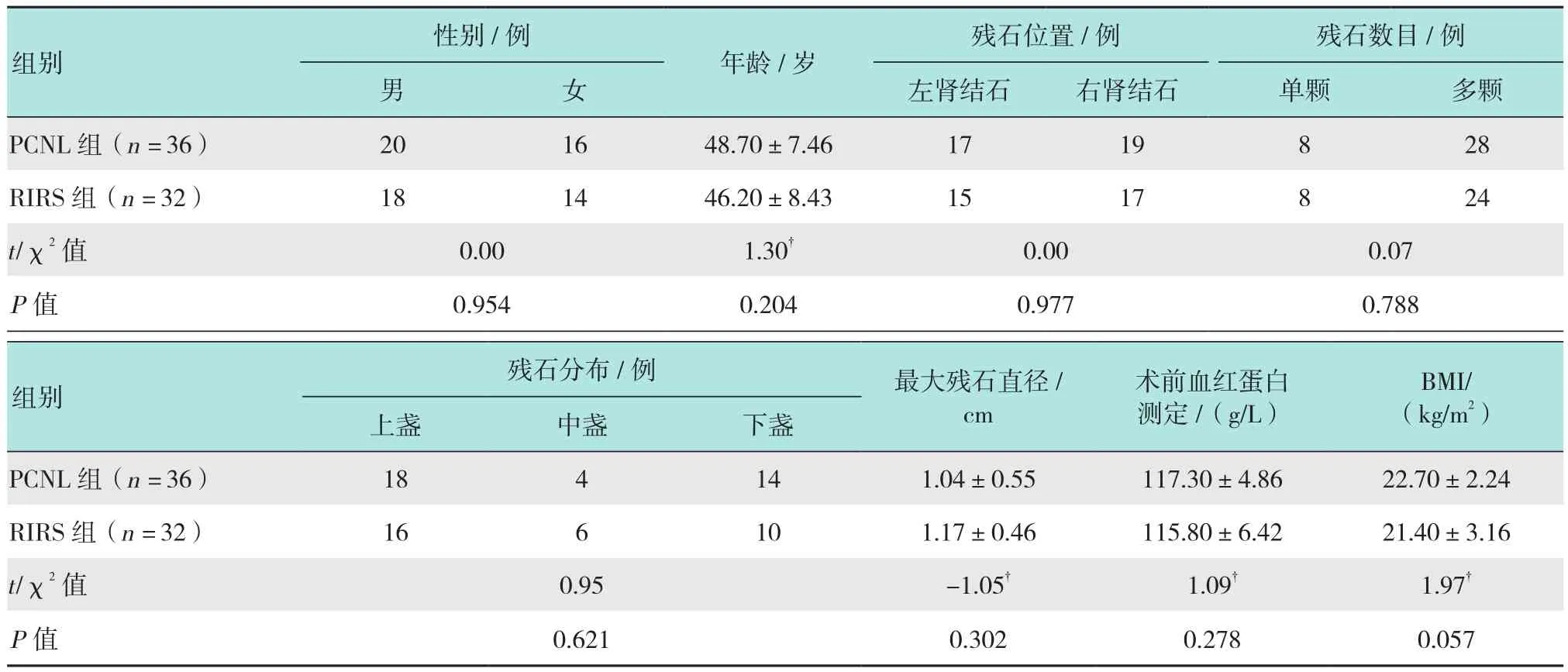
表1 兩組患者一般資料比較Table 1 Comparison of general data between the two groups
1.2 手術方法
兩組手術均由同一位臨床經驗豐富的泌尿外科醫生完成。
1.2.1 一期PCNL采用氣管插管全麻或腰硬聯合麻醉。麻醉成功后患者取截石位,在腎鏡觀察下,經尿道進入膀胱置入F5輸尿管導管。改俯臥位,于B超定位下選取合適的位置建立經皮腎鏡通道(常為患腎中盞),由F10順序擴張通道至F24,置入F24工作鞘,使用彈道碎石機進行碎石。碎石后,檢查無明顯殘留結石,或僅剩余因角度原因可見到而碎石桿觸不到的結石。沿導絲順行置入F5雙J管做輸尿管內支架,退出斑馬導絲,沿工作鞘置入腎造瘺管,退出工作鞘,縫合皮膚切口兩針并固定腎造瘺管。術后予以抗感染、止血、止痛等對癥支持治療,術后3至4 d復查腹部CT,明確術后殘石的大小、數量及位置。術后1至2周后,殘留結石行二期手術治療。
1.2.2 二期 PCNL組采用氣管插管全麻或腰硬聯合麻醉。麻醉成功后患者取截石位,在腎鏡觀察下經尿道進入膀胱,先拔除雙J管再置入F5輸尿管導管;改俯臥位。沿造瘺管插入斑馬導絲至腎盂,拔出造瘺管,將F24工作鞘沿斑馬導絲置入原經皮腎通道,然后將腎鏡順導絲置入工作鞘,腎鏡觀察腎盂及腎盞有無結石,若能觀察且接觸結石,則進行碎石;若未能觀察結石或不可接觸,則根據復查影像資料找到殘石位置,聯合B超定位下建立經皮腎鏡通道,再由F10順序擴張通道至F24,置入F24工作鞘(經原通道12例,微通道10例,標準通道14例;其中有4例多發殘石建立1個標準通道和1個微通道),將腎鏡置入工作鞘,使用彈道碎石機進行碎石。碎石后,沿導絲順行置入F5雙J管做輸尿管內支架,退出斑馬導絲,沿工作鞘置入腎造瘺管,退出工作鞘,縫合皮膚切口兩針并固定腎造瘺管。術后3至4 d再次復查泌尿系CT,仍有殘石≥0.4 cm,可認為殘石未清除,根據結石大小,選擇行體外沖擊波碎石(extracorporeal shock wave lithotripsy,ESWL)或擇期行三期手術,術后視小便顏色拔除腎造瘺管。術后1個月來院復查CT,并行雙J管拔除。
1.2.3 二期RIRS組氣管插管全麻后截石位,消毒,鋪巾。打開腎造瘺管,接引流袋(有2例多發殘石采用斜仰臥位雙鏡聯合碎石)。將輸尿管鏡經尿道置入膀胱,在輸尿管鏡的觀察下,拔除預先留置的雙J管,向患腎輸尿管開口置入斑馬導絲,F14擴張鞘沿著斑馬導絲置入輸尿管上段近腎盂口下方水平。退出斑馬導絲,更換為Olympus P3纖維輸尿管軟鏡并沿著擴張鞘進入腎盂,尋找結石,并使用鈥激光光纖進行碎石。碎石后,留置斑馬導絲,然后退出纖維輸尿管軟鏡及擴張鞘。更換輸尿管鏡,在斑馬導絲引導下,留置F5雙J管,最后退出輸尿管鏡及斑馬導絲,留置尿管,結束手術。術后1或2 d再次復查泌尿系CT,仍有殘石≥0.4 cm,可認為殘石未清除,根據結石大小,選擇行ESWL或擇期行三期手術,術后視小便顏色拔除腎造瘺管。術后1個月來院復查CT,并行雙J管拔除。
1.3 數據收集和療效評價
術中出血量:將手術中的含血沖洗液收集并測量其總量,抽取5 mL混勻后的沖洗液,測定沖洗液血紅蛋白濃度(采用全自動血細胞分析儀)。出血量計算公式:出血量(mL)=沖洗液中血紅蛋白濃度(g/L)×沖洗液總量(L)/[術前血紅蛋白濃度(g/L)×1 000]。
記錄和比較兩組患者的手術時間、術后出血量、二期手術清石率、三期手術/ESWL治療率、術后24 h血紅蛋白平均下降量、術后24 h疼痛視覺模擬評分(visual analogue score,VAS)、術后平均住院時間、輸血和發熱等并發癥發生情況。
1.4 統計學方法
采用SPSS 25.0統計軟件處理數據,計數資料以例表示,組間計數資料比較采用χ2檢驗;計量資料采用均數±標準差(±s)表示,進行t檢驗;等級資料采用秩和檢驗,P< 0.05為差異有統計學意義。
2 結果
2.1 兩組患者二期手術臨床資料比較
2.1.1 手術相關指標所有手術均順利完成,無1例出現嚴重并發癥。兩組患者均取得良好的清石率,清石率分別為RIRS組87.50%和PCNL組91.67%,差異無統計學意義(P> 0.05)。在術后平均住院時間、術后出血量、術后24 h血紅蛋白平均下降值、術后24 h VAS等方面,RIRS組均明顯優于PCNL組,差異有統計學意義(P< 0.05),在手術時間方面,RIRS組手術時間明顯長于PCNL組,差異有統計學意義(P< 0.05)。術后復查CT,PCNL組有3例患者(2例因多通道術中出血終止手術,1例因術中凝血塊阻礙視野而碎石不充分)的殘石> 0.4 cm需進一步治療,三期手術/ESWL治療率為8.33%;RIRS組有4例患者(4例下盞殘石因腎盂漏斗部夾角小而碎石不充分)需進一步治療,三期手術/ESWL治療率12.50%,兩組三期手術/ESWL治療率比較,差異無統計學意義(P> 0.05)。見表 2。
2.1.2 不同結石分布清石率PCNL組14例下盞殘石均碎石滿意,無需再治療(三期手術/ESWL率0.00%,0/14),RIRS組4例下盞殘石因腎盂漏斗部夾角小而碎石不充分需進一步治療(三期手術/ESWL率40.00%,4/10),兩組患者下盞結石三期治療率差異有統計學意義(χ2= 6.72,P= 0.010),PCNL組下盞清石率明顯高于RIRS組。RIRS組上、中盞結石22例,三期治療率0.00%(0/22),下盞結石10例,三期治療率40.00%(4/10),上、中盞結石與下盞結石三期治療率比較,差異有統計學意義(χ2= 10.06,P= 0.002)。
2.2 兩組患者二期手術術后Clavien-Dindo外科手術并發癥分級比較
本研究并發癥比較見表3,Clavien-Dindo外科手術并發癥分級比較見表4。在總并發癥發生率方面,RIRS組發生4例,發生率12.50%(4/32);PCNL組發生14例,發生率38.89%(14/36),RIRS組總并發癥發生率明顯少于PCNL組(P< 0.05)。其中,RIRS組術后發熱4例,未出現石街和敗血癥;PCNL組術后發熱8例,6例因出血而給予相應處理(2例患者輸注濃縮紅細胞2~4 u;2例多通道患者因術中出血影響視野,終止手術;2例術后遲發性出血,予以手術切口縫合、沙袋加壓、絕對臥床等對癥保守治療后好轉),所有出血患者經治療后均無需介入治療,隨訪未發生再次出血。RIRS組無1例因術中出血影響視野而終止手術,無輸尿管撕脫/穿孔等并發癥,術后亦無遲發性出血。兩組患者術后復查CT均未見結石殘留。
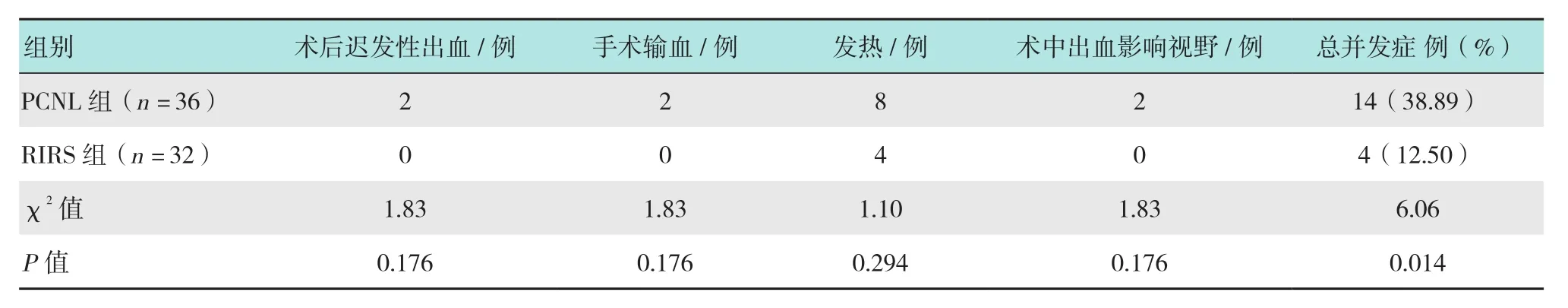
表3 兩組患者并發癥比較Table 3 Comparison of complications between the two groups
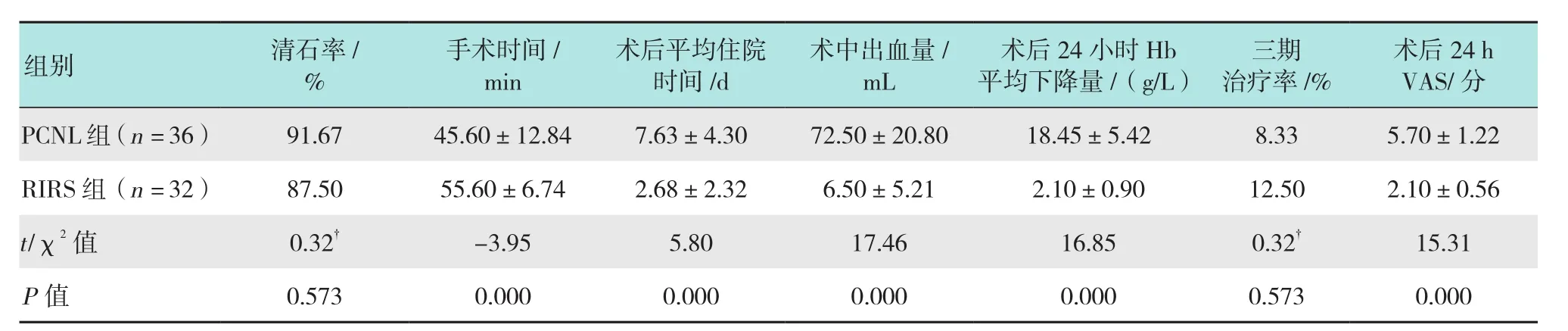
表2 兩組患者二期手術相關資料比較Table 2 Comparison of two-stage surgery related data between the two groups
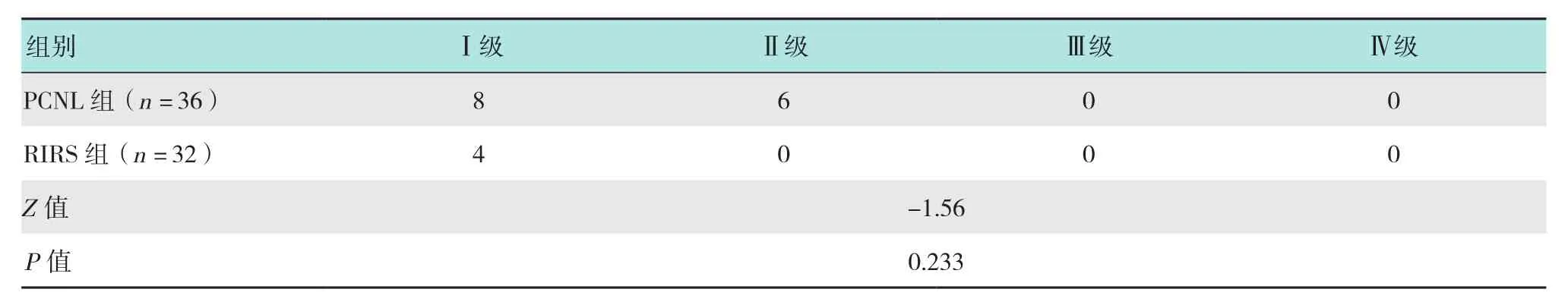
表4 兩組患者Clavien-Dindo外科手術并發癥分級比較 例Table 4 Comparison of Clavien-Dindo classification of surgical complications between the two groups n
3 討論
鑄型腎結石為泌尿系結石中的復雜性結石[5],常填充腎盂和幾個腎盞,甚至全部腎盞,若存在梗阻、感染等問題,可引起腎功能損傷,甚至并發嚴重感染。因此,檢查發現鑄型結石時需及時手術治療,以清除結石、保護腎功能。同時,鑄型腎結石常出現結石復雜、結石巨大、取石困難、無腎積水或嚴重腎積水等問題,導致治療難度大,常需多次治療才能徹底清除結石,目前的治療方案主要為PCNL。因鑄型腎結石常填充多個腎盞,單通道PCNL難以處理全部結石,需建立多個通道或者多期手術治療[6]。術后殘石是鑄型腎結石PCNL手術難以避免的問題,有資料[7-8]顯示,鑄型腎結石一期碎石術后殘石率為5.2%~22.0%,術后殘石處理為鑄型腎結石手術的重點之一。目前,RIRS已成為治療腎結石的有效方法,具有碎石效果確切、清石率高和并發癥少等特點,已廣泛應用于各種上尿路結石的治療。歐洲泌尿外科指南[9]指出,RIRS是治療1.0~2.0 cm腎結石的一線方案,是治療2.0~3.0 cm結石的選擇方案之一。有研究[10]指出,RIRS治療1.0~2.0 cm腎結石與微通道經皮腎鏡取石術(microchannel percutaneous nephrolithotomy,MPCNL)療效相當,也有相關研究[11]嘗試使用RIRS治療鑄型腎結石,取得理想的治療效果。因此,本研究結合輸尿管軟鏡的特點,探討二期RIRS與二期單通道/多通道PCNL治療鑄型腎結石PCNL術后殘石的相關問題。
鑄型腎結石術后殘石為一期單通道PCNL碎石的結石術后殘留,常為一期單通道PCNL無法觀察或無法接觸的結石,往往分布于與原通道平行的腎盞。若二期PCNL在一期手術原通道進行碎石手術,獲取的手術視野與一期手術視野無明顯差異,常常無法觀察全部殘石,以致無法處理全部殘石,碎石效果欠佳。因此,二期PCNL處理鑄型腎結石PCNL術后殘石,往往需建立多個通道再進行碎石。有研究[3,12]認為,建立多個經皮腎通道對腎臟的損傷較大,術后出血明顯,且建立多通道難度大,副損傷及并發癥較一期PCNL手術增多。本研究也發現多通道穿刺成功率不高,一個新經皮腎通道往往需要穿刺1至3次;同時,在建立PCNL多通道時易因穿刺腎臟致術中出血,PCNL術中形成的部分凝血塊常包裹結石或阻擋術野,影響手術操作,甚至中止手術,降低手術清石率。本研究PCNL組有2例患者術中建立多通道過程中出現明顯出血而停止手術,1例患者因術中凝血塊阻礙視野而碎石不充分。因此,3例患者需行三期手術/ESWL治療。
與PCNL組比較,RIRS組無需建立經皮腎通道,輸尿管軟鏡因其構造的特點,可順應輸尿管-腎盂結構到達各個腎盞,順利清除各腎盞結石,且術后無需留置腎造瘺管。在術中術后出血方面,RIRS組明顯優于PCNL組,術中出血量分別為(6.50±5.21)和(72.50±20.80)mL、術后24 h血紅蛋白平均下降值(2.10±0.90)和(18.45±5.42)g/L,差異均有統計學意義。一期手術術后保留腎造瘺管,二期RIRS術中灌注于腎盂的灌注液能通過腎造瘺管排出,可避免術中腎盂內壓過高,術者術中可根據手術需求增加腎盂灌注量,沖走殘石,以提高碎石效率、縮短手術時間。二期RIRS術中出現出血時,亦可加大腎盂灌注,沖走血塊,保持術野清晰,提高手術效率。本文二期RIRS清石率(87.50%)與PCNL組(91.67%)比較,差異無統計學意義,但RIRS組中有4例患者需要進行三期手術或ESWL治療,4例患者均為下盞殘石碎石不充分。筆者認為,因腎盂與腎下盞夾角過小,盞頸漏斗部較長,輸尿管軟鏡無法到達下盞殘石處,而導致清石不徹底。本研究中,PCNL組的下盞結石清石率高于RIRS組(χ2= 6.72,P= 0.010),而RIRS組的上、中盞結石的清石率高于下盞結石(χ2= 10.06,P= 0.002)。結合臨床經驗,筆者認為,RIRS處理中上盞殘石清石效果理想,而處理下盞殘石成功率低。MOLIMARD等[13]研究也顯示,腎下盞的清石率要明顯低于中、上盞,腎盂與下盞夾角越小、盞頸漏斗部越長,碎石成功率越低。
既往文獻[14-15]報道,RIRS術后并發癥主要為術后尿源性膿毒血癥,RIRS術中會出現腎盂內壓增高,使得手術時間延長、灌注液吸收增多,導致病菌或內毒素進入循環系統,從而更容易發生尿源性膿毒血癥。有研究[16]建議,術中應避免輸尿管軟鏡手術時間過長、水流量過大,以減少膿毒血癥的發生。而本研究RIRS組未出現膿毒血癥等嚴重并發癥,筆者認為,由于一期PCNL術后腎造瘺管存在,RIRS術中灌注于尿路系統的液體可通過腎造瘺管排出體外,避免腎盂壓力升高,降低了膿毒血癥的發生風險,與徐剛等[17]的研究一致。同時,因腎造瘺管連接于引流袋,RIRS碎石過程中釋放的細菌可被沖出腎盂,減少致病菌和內毒素進入血循環,從而降低膿毒血癥發生率。本文PCNL組也未發生尿源性膿毒血癥,筆者認為,PCNL建立多個取石通道,有利于腎盂內壓降低,加快排出含菌沖洗液,縮短手術時間,可減少中毒性休克并發癥的發生率,與ZHONG等[18]的研究一致,同時,取石鉗器械取石的過程中,可減少術中腎內壓力,有利于致病菌或內毒素經沖洗液順利流出體外,減少膿毒血癥的發生,與NEGRETE-PULIDO等[19]的研究一致。
在手術時間方面,RIRS可提高術中水流灌注量及速度,沖走碎石,保持手術視野清晰,提高手術速率,進而降低手術時間。PCNL碎石效率高,較大殘石也可通過經皮腎通道取出,手術時間短。但本組的數據顯示,PCNL組優于RIRS組[(45.60±12.84)和(55.60±6.74)min],差異有統計學意義。鑄型腎結石術后殘石常分布于不同腎盞,二期PCNL常需建立2至3個經皮腎新通道,甚至要建立更多的經皮腎新通道,手術時間也隨之延長。雖然兩組總平均手術時間差異有統計學意義,但PCNL組中有16例患者因術中需建立2~4個經皮腎新通道,其手術時間均多于RIRS組的平均手術時間。
RIRS順應人體自然腔道治療結石,避免經皮穿刺至腎盂,減少患者損傷及減輕疼痛,還可降低手術出血風險,術后恢復快。而二期PCNL常需建立2至3個經皮腎新通道,術后需留置多根造瘺管,引起術后明顯疼痛,術后恢復時間延長。本研究RIRS組術后疼痛程度和術后恢復程度均優于PCNL組,與以往文獻[20]報道RIRS術后疼痛明顯輕于MPCNL相似。
綜上所述,在處理鑄型腎結石PCNL術后殘石時,RIRS與二期單通道/多通道PCNL均可有效清除殘石,RIRS處理中上盞殘石清石效果理想,處理下盞殘石時如腎盂漏斗部夾角小而成功率會較低。相比二期單通道/多通道PCNL,RIRS具有術中出血少、手術創傷小、術后疼痛輕、術后住院時間短和手術并發癥少等優勢。因此,在治療鑄型腎結石PCNL術后中上盞殘石時可優先考慮RIRS。

