綜合醫院臨床研究倫理初始審查常見問題及對策研究
安 妮 喬田奎 許國雄 沈 輝
醫學的發展和進步離不開臨床醫學研究的驗證和推廣,臨床新技術、新藥物、新器械等涉及人的臨床研究既要確保其安全性、有效性,又要符合倫理原則[1]。醫院倫理委員會承擔對臨床研究的科學性、倫理合理性的審查和倫理管控,督促研究者重視和嚴格保護受試者的尊嚴、安全性和權益。所以醫院臨床研究者對醫學倫理的認識和能力是臨床科研倫理合理性的根本保障[2]。本文匯總分析了筆者所在醫院2018年度臨床科研項目倫理審查中存在的問題,并在此基礎上提出了相應的改進措施,以期為綜合性醫院臨床研究倫理的審查和管理提供借鑒。
1 資料與方法
通過回顧性研究,對2018年1月~2019年3月筆者所在醫院開展的科研倫理審查項目存檔資料進行評估,同時運用SPSS統計分析方法,對所歸納的倫理審查問題進行深入分析。
2 結果
2.1 科研倫理審查基本情況
2018年1月~2019年3月筆者所在醫院醫學倫理委員會共對67項研究項目開展初始審查。項目負責人職稱構成:高級21人,占31.4%;中級24人,占35.8%;初級22人,占32.8%。評審項目按學科分類,科研項目分布27個專業科室,以內科項目居多,見圖1。外科系統科室24項,占35.8%;內科系統科室33項,占49.2%;護理5項,占7.5%;醫技與其他科室5項,占7.5%。
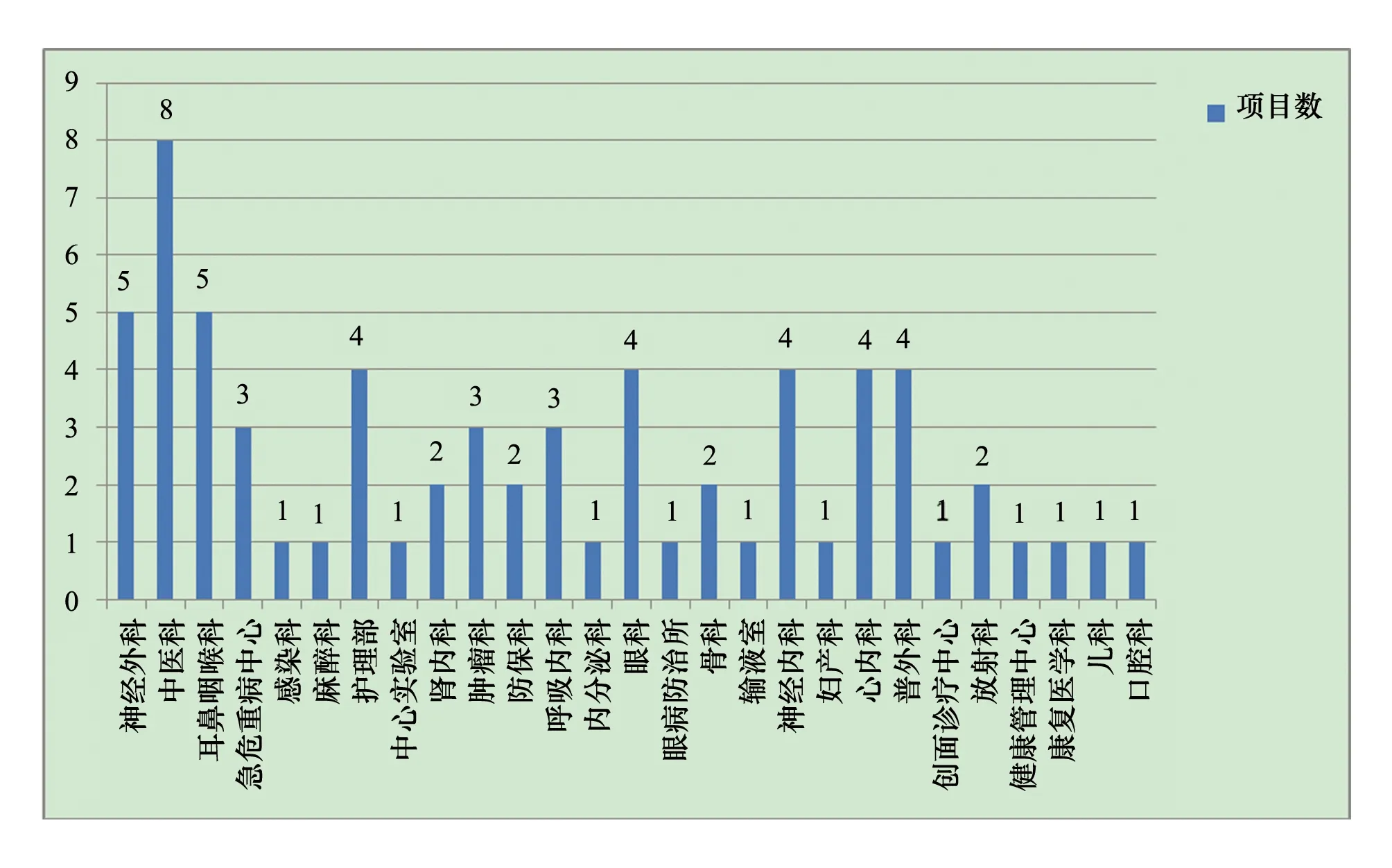
圖1 科研項目數專業分布
2.2 初始審查總體情況
在67個申請倫理審查的項目中,有36個項目被倫理委員會委員提出修改意見,占審查總數的53.7%。其中,研究方案被倫理委員會委員提出修改意見的有23項,占審查總數的34.3%。其中最常見的問題出現在研究方案設計這一審查要素,其次是受試者的納入與排除標準。
倫理審查時,有32個(占47.8%)項目的知情同意書存在問題,主要集中在知情同意的告知、語言表達、風險考慮等幾個審查要素方面。
2.3 研究方案中主要倫理問題分析
統計初始審查結果分析發現,在23項需要修改的研究方案中倫理委員會委員審查提出的問題主要集中在以下幾個方面:受試者納排標準,即2018年1月~2019年3月所有審查項目中,6.0%的項目在納排標準上存在問題,研究設計與對照有31.3%存在問題,試驗組和對照組的設置有3.0%存在問題,見表1。
表1研究方案和知情同意書中的常見問題
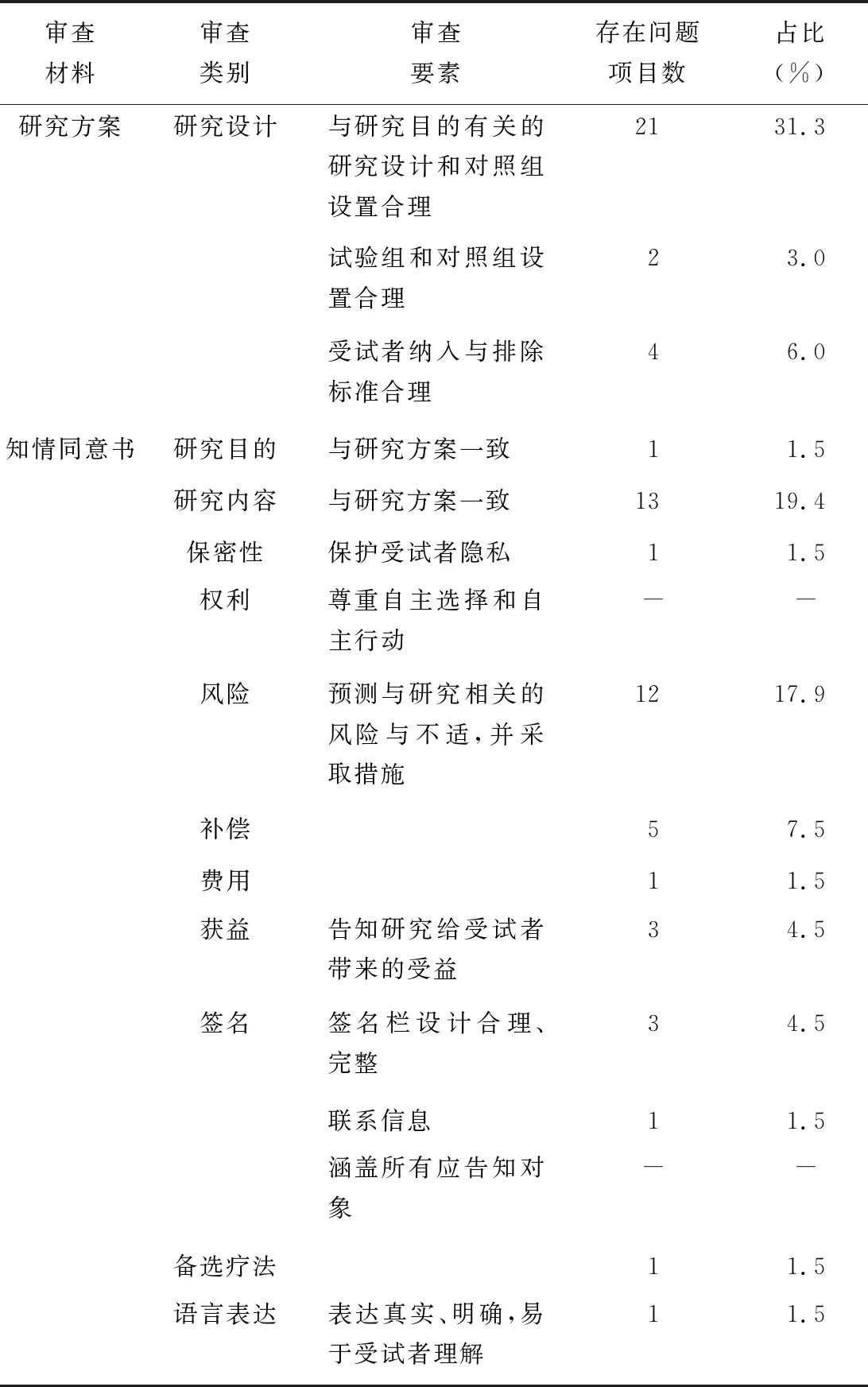
審查材料審查類別審查要素存在問題項目數占比(%)研究方案研究設計與研究目的有關的研究設計和對照組設置合理2131.3試驗組和對照組設置合理23.0受試者納入與排除標準合理46.0知情同意書研究目的與研究方案一致11.5研究內容與研究方案一致1319.4保密性保護受試者隱私11.5權利尊重自主選擇和自主行動--風險預測與研究相關的風險與不適,并采取措施1217.9補償57.5費用11.5獲益告知研究給受試者帶來的受益34.5簽名簽名欄設計合理、完整34.5聯系信息11.5涵蓋所有應告知對象--備選療法11.5語言表達表達真實、明確,易于受試者理解11.5
2.3.1 納入與排除標準不嚴謹
目前國家相關法律法規并沒有對納入、排除標準進行明確定義,也沒有相關文獻論著可供參考,導致試驗設計參考原則五花八門,質量參差不齊。通過結合多方資料,張強等[3]認為,納入標準應當是指能夠入組的基本條件,而排除標準應該是在符合納入標準基礎上的其他不滿足試驗要求的特殊情況。
納入與排除標準是關于受試者是否能夠入組的決定性因素,方案中設計合理的納入、排除標準是保證臨床試驗科學、順利、有效開展的前提。納排標準制定的是否嚴謹、是否科學,最終導致試驗結果是否能做出科學的結論,出現選擇性偏倚。根據梳理,研究者在制定納排標準時容易出現的主要問題有:(1)納入標準與排除標準的混淆。在科研倫理審查項目中經常會發現部分研究者認為納入標準相反就是排除標準,在書寫方案時會將納入標準的否定句當成排除標準。(2)未考慮試驗高危人群。排除標準中并未限定弱勢人群(如懷孕、認知障礙、文盲等)、其他嚴重疾病、低資源地區等因素。倫理委員會辦公室人員日常與研究者溝通交流中發現,大多數研究者并非故意不遵循倫理審查要求,而是經常會忽略這一點。有時候“寫”和“做”并不會契合。可見,即使方案再完美,研究人員在實際操作時并不遵守,也是沒用的。倫理委員會應加強過程的管理與監督機制,保證研究過程中規范自覺遵守倫理原則。
2.3.2 研究方案設計不合理
研究方案是整個臨床試驗中的核心,方案設計的不嚴謹會導致試驗的開展阻礙重重,甚至導致試驗不得不暫停,重新修改。本機構倫理審查中主要遇到的問題有:(1)方案設計前期缺乏對醫院就診流程調研,導致試驗開展困難重重。比如:試驗方案計劃抽血點為受試者入院手術的前3天,但是實際操作過程中發現大部分患者基本只能在手術當天采血。(2)安慰劑的使用并沒有考慮受試者的依從性。例如,“一項在患有絕經潮熱婦女中評價某個藥物療效和安全性隨機、雙盲、12周、安慰劑對照”項目,并沒有考慮到無效的安慰劑干預導致受試者的依從性降低甚至會退出試驗。
2.4 知情同意書中主要倫理問題分析
初始審查結果統計分析發現,知情同意書存在的問題是影響審查結論的主要因素。倫理委員會委員提出修改意見,主要集中于研究目的和研究內容告知不詳細或不準確(20.9%);預測與研究相關的風險與不適,以及采取措施告知問題(17.9%);研究補償和獲益問題(11.7%);格式設計、保密和語言表達問題(7.4%)。見表1。
2.4.1 研究內容告知不充分
知情同意書對研究內容(包括干預措施、生化指標監測的總量與頻次,附加試驗或檢測等)的基本流程未做出清晰的闡述,甚至有些與研究方案不一致。例如:“研究刺激迷走神經聯合降壓藥物治療難治性高血壓”試驗中僅告知受試者試驗中需要使用儀器刺激迷走神經,但是并沒有明確告知受試者此臺儀器是由誰來保管以及使用是否免費;通過冠脈造影觀察前列腺素E1改善早期冠狀動脈微循環試驗的知情同意書中并沒有告知受試者整個試驗過程需要做2次冠脈造影。
2.4.2 風險告知不詳細
根據倫理委員會辦公室秘書與研究者溝通整理,在知情同意書中,研究者往往會忽視常見的抽血、CT、采集咽拭子、中醫按摩理療等常規檢查的風險。例如,“研究穴位按摩聯合蜂蜜外涂用于小兒肛裂的治療”試驗的知情同意書中并未告知此試驗風險。
2.4.3 語言專業化
知情同意書中,尤其是研究目的與內容文字照搬研究方案,描述過于專業化;涉及到國際合作的項目,直接使用直譯英文版知情同意書,語言較為生硬且有時還會引起他人的不解與歧義,使得受試者不能充分理解試驗相關內容。例如,有些知情同意書中會將專業術語使用英文縮寫表達,且并沒有對此英文縮寫進行描述;部分知情同意書中還存在一些誘導性詞語,如提供“免費治療藥物”、“提供免費的檢查”、“提供較好的醫療服務”等。另外,有些知情同意書會有“您已被診斷出×××疾病”“惡性腫瘤”等字眼,容易引起受試者不舒適的感覺。
2.4.4 補償與費用告知不恰當
有些國際多中心項目中文版知情同意書會使用“最多”、“至少”等不準確性詞匯,讓受試者誤解。
2.5 倫理初審項目修改情況分析
申請倫理審查的項目中,高級職稱研究者申報22項,臨床研究方案需要修改17項,知情同意書需要修改10項;中級職稱研究者申報25項,臨床研究方案需要修改12項,知情同意書需要修改13項;初級職稱研究者申報21項,臨床研究方案需要修改7項,知情同意書需要修改9項。運用Gamma法分析得出職稱與臨床研究方案修改情況(P=0.006,r=-0.357);分析職稱與知情同意書修改情況(P=0.002,r=-0.368)。其中顯示職稱越高,臨床研究方案和知情同意書需要修改的可能性越大。這可能與日常診療中高級職稱的研究者較忙,很難有時間準備倫理審查申報材料與及時詳細和倫理委員會辦公室工作人員溝通所導致。
3 討論
醫學研究和實踐應遵循的倫理基本原則是不傷害原則、有利原則、公開原則和尊重原則[4]。醫學倫理委員會對臨床研究項目初始審查,包括研究方案的設計與實施、研究的風險與受益、受試者的招募、知情同意告知的信息、知情同意的過程、受試者的醫療和保護,隱私和保密、弱勢群體的特殊保護等。倫理委員會委員關注相關研究方案,從研究的目的、研究的標準、對照組的設計、安慰劑的使用、試驗周期、研究終點等方面進行風險收益的評估,研究方案的設計應盡可能地減少已知風險。風險受益評估的科學審查,每項涉及人體的研究實施前必須對參加試驗的個體和群體都做出可預見的風險和負擔的評估,與研究給他們身體和疾病情況影響的益處對比進行慎重的評估。科學上的合理是研究符合倫理原則的基本要求。本組資料顯示,初始審查項目,倫理委員會提出意見的項目達53.7%,其中存在問題最多的是知情告知書修改率為47.8%,研究方案修改率為34.3%。可見,倫理審查對臨床研究的重要性。
3.1 研究者對倫理審查的意識薄弱
在2008年以前,臨床研究者對國內外雜志發表涉及人的臨床研究的論文所需要的倫理學要求認識還不充分,隨著國內外政策的導向,醫院科研人員的倫理意識也有一定提升[5]。現今國內機構重視臨床科學研究,但是對倫理的考量并沒有得到應有的重視,大部分研究者在臨床研究中缺乏倫理層面的思考,對研究過程、研究方式、研究成果可能存在或誘發的倫理問題未做充分的分析與預測[6]。每個項目負責人都要有醫學倫理的意識,認識倫理的重要性,掌握藥物試驗中各種倫理問題的關鍵點,以倫理知識解決倫理問題。只有全面掌握了倫理的相關知識,才能明白臨床試驗倫理的重要性[7]。
倫理審查工作中常發現,研究者不了解審批流程,如申請表的差異、審批流程的時間節點等[8]。許多研究者在準備開展臨床研究前,沒有充分知曉所在醫療機構的倫理審批所需材料,這不僅會造成臨床研究的滯后,給研究團隊帶來不便,也對倫理委員會的工作造成了不必要的麻煩。
3.2 知情同意書質量是影響初始審查結果的主要因素
知情同意指向受試者告知一項試驗的各方面情況后,受試者自愿確認其同意參加該項臨床試驗的過程,須以簽名和注明日期的知情同意書作為文件證明[9]。患者知情同意權是指在醫患關系中,患者享有的對真實病情治療措施與方案、醫療風險、醫療費用、診治權和決定權。根據藥品臨床試驗管理規定規范的要求,知情告知必須要滿足符合患者利益,保護患者隱私,尊重患者知情權。想要獲取知情同意,書面材料和告知過程的準備工作是十分必要的前提,研究者提供研究信息的準確性、真實性、充分性。尤其是對研究方案,新的診療技術或藥物與常規或其他治療手段等對受試者預后影響的說明。有的臨床研究開展的過程中,某些研究者在受試者招募口頭告知中會擴大受試者的受益或淡化風險,誘導受試者進入研究,影響受試者的自主選擇,告知不充分導致受試者誤解而進入臨床試驗,但試驗中由于各種原因也會發生受試者的失訪或退出等狀況,對臨床試驗而言,也是百害而無一利。所以,研究者不能將知情告知流于形式。
由于患者所處的社會文化背景、生活環境不同,對疾病的理解也有巨大的區別,對治療過程的理解以及結果預期也會不同,而知情告知的語言、內容、要點等應盡量做到符合受試者的理解能力、通俗易懂,對患者解釋病情診斷和預后告知,既要符合醫務人員科學客觀、實事求是,又要符合道德規范和受試者或監護人認可的原則。
3.3 重視弱勢人群的保護
研究者應該保證受試者人群的選擇可以公平合理地承擔研究風險受益與研究成果,弱勢群體有權分享科學研究的成果,但要考慮弱勢群體的生理、心理、自主能力等特殊性,如何評估弱勢群體參加研究的合理性,如何保護弱勢群體,是研究者和倫理委員會審查過程中必須思考的重要問題。
我國的醫學倫理審查越來越受到醫院和研究機構的重視,研究者倫理的意識和能力,也需要不斷加強。作為綜合性醫院倫理委員會不僅要不斷更新倫理審查的知識和能力,更要提高服務意識和手段,從而才能不斷提高倫理審查的水平和效率,為研究者和受試者提供專業優質服務。首先,利用信息化手段在醫院官網提供信息公開的渠道,讓研究者和申辦方了解倫理委員會工作的流程,各類申請的材料和表格模板以及申請的相關事宜,同時建立各個項目的信息庫,實時掌握項目的進展以及跟蹤審查等。第二,定期開展全院培訓,同技術、申請者不同層次、倫理新法規等專題培訓,強化研究者倫理意識和能力。第三,倫理委員會成員和辦公室工作人員樹立主動服務的意識,既要做倫理審查者,還要做倫理的宣傳者、輔導員和示范者。針對個別項目或個性化項目對研究者進行主動的輔導。第四,醫院和學科管理層面的重視,給予倫理培訓和審查工作政策、時間、經費和人員等方面的關心支持,是做好倫理申請和審查的保障。

