草魚樹突狀細胞的分離鑒定及益生芽孢桿菌對其免疫功能的影響
李思思 周成翀 王 歡 許荔立 張詩雨 謝夢琪 陳孝煊 吳志新
(華中農業大學水產學院, 湖北省水生動物病害防控工程技術研究中心, 農業部淡水生物繁育重點實驗室, 水產養殖國家級實驗教學示范中心, 武漢 430070)
樹突狀細胞(Dendritic cells, DCs)是已知功能最為強大的抗原遞呈細胞(Antigen-presenting cells,APCs), 也是唯一能激活初始T淋巴細胞增殖反應的細胞[1]。樹突狀細胞是連接固有免疫和適應性免疫的橋梁, 并在控制免疫反應的發生和免疫耐受中發揮重要的作用。樹突狀細胞通過模式識別受體(Pattern recognition receptors, PRRs)來區分不同的抗原物質并誘導免疫反應的類型[2]。研究表明DCs可通過上調共刺激分子CD83、CD80和促炎性因子IL-12的表達, 誘導Th1免疫細胞的產生[3]。DCs也可通過上調抗炎性因子IL-4和IL-10的表達來誘導Th2免疫細胞的分化[4]。相比于哺乳動物,對魚類DCs的研究起步較晚。Lugo-Villarino等[5]在斑馬魚(Danio rerio)中發現了一類具有吞噬活性的樹突樣細胞, 并對其刺激T淋巴細胞增殖的能力進行了分析。Bassity等[6]在虹鱒頭腎和脾臟中分離得到一類具有樹突樣形態, 高表達CD83和MHC-II、可啟動混合淋巴反應(Mixed Lymphocyte Reaction,MLR)的細胞。Zoccola等[7]利用SCRIPT為標記, 研究了在尖吻鱸(Lates calcarifer)中DCs的分布并進行了生物學功能的分析鑒定。綜合前人的研究, 目前對魚類DCs的鑒定工作主要圍繞形態學特征和生物學功能開展。在魚類DCs相關研究中, 通常使用混合淋巴反應評價魚類DCs刺激淋巴細胞增殖的能力, 將同種異體淋巴細胞與DCs共孵育, 通過檢測增殖的淋巴細胞的數量反映DCs刺激淋巴細胞增殖的能力。但目前尚未有淡水溫水性魚類中DCs存在的報道。
益生菌是一類對宿主有益的活性微生物, 可定植于宿主腸道等組織中[8]。在哺乳動物中, 多項研究表明益生菌可調節樹突狀細胞的功能, 從而影響宿主的免疫水平[9—11]。Hart等[12]發現乳酸菌可促進樹突狀細胞分泌IL-10, 抑制IL-12的表達, 緩解IBD患者的炎癥反應。糞球菌等可抑制CD40等細胞因子的表達, 減少成熟的樹突狀細胞的數量, 避免過度免疫反應的發生[13]。在水產養殖中, 益生菌已被證實可有效促進魚體的生長, 改善腸道微環
境[14, 15]。
枯草芽孢桿菌Ch9(Bacillus subtilisCh9)是一株分離自草魚腸道的益生菌, 在本實驗室之前的研究中證實使用該菌株可有效減輕嗜水氣單胞菌(Aeromonas hydrophila)引起的腸道損傷[16,17]。本研究通過魚類細胞培養技術分離獲得草魚樹突狀細胞, 并比較了其與哺乳動物樹突狀細胞在形態和功能上的區別。這些結果有助于我們更好地理解低等脊椎動物免疫系統, 并為水產動物疫苗的研發提供基礎。此外, 通過分析益生芽孢桿菌對樹突狀細胞免疫功能的調控, 為其在草魚生態養殖中的應用提供重要的理論依據。
1 材料與方法
1.1 實驗材料
實驗用草魚(Ctenopharyngodon idellus, 體重1000—2000 g/尾)來自湖北省武漢市江夏區漁場。實驗前2周暫養于華中農業大學水產學院水產養殖教學實驗中心循環水系統中。水溫控制在24—28℃, 期間按體重的4%投喂商業飼料(湖北海大集團)。每日更換1/3的水并清潔殘余的飼料殘渣。實驗前檢查魚體表無明顯傷痕和病原感染癥狀。
1.2 實驗用菌株
嗜水氣單胞菌(Aeromonas hydrophila)Ah1菌株:分離自細菌性敗血癥銀鯽腸道, 可引起草魚、銀鯽、團頭魴、鰱等魚類細菌性敗血癥和腸炎。將Ah1菌株接種于LB液體培養基, 28℃振蕩培養過夜后3500 r/min離心10min, 無菌PBS洗滌兩次后重懸至適宜的濃度備用。
枯草芽孢桿菌(Bacillus subtilis)Ch9菌株: 分離自健康草魚腸道。將Ch9菌株接種于LB液體培養基, 28℃振蕩培養過夜后離心收集, 無菌PBS洗滌兩次后重懸至適宜的濃度備用。
UV滅活的枯草芽孢桿菌: 按上述步驟獲得Ch9菌液, PBS洗滌重懸后紫外照射30min。通過涂布LB平板檢測照射后菌液中細菌活性。
上述菌株由華中農業大學水產學院細菌學實驗室保存并提供。
1.3 主要試劑的配制
AIM液: 含有47.5 mL L-15培養基, 2.5 mL雙抗,2.5 μg/mL兩性霉素B和25 μg/mL慶大霉素, 置于4℃備用。
細胞原代培養基: 含有44.5 mL L-15培養基,0.5 mL雙抗, 5 mL胎牛血清FBS, 2.5 μg/mL兩性霉素B和25 μg/mL慶大霉素, 置于4℃備用。
L-15培養基購自Hyclone公司, 雙抗、LPS、兩性霉素B和慶大霉素購自Biosharp公司, 胎牛血清FBS購自ScienCell公司, Ficoll分離液購自GE Healthcare公司。
1.4 草魚樹突狀細胞的分離培養
選取健康的草魚, 使用過量MS-222浸泡麻醉致死。在無菌條件下取出脾臟。AIM液中浸泡, 用無菌注射器橡膠塞輕輕按壓通過200目(70 μm)細胞篩。獲得的單細胞懸液按照2∶1的體積比輕輕鋪加在盛有Ficoll分離液的15 mL離心管中。800×g室溫離心20min后, 吸取界面層之間的細胞, 無菌PBS洗滌兩次, 加入細胞原代基培養重懸并調整密度為5×106cells/mL。轉移至25 cm2細胞培養瓶中, 于28℃細胞培養箱中, 隔天吸出原培養瓶里一半的培養基, 離心收集懸浮細胞, 再加入一半新鮮培養基,培養7—10d, 收集非貼壁細胞備用。
1.5 草魚樹突狀細胞的富集
使用密度為1.067和1.077 g/mL的Percoll密度分離液, 按照說明書的步驟操作富集上一步收集到的非貼壁細胞。富集后的細胞用無菌PBS洗滌兩次,流式細胞儀檢測其純度。
1.6 姬姆薩染色觀察
將細胞懸液滴加于玻片上均勻鋪開, 自然風干后滴加1—2滴甲醛溶液固定。待自然風干后滴加姬姆薩染色工作, 染色15min, PBS輕輕沖洗, 自然晾干后封片觀察。
1.7 樹突狀細胞生物學功能鑒定
刺激T淋巴細胞增殖能力的測定: 采用混合淋巴反應法來檢測草魚樹突狀細胞刺激T淋巴細胞增殖的能力。同種異體淋巴細胞的收集根據Bassity等[6]的方法進行。選取體重1000 g左右的健康草魚, 在無菌條件下取出脾臟, 置于盛有AIM液的培養皿中浸泡1h, 期間用無菌眼科剪將組織切成1 cm3大小的小塊, 輕輕按壓通過200目(70 μm)的細胞篩,獲得的單細胞懸液按照2∶1的體積比輕輕鋪加在盛有Ficoll分離液的15 mL離心管中。800×g室溫離心20min后, 吸取界面層之間的細胞, 無菌PBS洗滌兩次, 加入細胞原代基培養重懸并調整密度為5×106cells/mL。轉移至25 cm2細胞培養瓶中, 于28℃細胞培養箱中靜置2h, 輕輕晃動培養瓶, 吸取懸浮細胞即得到淋巴細胞。使用CFSE染色液, 按照說明書進行染色。DC和淋巴細胞均調整濃度為1×106cells/mL,按照1∶1、1∶2、1∶4、1∶8的比例分別加入24孔板中。空白對照組中僅加入等量的淋巴細胞。28℃細胞培養箱中孵育3d, 流式細胞儀檢測增殖情況。
遷移能力的測定: 使用Transell板測定草魚樹突狀細胞的遷移能力。Transewell小室膜直徑為3 μm, 小于細胞直徑(>10 μm)從而降低被動遷移的影響。上室加入1×106個細胞, 下室分別加入PBS(空白對照)、LPS (5 μg/mL)、嗜水氣單胞菌Ah1(MOI分別為0.1和1)、枯草芽孢桿菌Ch9 Muhiplieity of infection (MOI分別為0.1和1)。28℃細胞培養箱中孵育4h, 輕輕刮去上室的細胞, 用0.25%的胰蛋白酶消化膜上的細胞, DAPI染色后, 熒光顯微鏡計數。
1.8 膜表面標記分子的測定
調整細胞濃度為1×106cells/mL接種于24孔板中, 加入LPS至濃度為5 μg/mL。28℃細胞培養箱中孵育12h, 收集細胞用于檢測DCs膜表面標記分子CD83、CD80/86表達情況。
1.9 益生芽孢桿菌和樹突狀細胞共孵育
調整細胞濃度為1×106cells/mL接種于24孔板中, 按照MOI=100加入UV滅活的枯草芽孢桿菌,28℃細胞培養箱中孵育。分別于0、2h、4h、8h、12h和24h收集細胞, 檢測抗炎性因子IL-4、IL-10的表達。
1.10 RNA的提取和cDNA的合成
使用Trizol法提取收集到的細胞樣本的總RNA,并用1%瓊脂糖凝膠電泳和NanoDrop 2000分光光度計檢測其濃度和質量, -80℃冰箱保存備用。cDNA的合成使用PrimeScriptTMRT reagent Kit with gDNA Eraser試劑盒, 按照說明書的步驟進行反轉錄獲得。
1.11 RT-PCR分析
利用實時熒光定量方法(RT-PCR)檢測相關基因的表達情況, 以β-actin基因作為內參基因, 引物序列見表 1。使用LightCycler 480 II熒光定量PCR儀上進行qPCR反應。反應體系為: Master Mix 10 μL, ddH2O 7 μL, 上游引物1 μL, 下游引物1 μL,cDNA 1 μL; 每個樣品3個重復。用2-ΔΔCt法計算相對表達量, 結果以平均值±標準差(Mean±SEM)表示。
1.12 數據處理
使用SPSS 18軟件進行數據分析處理, 不同處理組之間的比較使用獨立樣本t檢驗(Independent samples,t-test), 多組數據間的比較使用Ducan法進行分析,P<0.05表示具有顯著性差異。
2 結果
2.1 草魚樹突狀細胞分離培養和觀察
從草魚脾臟初始分離的細胞種類比較復雜, 由單核細胞、巨噬細胞、嗜酸性粒細胞、淋巴細胞等組成(圖 1A)。在培養過夜后, 部分細胞轉為半貼壁狀態。在培養的第3天, 可見大的、非黏附的圓形細胞聚集形成集落(圖 1B)。在培養7d后, 小而圓的、非黏附細胞基本消失; 體積較大的、非黏附細胞比例上升, 呈現出類似于哺乳動物樹突狀細胞的分枝狀形態(圖 1C)。
收集這類非貼壁細胞并使用密度分離法純化后, 流式細胞分析的結果顯示細胞純度有較大提升,通常可達80%以上。吉姆薩染色結果顯示(圖 2), 這類細胞具有典型的樹突樣形態, 不規則的分葉的細胞核, 與哺乳動物樹突狀細胞的吉姆薩染色結果相比具有高度相似性[18,19]。
2.2 草魚樹突狀細胞生物學功能分析
圖 3A顯示了孵育3d后流式細胞儀檢測混合淋巴反應中T細胞增殖的情況。當DC∶淋巴細胞比例為1∶1時, 增殖細胞占比為30.76%; 比例為1∶2時, 增殖細胞占比為20.53%; 比例為1∶4時, 增殖細胞占比為16.28%; 比例為1∶8時, 增殖細胞占比為7.42%。結果表明草魚樹突狀細胞可有效啟動混合淋巴反應, 刺激T淋巴細胞增殖且具有劑量依賴性。
Transwell實驗結果表明(圖 3B), 與對照組相比, 樹突狀細胞在LPS和嗜水氣單胞菌的刺激下遷移細胞數量具有顯著性差異(P<0.05)。但在枯草芽孢桿菌刺激下的遷移細胞數量差異不顯著。這表明草魚樹突狀細胞可以有效地向抗原物質遷移, 以便下一步的捕獲過程的進行。
2.3 草魚樹突狀細胞膜表面標記分子表達的研究
在LPS刺激12h后, 草魚DCs膜表面標記分子CD83、CD80/86表達顯著提升(圖 4), 與對照組相比差異顯著(P<0.05)。
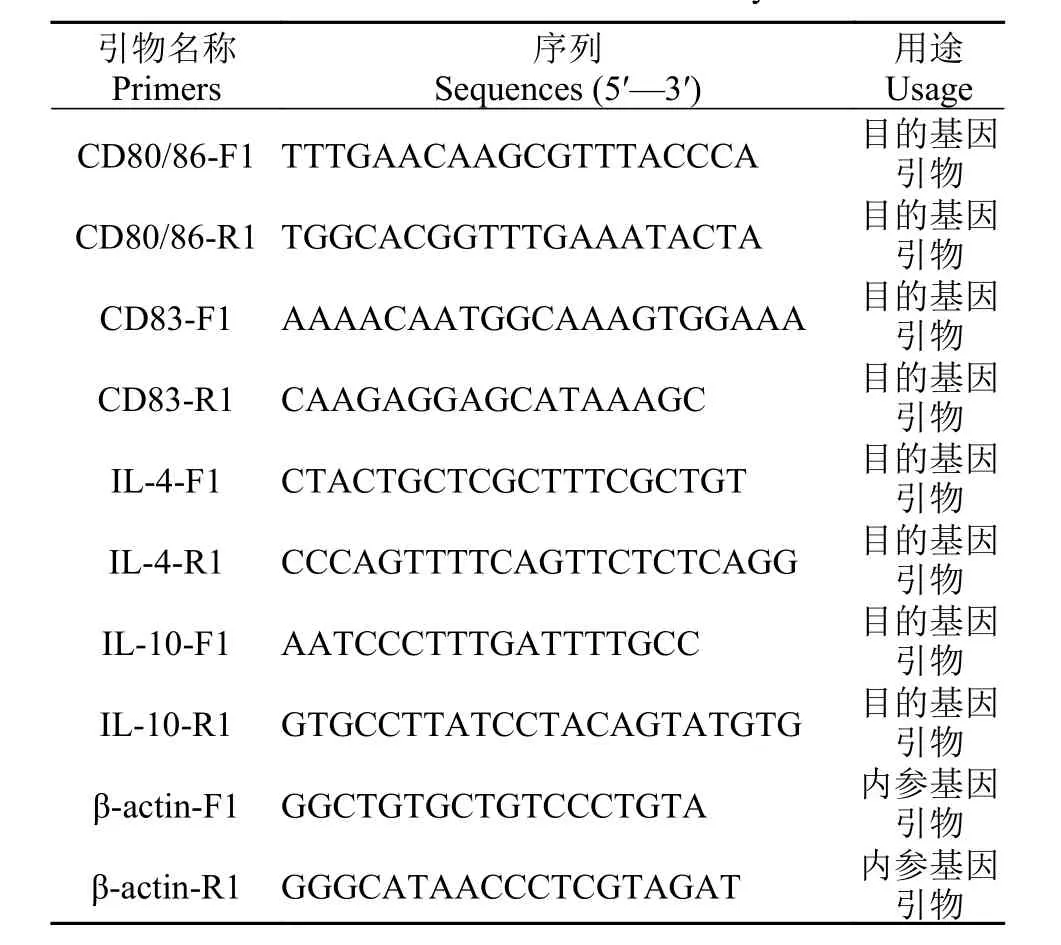
表 1 實驗所用引物序列Tab. 1 Primers used in this study
2.4 益生枯草芽孢桿菌對草魚樹突狀細胞免疫功能的調控
RT-PCR的結果表明, 益生枯草芽孢桿菌刺激可以有效促進草魚樹突狀細胞中抗炎性因子IL-4和IL-10的表達(圖 5)。在2—12h期間, 與對照組相比均顯著性提升。在24h時IL-4的表達差異不顯著,IL-10的表達仍顯著性提升。

圖 1 不同培養時期草魚樹突狀細胞形態觀察Fig. 1 Morphological observation of dendritic cells of grass carp at different time points
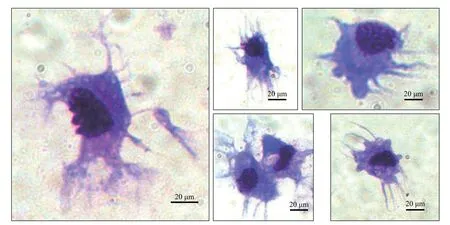
圖 2 草魚樹突狀細胞的姬姆薩染色圖片Fig. 2 Giemsa staining of dendritic cells of grass carp (Bar=20 μm)
3 討論
在哺乳動物中, 常常從骨髓中獲得培養DCs所需的前體細胞[19]。由于魚類缺乏這類組織, 因此我們對哺乳動物DCs的培養方法進行了修改。建立了從魚體內重要的免疫器官——脾臟中分離培養DCs的方法。與哺乳動物DCs相比, 培養7d后收集得到的樹突狀細胞, 在形態、生物學功能和膜表面分子標記的表達上具有高度的相似性。此外, 與虹鱒[6]和斑馬魚[5]DCs相比, 草魚DCs在應對LPS等抗原刺激時, 與成熟過程相關的膜表面分子CD83、CD80/86的表達更加快速而強烈。這可能是不同物種間的差異所導致。這一結果也為比較不同環境下相近物種免疫功能的差別提供了有益的依據。
在哺乳動物DCs培養中, 常常需要添加細胞生長因子如GM-CSF來促進前體細胞向DCs的分化。在我們前期的實驗中, 向培養的DCs前體細胞中加入了重組人GM-CSF, 但與對照組相比, 在DCs產生的數量上并沒有顯著差異。這一結果與小鼠脾臟中分離細胞并在不添加生長因子情況下獲得未成熟DCs的結果相似[20]。對此我們推測草魚DCs是通過細胞自身分泌的生長因子來誘導分化成熟。
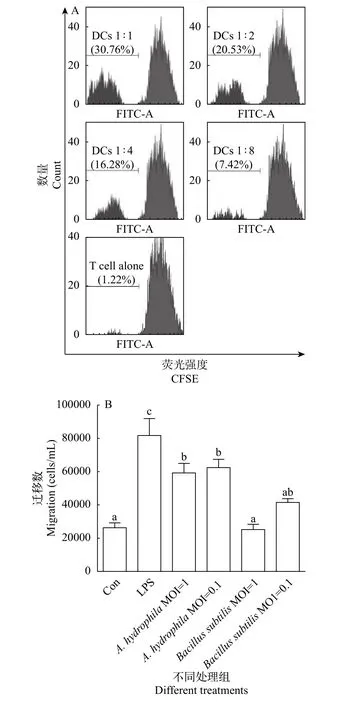
圖 3 草魚樹突狀細胞功能分析結果Fig. 3 Function analysis of dendritic cells of grass carp
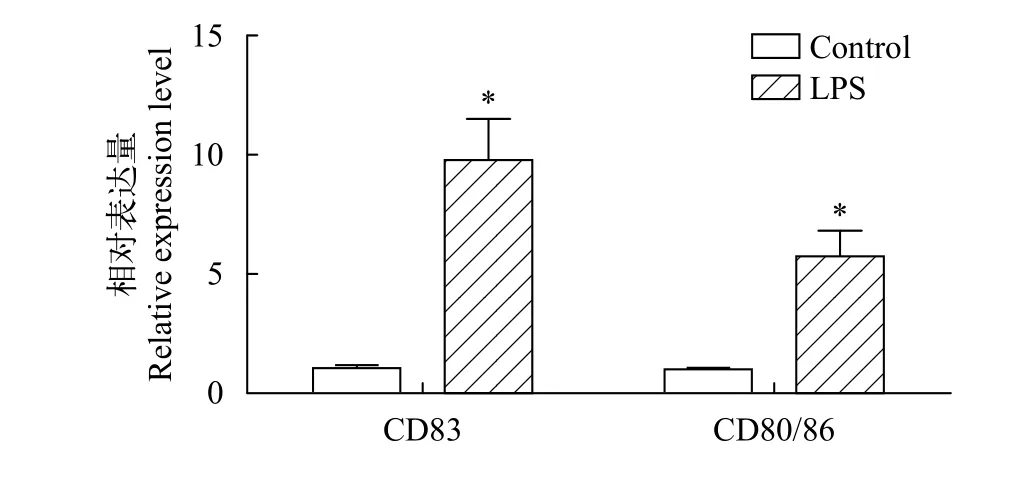
圖 4 草魚樹突狀細胞膜表面分子表達情況Fig. 4 Relative expression of surface molecular markers on grass carp dendritic cell
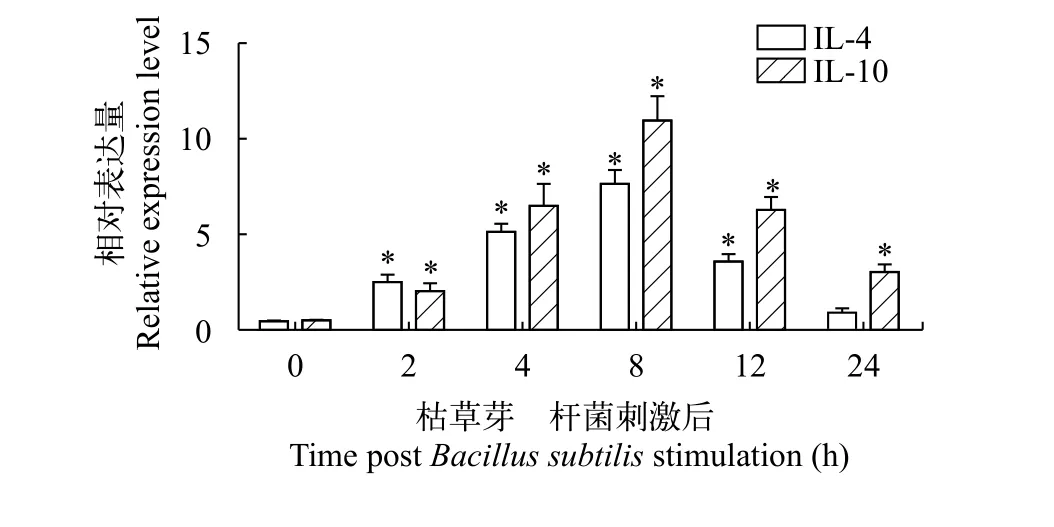
圖 5 益生枯草芽孢桿菌刺激后草魚樹突狀細胞抗炎性因子表達的變化Fig. 5 Expression of anti-inflammatory cytokines in gDCs stimulated by B. subtilis
CD83和CD80/86是哺乳動物成熟DCs的特異性膜表面分子標記物。在哺乳動物中CD80和CD86是兩種不同的分子標記物, 但在魚類中, 普遍認為CD80/86基因與哺乳動物中CD80和CD86基因具有高度的功能保守。在魚類相關研究中, 有報道稱虹鱒的CD83表達與MHC-II的表達也具有相關性[21], 說明魚類中CD83的表達可能也存在和哺乳動物類似的調節機制。目前多種魚類中均發現CD83基因的存在, 在巨噬細胞、淋巴細胞中均檢測到其表達[22—24]。在哺乳動物中, CD83在mRNA水平的表達不僅僅存在于DCs, 在T細胞、B細胞、單核細胞和巨噬細胞中均有檢測到[25—27], 但蛋白表達僅存在于DCs中[28,29]。值得注意的是, mRNA水平的表達并不一定反映產生的蛋白量, 魚類也可能與哺乳動物一樣, 對轉錄后的翻譯過程進行調控, 因此盡管在非DCs的細胞中也檢測到CD83的表達, 但CD83依然可以在蛋白水平上作為魚類DCs的特異性標記物。下一步的研究可以通過草魚CD83單克隆抗體進行DCs的檢測, 對魚類DCs的生物學特征進行更深入的分析。
細胞因子是免疫系統的組成部分, 在免疫功能的調節中發揮著重要的作用[30,31]。IL-4、IL-10是IL家族的重要成員, 被認為是一類免疫抑制細胞因子, 在炎癥反應的調節中發揮著重要的作用[32]。IL-4具有誘導T細胞增殖的能力, 可促進Th2細胞的分化抑制Th1細胞的生成, 發揮抗炎作用[33]。研究表明IL-10可有效抑制Th1細胞的分化以及IL-1、TNF-α等促炎性細胞因子的釋放, 促進B、T細胞的增殖, 增強機體體液免疫的水平, 此外還可抑制氧自由基(ROS)的產生, 避免過度免疫反應對機體造成損傷[33—35]。在本研究中, 益生枯草芽孢桿菌可有效促進草魚樹突狀細胞IL-4、IL-10的表達, 證實其可通過抑制炎癥反應的發生發揮免疫調節作用。
綜上所述, 本研究首次從草魚體內分離培養了一類具有典型樹突狀形態的細胞, 通過形態學比較、生物學功能分析和膜表面標記分子表達的研究, 證實這類細胞和哺乳動物樹突狀細胞具有高度同源性。這一結果有助于豐富低等脊椎動物免疫系統組成的研究。此外, 通過檢測和益生枯草芽孢桿菌共孵育后DCs的抗炎性因子IL-4、IL-10的mRNA表達情況, 揭示了益生枯草芽孢桿菌對草魚樹突狀細胞免疫功能調控的機制, 為其在水產養殖中的應用奠定了理論基礎。

