噴霧干燥工藝對膠束態酪蛋白結構及抗氧化性的影響
曾秋兵,楊敏,*,王裕成,秦娟娟,楊繼濤
1(甘肅農業大學 食品科學與工程學院,甘肅 蘭州,730070)2(甘肅農業大學 理學院,甘肅 蘭州,730070)
酪蛋白(casein,CN)是牛乳中含量最高的蛋白質,是重要的營養成分之一。酪蛋白是一種磷酸化蛋白,主要由αs1-、αs2-、β-和κ-CN四部分組成。牛乳中,4種酪蛋白單體通過疏水相互作用、靜電斥力等作用形成直徑約80~400 nm的酪蛋白膠束(casein micelle,CM)[1-2]。目前,膠束態酪蛋白的內部結構并不明確,均以模型表示。眾多模型一致認為,αs-CN和β-CN通過疏水作用、膠體磷酸鈣連接構成膠束骨架,κ-CN位于膠束表面,維持膠體穩定,因此天然酪蛋白膠束是多孔狀納米級的球形聚合體[3-4]。
酪蛋白因較高的營養價值和乳化、發泡等功能特性,可作為乳化劑、增稠劑、營養強化劑等,是許多加工食品中關鍵功效成分[5]。膜過濾,特別是超濾技術,被廣泛應用于乳品行業,以提取乳蛋白,使牛奶標準化或增加牛奶中的蛋白質含量[6]。超濾技術是一種根據目標物直徑或分子量大小實現物料分離的技術,因此在乳蛋白分離中可以較為完整地保留膠束態酪蛋白天然的粒徑和結構,從而保留其理化及功能特性;且具有操作簡單、處理量大、綠色、高效、非熱等特點[7]。膜分離法制備膠束態酪蛋白工藝被廣泛關注[6,8-9]。陳建行等[7]用2種孔徑的中空纖維陶瓷膜分離乳蛋白濃縮液,發現40nm膜滲濾液中不含酪蛋白,能減少酪蛋白的損失,提高膠束的得率。
噴霧干燥是食品工業中廣泛應用的干燥技術,乳蛋白濃縮物的干燥處理大多采用這種方法,而干燥工藝對產品品質具有較大影響[7,9]。關于乳蛋白噴霧干燥相關研究主要集中在干燥工藝對乳蛋白理化性質及功能性質的影響方面。研究表明,在130 ℃下噴霧干燥獲得的乳蛋白濃縮物溶解性高于160 ℃和190 ℃[10]。抗氧化性是乳蛋白及其活性肽的重要活性之一,已有大量研究報道酪蛋白酶解物、酪蛋白美拉德反應產物的抗氧化性活性[11-13]。然而,膠束態酪蛋白的抗氧化性鮮有報道,而噴霧干燥工藝對膠束態酪蛋白抗氧化性的影響未見報道。
本文采用超濾技術對荷斯坦牛乳進行分離獲得膠束態酪蛋白,進而進行不同工藝的噴霧干燥,對干燥樣品的結構特性(粒徑、熒光特性、表面形貌)、溶解性、堆積密度,以及抗氧化性(還原力、DPPH和ABTS自由基清除率以及Fe2+螯合力)進行對比,探討噴霧干燥工藝對膠束態酪蛋白結構及抗氧化性的作用規律,可為噴干工藝優化及其在膠束態酪蛋白生產中的應用提供參考依據。
1 材料與方法
1.1 材料和試劑
材料:市購新鮮荷斯坦牛乳,置于裝有冰袋的保溫箱中,1h之內送達實驗室。
試劑:1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS),上海麥克林生化科技有限公司;鐵氰化鉀(K3Fe(CN)6),三氯乙酸(TCA),天津市凱信化學工業有限公司;FeCl2、FeCl3,天津市百世化工有限公司;坩堝,北京天連和諧儀器儀表有限公司;其他試劑均為分析純。
1.2 儀器與設備
S-3400N掃描電子顯微鏡,日本日立公司;Bettersize2000激光粒度分布儀,丹東百特儀器有限公司;FD-1-50真空冷凍干燥機,北京博醫康實驗儀器有限公司;NAI-GZJ型實驗室小型噴霧干燥機,上海那艾精密儀器有限公司;H1850臺式高速離心機,湖南湘儀實驗室儀器開發有限公司;TU-19系列雙光束紫外可見分光光度計,北京普析通用儀器有限責任公司;RNF0460管式膜設備,廈門福美科技有限公司;PHS-3C實驗室pH計,北京三信儀表廠;BSA224S電子天平,廣州市深華生物技術有限公司。
1.3 試驗方法
1.3.1 酪蛋白膠束的制備
膠束濃縮液的制備:新鮮的牛乳在4 000×g離心脫脂20 min,脫脂乳過10 kDa的卷式膜濃縮。膜進口壓力0.5 MPa,變頻調速20 Hz,夾套循環水以保證低溫超濾,截留液即是膠束態酪蛋白濃縮液。
干燥處理:膠束濃縮液一部分用于冷凍干燥,剩余部分用于噴霧干燥。噴干工藝按2個溫度2個壓強設置,分別是進口溫度130 ℃和150 ℃、霧化壓力0.05 MPa和0.1 MPa,撞針間隔時間1 s,物料流量250 mL/h。收集樣品,粉碎后過100目篩,置于4 ℃冰箱保存備用。采用凍干溫度-50 ℃、時間48 h冷凍干燥膠束態酪蛋白濃縮液。凍干樣記作CM,4個噴霧干燥工藝分別為130 ℃-0.05 MPa、130 ℃-0.1 MPa、150 ℃-0.05 MPa、150 ℃-0.1 MPa,記作CM1、CM2、CM3、CM4。經測定,樣品中蛋白質質量分數為66.78%,乳糖9.77%,脂肪2.65%,灰分8.51%。
1.3.2 水分含量的測定
不同干燥方式得到的膠束態酪蛋白按照GB 5009.3—2010食品中水分的測定,采用直接干燥法測定水分含量。
1.3.3 掃描電鏡觀察
取適量膠束態酪蛋白樣品置于銅臺上的導電膠條表面,小心涂抹使其分散為薄層,噴金后采用S-3400N掃描電子顯微鏡觀察,電壓12.0 kV。
1.3.4 粒徑的測定
將不同干燥方式得到的膠束溶于水,配制成10 mg/mL pH 7.0的溶液,用Bettersize2000激光粒度分布儀測定,水作為分散劑,泵速1 800 r/min,樣品折射率1.35,介質折射率1.33,取中位徑D50表示平均粒徑。
1.3.5 堆積密度的測定
堆積密度的測定參考GOULA等[14]的方法,將2 g膠束態酪蛋白樣品倒入10 mL量筒(139 mm×13 mm),適當用玻璃棒輕輕敲擊至量筒內樣品表面水平且體積不再變化,記錄樣品體積,質量與體積之比即為堆積密度。
1.3.6 溶解度的測定
參考MILTON等[15]的方法,略有修改。用恒溫磁力攪拌器在45 ℃下攪拌配制樣品溶液,用1 mol/L的HCl和NaOH溶液調節pH直至穩定,定容至終質量濃度為10 mg/mL。磁力攪拌2 h,定容后室溫放置2 h。將10 mL溶液移入15 mL恒重的離心管中,4 000 r/min離心10 min,去掉上清液,放入烘箱中于65 ℃烘至恒重,蛋白質質量記為A0,10 mL的溶液中蛋白質質量記為A1,每組平行3次,溶解性的計算如公式(1):

(1)
1.3.7 內源熒光的測定
參考YANG等[16]的方法,略有修改。用去離子水配制質量濃度為2 mg/mL pH 7.0的樣品溶液,用熒光分光光度計在室溫下測定其熒光發射光譜,激發波長設定為280 nm,發射光譜采集范圍為290~450 nm,激發波長與發射波長狹縫均為3.0 nm。
1.3.8 抗氧化性的測定
1.3.8.1 還原力的測定
參照WANG等[17]的方法,略有修改。分別將2.5 mL pH 6.6質量濃度為 1、2、4、8 mg/mL的樣品溶液與2.5 mL 0.2 mol/L pH 6.6 的磷酸鹽緩沖液和2.5 mL 1% 的鐵氰化鉀溶液混合。50 ℃水浴溫育20 min,冷卻至室溫后加入2.5 mL 10% TCA溶液,然后將混合物在4 000 r/min下離心10 min。取上清液2.5 mL加入2.5 mL超純水和500 μL 0.1% FeCl3溶液,混勻后靜置10 min,于700 nm下測量吸光度。還原力用700 nm處的吸光度表示。
1.3.8.2 Fe2+螯合力的測定
參照GU等[13]和WANG等[17]的方法,略有修改。分別將0.2 mL pH 6.6質量濃度分別為1、2、4、8 mg/mL的樣品溶液與3.65 mL 去離子水、0.05 mL 2×10-3mol/L FeCl2溶液混合,將混合物在28 ℃下靜置30 s。隨后加入0.1 mL 5×10-3mol/L菲洛嗪并混合,在室溫下靜置10 min后于4 000 r/min離心5 min,取上清液于562 nm處測定吸光度,記為Ai。對照組用水代替,記為Aj,螯合力計算如公式(2):

(2)
1.3.8.3 DPPH自由基清除力的測定
參照WANG等[17]和XIE等[18]的方法,略有修改。分別將1.5 mL pH 6.6質量濃度分別為1、2、4、8 mg/mL的樣品溶液加入到1.5 mL 1×10-4mol/L DPPH乙醇溶液中,振蕩均勻,并室溫避光靜置20 min。將混合物于4 000 r/min下離心10 min,于517 nm處測量上清液的吸光值,記為A1,用等體積乙醇溶液代替DPPH溶液,記為A2,等體積水代替樣品溶液,記為A0。等體積水和乙醇混合溶液調零。DPPH自由基清除力計算如公式(3)所示:

(3)
1.3.8.4 ABTS自由基清除力的測定
參考KONG等[19]和RE等[20]的方法配制ABTS工作液,在暗環境下放置12~16 h。測定時,取適量工作液,用pH 7.4的磷酸鹽緩沖液稀釋使其在波長734 nm處的吸光值為0.70±0.02(記為A0),即可使用。取50 μL pH 6.6的樣品溶液,加入3 mL ABTS稀釋液,室溫反應6 min,測定734 nm處的吸光度值A。ABTS自由基清楚力計算公式如公式(4)所示:

(4)
1.4 數據統計分析
所有實驗重復3次,試驗數據采用Excel 2010處理并用平均數±標準偏差表示,用Origin Pro 9.0作圖,用IBM SPSS Statistics 22進行差異顯著性分析,數據間差異顯著分析采用Duncan法。
2 結果與分析
2.1 干燥工藝對膠束態酪蛋白水分含量的影響
酪蛋白的水分含量和粒徑影響其功能性質和乳制品品質[21]。如表1所示,噴霧干燥工藝對膠束態酪蛋白水分含量具有顯著影響(P<0.05)。隨著進口溫度的升高,同一霧化壓力下樣品含水量降低;從130 ℃提高到150 ℃,0.05 MPa和0.1MPa下水分含量分別降低了18.84%和19.27%;而CM4與CM1相比,水分含量降低了30.30%。同一溫度下,隨著霧化壓力的升高,樣品含水量顯著降低(P<0.05)。凍干樣品平均水分含量為(5.25±0.15)%,低于130 ℃噴干樣,高于150 ℃噴干樣,且與CM1、CM4差異顯著(P<0.05)。
進口溫度升高可提高樣品的干燥速率,霧化壓力增加可降低樣品液滴的尺寸。隨著溫度和壓力的增加,干燥器內部相同時間內蒸發能量增加,顆粒內部更多水分向外表面遷移,因此水分含量降低[22]。130℃噴干的膠束態酪蛋白含水量略高于相同溫度下噴干的乳蛋白濃縮物含水量(4.25%)[10],這是由于不同原料的水分結合性不同,而且霧化壓力也存在差異所造成的。由此可見,提高進口溫度和霧化壓力可降低膠束態酪蛋白水分含量,且一定條件下冷凍干燥也能獲得和噴霧干燥樣品較為接近的水分含量。

表1 不同干燥工藝對樣品水分含量、粒徑和堆積密度的影響
注:表中同一列不同小寫字母表示差異顯著(P<0.05)。
2.2 干燥工藝對膠束態酪蛋白表面形貌的影響
膠束態酪蛋白表面形貌如圖1所示,凍干樣品沒有規則形貌,噴干樣品為帶有凹陷的球形顆粒且粒徑分布范圍較大。隨著噴干溫度和壓力的增加,膠束態酪蛋白尺寸沒有顯著變化,但表面凹陷位點略有增加。

圖1 不同干燥工藝下膠束態酪蛋白的掃描電鏡圖
冷凍干燥過程中,膠束態酪蛋白逐漸失水且連成片狀,干燥樣品沒有規則形狀。噴霧干燥過程中,由于樣品霧化成液滴,之后經歷快速失水,形成球形形貌。由于噴干過程中,水分從液滴內部迅速遷移至表面蒸發,而酪蛋白分子量較大,遷移速率極慢,因而表面出現凹陷,呈葡萄干狀[23-24]。
2.3 干燥工藝對膠束態酪蛋白堆積密度的影響
堆積密度是粉末樣品的物理特性之一;堆積密度越大,表示相同質量的物料體積越小,比表面積越大。不同干燥工藝對樣品堆積密度的影響如表1所示。CM的堆積密度最大,為416.47 mg/mL。噴霧干燥樣品堆積密度隨溫度和壓力的增加顯著增大(P<0.05)。結合圖1,凍干樣品沒有規則形貌,粉碎后體積較大,因此堆積密度較大。噴干樣品的凹陷位點隨著噴干溫度和壓力的升高而有所增多,致使其比表面積增加,在敲擊塌陷過程中小顆粒恰好可填充大顆粒凹陷部位,所以堆積密度增大。有研究指出[25],牦牛乳粉堆積密度隨著噴干溫度的升高(130~170 ℃)而增大,與本文研究結論相似。
2.4 干燥工藝對膠束態酪蛋白粒徑的影響
不同干燥工藝下膠束態酪蛋白粒徑如表1所示。4個噴霧干燥樣品的粒徑隨溫度和壓力的增加而增大,其中CM4粒徑最大,CM1、CM2、CM3的粒徑差異不顯著(P>0.05)。凍干樣品粒徑顯著低于噴霧干燥樣品(P<0.05)。干燥溫度的升高使殘留的乳清蛋白與膠束的共價結合程度增加,而且殘留的乳糖和膠束的熱聚合也有所加劇,致使膠束表面附著物增多,故而粒徑有所增加。
2.5 干燥工藝對膠束態酪蛋白溶解性的影響
溶解特性是蛋白質發揮其功能性質的基礎[25]。由圖2可以看出,同一干燥處理樣品不同pH下溶解性差異顯著(P<0.05)。隨著pH的升高,膠束態酪蛋白溶解性增加,表現出堿性解離。隨著噴干溫度的升高,樣品溶解性降低;隨著霧化壓力的增大,溶解性也出現降低趨勢。同一pH下,凍干樣品CM和130 ℃-0.05 MPa條件下噴干樣CM1的溶解性差異不顯著(P>0.05)。中性和弱堿性pH下,CM1和CM3溶解性差異不顯著(P>0.05),即0.05 MPa壓力下溫度對溶解性影響不大;CM2和CM4溶解性差異顯著。可見,霧化壓力對溶解性的影響取決于進口溫度。
文獻指出,隨著溫度的升高,噴干乳粉溶解性降低,且溶解度約80%[10,25],與本文研究結論基本一致。進口溫度越高,乳清蛋白、酪蛋白熱變性程度越高;同時,酪蛋白膠束和乳清蛋白以及乳糖之間的熱聚合作用越明顯,甚至出現明顯的美拉德反應,從而形成分子量較大、溶解性較差的顆粒,所以樣品溶解度會隨溫度的升高而降低[26]。另外,霧化壓力增大,樣品液滴變小,比表面積增加,熱聚集和熱變性程度加劇,因此高溫下增加壓力時溶解性的降低程度增大。由此可見,酪蛋白膠束在噴干過程中不宜采用過高的進口溫度和霧化壓力。
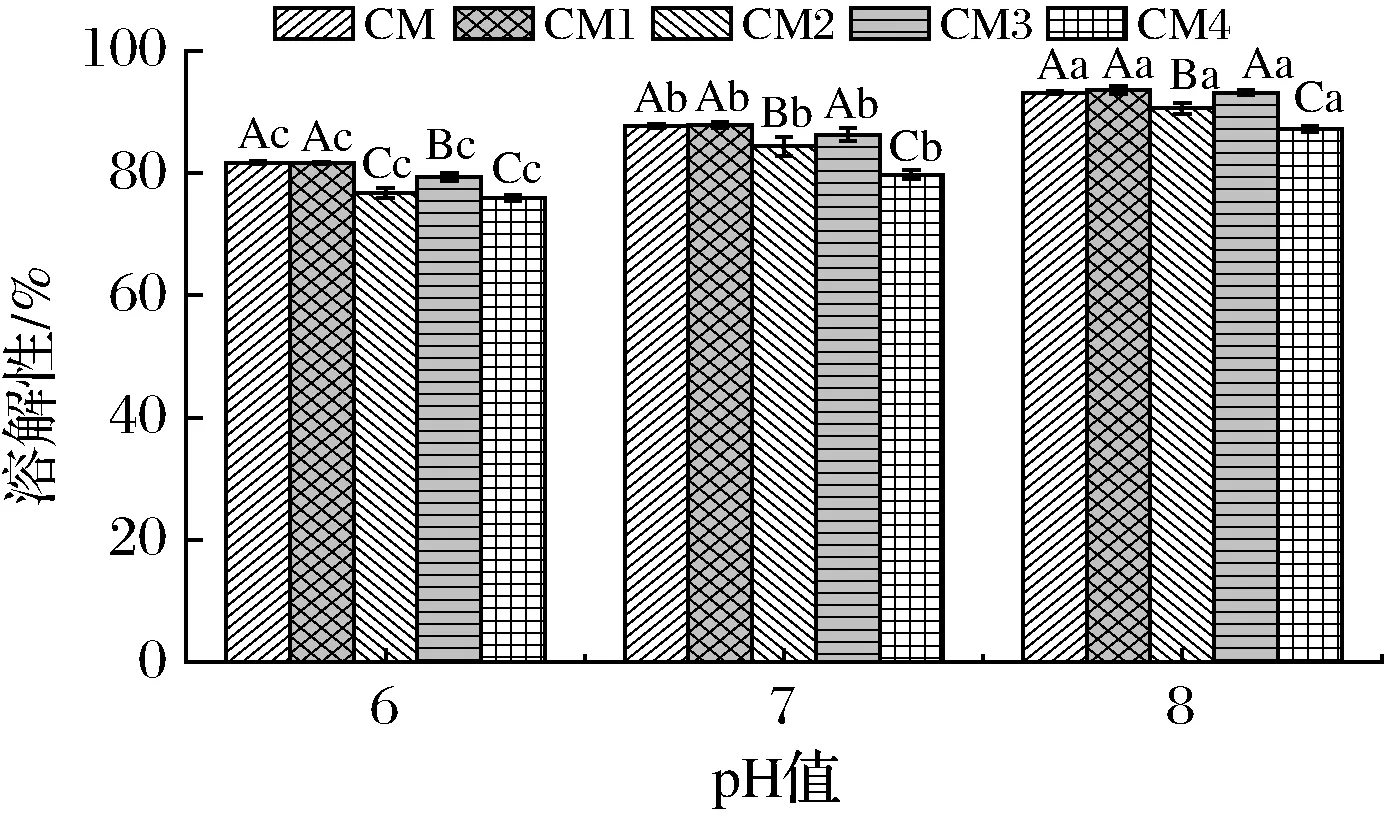
圖2 不同干燥工藝對膠束態酪蛋白溶解性的影響
2.6 干燥工藝對膠束態酪蛋白內源熒光的影響
內源熒光光譜分析主要用于判斷蛋白質三級構象的變化以及色氨酸殘基周圍微環境變化[27]。若最大發射波長大于330 nm,則表明蛋白結構松散,色氨酸殘基暴露在極性更大的環境中;反之,最大發射波長小于330 nm,則表明蛋白結構緊湊,殘基處于疏水性更大的環境中[28]。如圖3所示,樣品的最大熒光強度依次為CM>CM1>CM3>CM2>CM4,最大發射波長都在336 nm處。由此可見,本文選取的噴霧干燥工藝對膠束態酪蛋白的內部結構沒有產生顯著影響。在噴干過程中,迅速干燥使得酪蛋白膠束結構來不及改變,依然保持原有的內部構象。隨著干燥溫度和壓力的增大,最大熒光強度呈現降低趨勢,這可能是由于酪蛋白膠束表面部分親水性基團在溫度和壓力作用下暴露出來,因此熒光強度略有降低,且CM4的熒光值最低。綜上所述,噴霧干燥可較好地保留膠束態酪蛋白天然內部結構。

圖3 不同干燥工藝下膠束態酪蛋白的內源熒光光譜
2.7 干燥工藝對膠束態酪蛋白抗氧化性的影響
2.7.1 還原力
還原力表示抗氧化劑提供電子或氫的能力[18]。不同干燥方式對膠束態酪蛋白還原力的影響如圖4所示。還原力大小與樣品濃度之間存在一定的關系,隨濃度增加,還原力基本呈現線性增大。同一樣品不同濃度之間還原力差異顯著(P<0.05),這與WANG等[17]的研究結果類似。5個干燥樣品中,相同濃度條件下CM1的還原力最大,且顯著高于其他4個樣品;150 ℃-0.1 MPa干燥樣CM4的還原力最差。樣品質量濃度在8 mg/mL時, CM和CM2的還原力沒有顯著差異(P>0.05)。
隨著進口溫度的增大,樣品還原力顯著降低;隨著霧化壓力的增大,樣品還原力顯著降低(P<0.05)。溶解性研究結果顯示,溫度升高時樣品溶解性降低(圖2),而良好的溶解性是還原力發揮的前提。另一方面,粒徑分析顯示(表1),隨著溫度和壓力的增加,樣品粒徑增大,說明樣品熱聚集增強,使其活性基團難以發揮或喪失還原能力。因此,膠束態酪蛋白樣品隨著噴干溫度和霧化壓力的增加,其還原力降低。綜上所述,噴干條件對膠束態酪蛋白的還原力具有顯著影響。

圖4 不同干燥工藝對樣品還原力的影響
2.7.2 Fe2+螯合力
研究表明,蛋白質中的巰基、氨基等基團可以螯合Pb2+、Fe2+、Cu2+等金屬離子,這類蛋白質既可以作為有效的抗氧化劑,也可以用作重金屬解毒劑[29]。如圖5所示,膠束態酪蛋白噴干粉的Fe2+螯合力隨濃度的升高而增大。CM3的Fe2+螯合力大于同濃度的其他4個樣品,且螯合力由1 mg/mL 的50.41%增加到8 mg/mL的88.49%;其次為CM4。凍干樣的Fe2+螯合力最差。總體而言,升高溫度有利于提升膠束態酪蛋白的Fe2+螯合能力,而霧化壓力對Fe2+螯合力的影響與溫度有關。
研究指出,蛋白質的金屬結合能力一般與螯合金屬離子的有效位點數量有關[30]。凍干過程中,酪蛋白膠束通過脫水作用可能會使內部結構收縮,變得緊致,其表現為粒徑較小(表1),因此部分活性基團被包埋在緊致結構內部,難以與Fe2+結合,所以螯合能力較差。對噴干樣品而言,溫度較高時會增加美拉德反應程度,而美拉德反應產物具有較好的Fe2+螯合能力[17],因此溫度升高時膠束態酪蛋白的Fe2+螯合力增大。然而,在150 ℃時,霧化壓力增大后樣品溶解度顯著降低(圖2),反而不利于螯合力的發揮。由此可見,適宜的進口溫度和霧化壓力可提升膠束態酪蛋白的Fe2+螯合力。

圖5 不同干燥工藝對樣品Fe2+螯合力的影響
2.7.3 DPPH自由基清除活力
DPPH是一種脂溶性自由基,當加入清除劑時,其褪色程度與清除劑呈一定劑量關系,因而可以通過吸光值的變化來判斷清除力大小[31]。不同干燥工藝對膠束態酪蛋白DPPH自由基清除活力的影響如圖6所示。膠束態酪蛋白的DPPH清除率表現出明顯的濃度依賴性,濃度越大,其清除力越大(P<0.05),這與WANG等[17]的研究結果一致。樣品質量濃度為8 mg/mL時,CM4的清除率為51.21%,顯著高于其他4個樣品。濃度為2 mg/mL時,清除率的大小依次為CM4、CM3、CM2、CM1、CM。這是因為,噴霧干燥溫度和壓力增加可能使膠束態酪蛋白表面美拉德反應程度增加,反應產物具有較好的自由基清除活力,因此CM4的DPPH自由基清除活力在濃度為2 mg/mL和8 mg/mL時高于其他樣品。其他濃度下噴干工藝對4種噴干樣品的DPPH自由基清除活力沒有顯著影響(P>0.05)。凍干樣品的清除力低于噴干樣品。
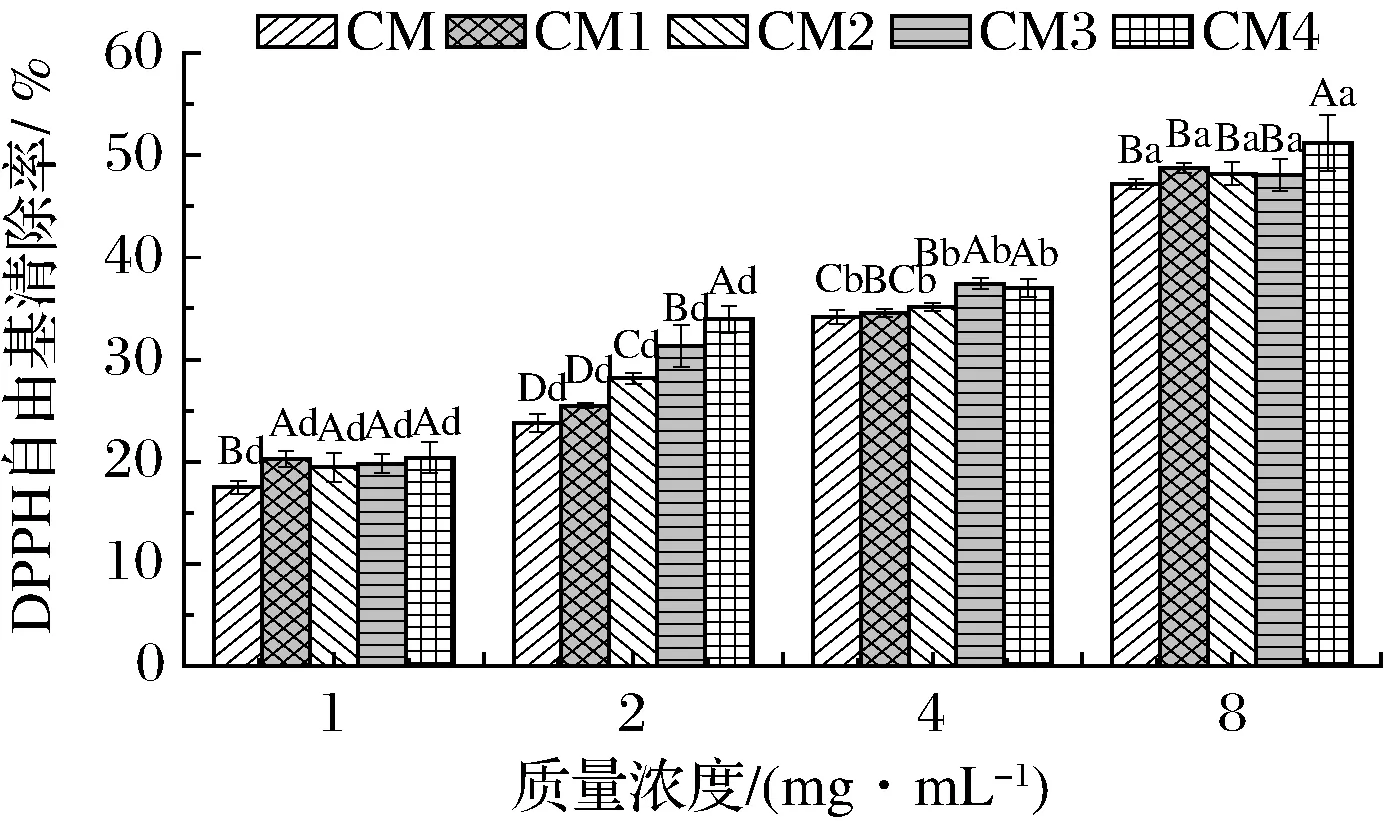
圖6 不同干燥工藝對樣品DPPH自由基清除活力的影響
2.7.4 ABTS自由基清除活力
不同干燥工藝下膠束態酪蛋白的ABTS自由基清除率如圖7所示。ABTS自由基清除率與樣品濃度存在顯著正相關性(P<0.05)。CM1和CM3的ABTS自由基清除率最大,且差異不顯著(P>0.05),但顯著高于其他3個樣品(質量濃度為8 mg/mL除外)。低濃度條件下,CM的清除力明顯小于CM4,但是當質量濃度大于2 mg/mL時, CM的清除率略高于CM4,這是因為CM的溶解性較好(圖2),濃度越大時其溶解的量較其他樣品越多,溶液中可與ABTS自由基作用的活性基團越多,因此清除率增大[32]。
溫度對樣品的ABTS自由基清除活性影響不大,但同一溫度下,壓力越大,其清除活性越差。ABTS為水溶性自由基,蛋白質對其清除活性與溶解性相關。壓力增加使樣品的溶解性降低(圖2),因此ABTS自由基清除活性也隨之降低。
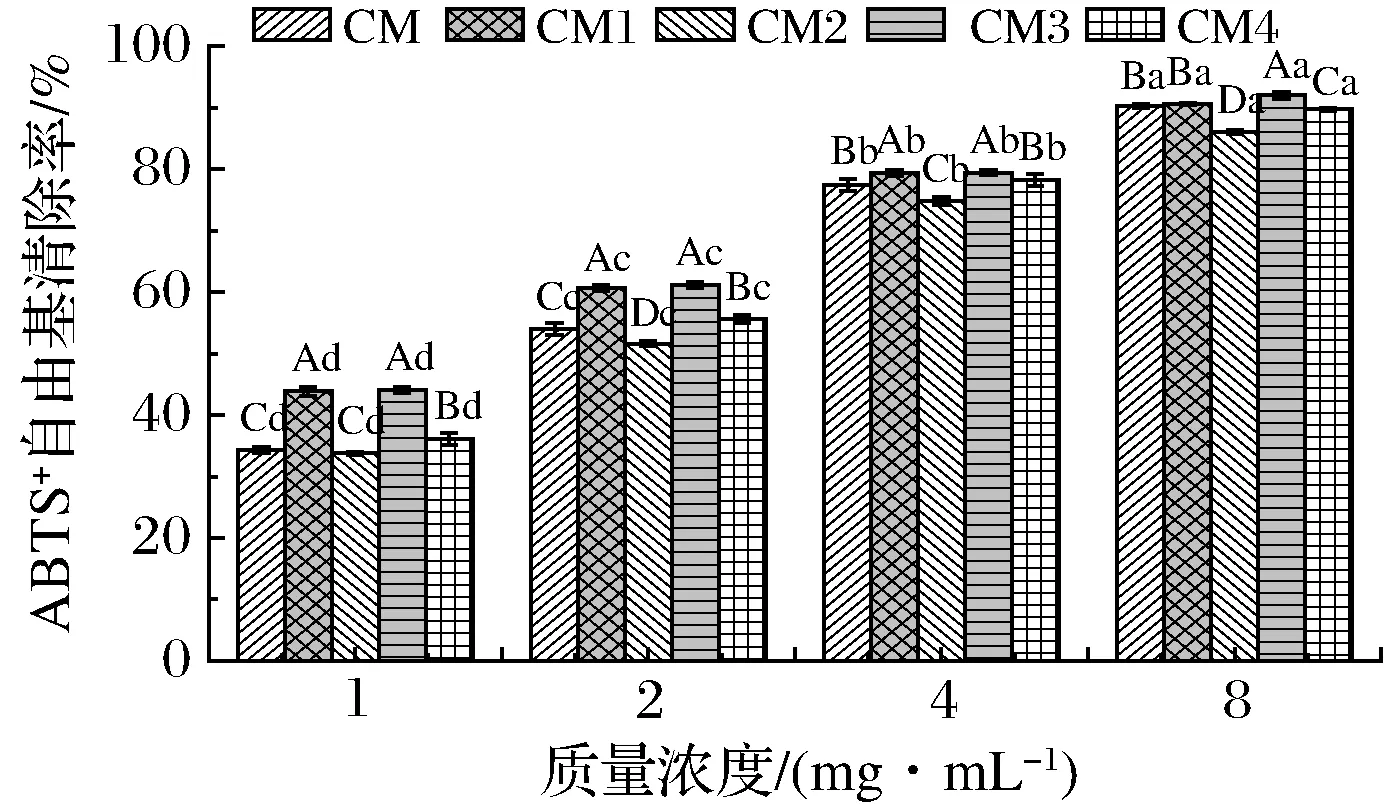
圖7 不同干燥工藝對樣品ABTS自由基清除率的影響
3 結論
噴霧干燥是粉末類乳制品的主要干燥方式。噴干工藝對膠束態酪蛋白的水分含量、粒徑和堆積密度具有顯著影響。隨著噴干溫度和壓力的升高,膠束態酪蛋白的水分含量顯著降低,堆積密度顯著增大,粒徑略有增大,但產品形貌沒有發生改變。就溶解度而言,由于高溫高壓會加劇蛋白質的熱聚集和變性,因此隨著溫度的升高,樣品溶解性降低;隨著霧化壓力的增大,溶解性也出現降低趨勢。內源熒光分析表明,噴霧干燥進口溫度和霧化壓力升高時,樣品表面的親水基團暴露程度增加,疏水性降低,但內部結構不發生顯著改變。
抗氧化性是乳蛋白及乳源活性肽的主要生物活性之一。抗氧化活性分析表明,膠束態酪蛋白的抗氧化活性與其濃度正相關;同濃度下,抗氧化活性與噴干工藝有關。其中,溫度較低時膠束態酪蛋白具有較好的還原力和ABTS自由基清除活力,這與其較好的溶解性有關。而較高的噴干溫度有利于提升膠束態酪蛋白的DPPH自由基清除能力。溫度和壓力對酪蛋白膠束的Fe2+螯合力具有協同作用,進口溫度150 ℃和霧化壓力 0.05 MPa工藝下螯合能力最高。
由此可見,噴霧干燥溫度和霧化壓力對膠束態酪蛋白的理化性質和抗氧化性均具有影響。總體而言,進口溫度130 ℃、霧化壓力 0.05 MPa的工藝條件下膠束態酪蛋白的溶解性及抗氧化性較好。

