白及蔗糖合成酶基因的克隆及表達分析
蔣素華 牛蘇燕 周一冉 崔波 梁芳 袁秀云 馬杰

摘要:? 為揭示白及蔗糖合成酶基因與生長發育的關系,該研究以白及為材料,利用RT-PCR技術同源克隆白及蔗糖合成酶的關鍵基因SuSy,對SuSy基因的生物學特性及表達特征進行了分析,并利用實時熒光定量PCR檢測SuSy基因在不同組織中的表達規律。結果表明:(1)白及SuSy基因長度為2 215 bp,編碼737個氨基酸,與鐵皮石斛、文心蘭和蝴蝶蘭的蛋白質氨基酸序列的相似性分別為97%、92%和95%。(2)生物信息學分析表明,SuSy蛋白質序列具有較高的親水性,與擬南芥SuSy蛋白質氨基酸三級結構一致性為75.2%;系統進化樹分析發現,白及SuSy蛋白與鐵皮石斛處于同一個分支上。(3)qRT-PCR結果表明,SuSy基因在葉片中的表達量最高,塊莖中的表達量最低;成熟葉片的表達量高于未成熟葉片的表達量;數據差異性分析顯示,SuSy基因在根、塊莖中表達量具有極顯著性差異,但在一年生葉和二年生葉中的表達量無顯著性差異,幼苗葉和一、二年生葉中表達量具有極顯著性差異。由此推測,SuSy基因可能受生長發育的誘導,是調控白及生長發育關鍵基因。
關鍵詞: 白及, SuSy基因, 生物信息學分析, 表達分析
中圖分類號:? Q786文獻標識碼:? A
文章編號:? 1000-3142(2020)02-0192-08
Abstract:? To reveal the function of sucrose synthase (SuSy) gene during the growth and development in Bletilla striata species, the SuSy gene was cloned and its biological and expression characteristics were analyzed. In this study, a key gene (SuSy) for sucrose biosynthesis was homologously cloned from B. striata by RT-PCR technology. Bioinformatics analysis of SuSy gene was performed and real-time fluorescence quantitative PCR was used to detect the expression pattern of SuSy gene in different tissues. The results were as follows: (1) The length of SuSy gene was 2 215 bp that encoding 737 amino acids. The similarity of the protein amino acid sequence in Bletilla striata to Dendrobium officinaleis, D. oncidium, and D. phalaenopsis were 97%, 92% and 95%, respectively. (2) The results of bioinformatics analysis showed that the SuSy protein sequence was high hydrophily, and the consistency of amino acid tertiary structure of SuSy protein between the Bletilla striata and Arabidopsis thaliana was 75.2%. Phylogenetic tree analysis suggested that the SuSy protein of Bletilla striata and Dendrobium candidum were grouped in the same branch. (3) The qRT-PCR assay showed that the expression level of SuSy gene was the highest in leaves and lowest in tubers. Moreover, the expression of SuSy gene in mature leaves was higher than that in immature leaves. According to the statistical analysis, the expression level of SuSy gene in roots and tubers were very significant, but there were no significant difference in the expression of one-year leaves and two-year leaves, and the expression of seedling leaves were extremely significant.? These findings suggested that SuSy gene may be induced by growth and development, and is the key gene for regulation of growth and development in Bletilla striata species.
Key words: Bletilla striata, SuSy gene, bioinformatics analysis, expression analysis
白及(Bletilla striata)是蘭科(Orchidaceae)白及屬(Bletilla)多年生草本植物,地下有粗厚的塊莖,富粘性,含白及膠質,可供藥用,有止血補肺、生肌止痛之效。蔗糖合成酶(sucrose synthase, SuSy) 在植物各組織中普遍存在(Sung et al.,1986),是高等植物體內控制蔗糖合成和降解的關鍵酶之一,提供多糖合成的前體,催化蔗糖進入各種代謝。蔗糖代謝相關酶與植物體內糖積累之間存在密切聯系,SuSy在蔗糖代謝中起主要的調控作用,在植物的生長發育和產量調控方面都具有重要的意義(Vaughn et al., 2002;Zhang et al., 2011;Wang et al., 2017)。目前研究者已經從鐵皮石斛(孟衡玲等,2011)、枸杞(王麗娟等,2013)、蝴蝶蘭(李冬梅等,2013)及花生(陳娜等,2013)等多種植物中將SuSy基因克隆出來。羅才林等(2017)利用轉錄組測序和電子克隆相結合的方法將白及SuSy基因序列進行了生物信息學分析。植物的蔗糖合成酶基因除主要參與儲存組織的生長外,也參與植物的抗逆性、果實的發育及花芽的分化和發育等生命活動(喬亮, 2012;Zhang et al., 2013; Xiao et al., 2014)。有研究表明,SuSy基因家族不同成員在植物生長發育過程中具有時空特異性(Wang et al., 2015;Chen et al., 2012),以玉米 (Zea mays) 中的3個SuSy基因為例,SH-SuSy1 主要在胚乳中表達;SuSy1在胚,以及根、莖和葉中都有表達;SuSy3 在胚乳、胚珠、根和幼芽中表達(Duncan et al., 2006)。此外,有研究表明, SuSy3在莖和根的維管組織中高表達,SuSy4 在塊莖的貯藏組織中高表達(Xu et al., 2012)。水稻(Oryza sativa) 中發現6 個SuSy基因,參與了不同的生長過程,SuSy1在根、幼葉、節間表達,SuSy3和SuSy4主要在穎果中表達,SuSy2 在所有組織中都表達(Hirose et al., 2008)。目前關于白及SuSy基因同源克隆和表達特性分析的研究還未見報道。結合白及的生理和生長特性,采取不同時期的白及組織材料,根據NCBI上登陸的其他不同植物的SuSy基因序列,設計簡并引物,采用RT-PCR方法克隆白及SuSy基因,并對其進行氨基酸序列比對,蛋白質二、三級結構預測和系統進化樹分析,利用實時熒光定量PCR技術分析SuSy基因在白及的不同時期根、葉和塊莖中的表達。本試驗為進一步研究SuSy基因功能及代謝途徑奠定理論基礎,同時為白及蔗糖代謝和生長發育提供較為豐富有效的科學理論依據。
1材料與方法
1.1 試驗材料
供試的白及品種為紫花白及,種植于鄭州師范學院智能日光溫室,白及的栽培溫度為22~26 ℃,濕度為55%~65%。Escherichia coli DH5α菌株購自寶生物工程(大連)有限公司,反轉錄試劑盒購自上海拜力生物科技有限公司,植物RNA提取試劑盒購自廣州飛揚生物工程有限公司,普通瓊脂糖DNA 回收試劑盒、質粒小提試劑盒均購自天根生化科技(北京)有限公司,基因測序和引物合成由生工生物工程(上海)股份有限公司完成。
1.2 試驗方法
1.2.1總RNA 的提取和cDNA第一鏈的合成采用OMEGA HP Plant RNA Kit 植物總RNA 提取試劑盒,按照其說明要求進行RNA提取。利用反轉錄酶M-MLV將白及總RNA反轉錄成cDNA第一條鏈,作為白及SuSy基因克隆的模板。
1.2.2 設計簡并引物根據NCBI 中已經登錄的單子葉植物SuSy基因,經DNAMAN 序列比對,找出其中保守的核苷酸序列,在SuSy基因的保守區設計一對簡并引物,上游引物為TTTGGGTTATCCTGACACTGGT,下游引物為TCCTGAAGGGAACCCGAAG,用于擴增目的基因。
1.2.3 PCR擴增SuSy基因保守區以逆轉錄獲得的cDNA為模板,利用上游引物和下游引物PCR擴增白及的SuSy基因保守片段。反應體系10×PCR buffer 2.0 μL,dNTP(2.5 μmol·L-1)1.6 μL,MgCl2(25 μmol·L-1)1.5 μL,上、下游引物(10 μmol·L-1)各1.0 μL,Taq DNA聚合酶(5 U ·μL-1)0.2 μL,模板cDNA 1.0 μL,定量補足ddH2O至20 μL。PCR反應條件:94 ℃預變性3 min,94 ℃變性30 s,58.5 ℃退火30 s,72 ℃延伸3 min,30個循環,72 ℃延伸5 min。
1.2.4 白及SuSy基因保守區的鑒定取PCR產物進行經瓊脂糖凝膠電泳檢測,待檢測之后,將擴增產物進行T-A連接,轉入大腸桿菌DH5α菌株進行測序分析。將測序結果進行Blast比對分析,驗證測序結果的正確性。.
1.3 SuSy基因的生物信息學分析
基因相似性采用NCBI上的BLAST分析,氨基酸序列比對采用DNAMAN分析,蛋白質親疏水性采用ProtScale分析,亞細胞定位采用PSORT Ⅱ軟件分析,蛋白質二級結構預測采用ExPASy網站上的GOR分析,系統進化樹采用MEGA6.0分析,蛋白質三級結構預測采用ExPASy網站上的SWISS-MODEL 分析。
1.4 SuSy基因的表達分析
根據SuSy基因序列設計出特異性較強的qRT-PCR引物,參照SYBR Premix Ex TaqTM Ⅱ使用說明,用qRT-PCR(Real-time quantitative PCR)的方法檢測SuSy基因在白及不同生長階段不同組織的表達量,白及EF1α基因作為內參基因(GenBank登錄號:MK448293)。SuSy基因qRT-PCR上游引物為TTTGGGTTATCCTGACACTGGT,下游引物為TCCTGAAGGGAACCCGAAG。EF1α內參基因上游引物為GCCGTCCTTATTATTGATTCCA,下游引物為GGGATCTTATCAGGATTGTAACCA。反應體系共20.0 μL:2×SYBR premix Ex Taq Ⅱ 10.0 μL,10 μmol·L-1上、下游引物各0.8 μL,DNA模板2 μL,滅菌蒸餾水6.4 μL。擴增程序:95 ℃預變性30 s,95 ℃變性15 s,58 ℃退火15 s,共41個循環。qRT-PCR結果按照公式Rel. Exp = 2-ΔΔCt計算該基因的相對表達量。式中:ΔCt=Ct(SuSy)-Ct(EF1a RNA);ΔΔ Ct=(各植物組織ΔCt)-(一年生塊莖ΔCt)。數據差異性采用SPSS 17.0(SPSS Inc., Chicago, USA)軟件進行單因素方差分析。
2結果與分析
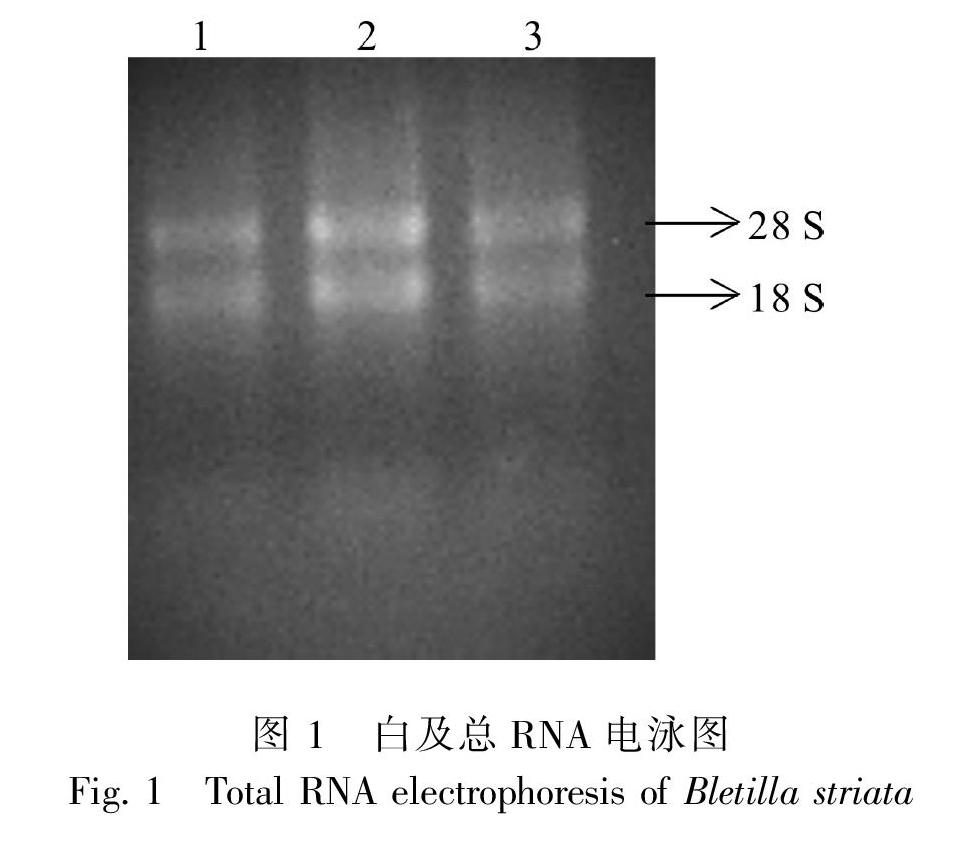
2.1 白及RNA提取
由電泳結果可知,白及葉片總RNA有完整的28S、18S和5S條帶(圖1),表明提取的總RNA完整性較好,很少出現降解現象,OD260/280的值為2.12,濃度為110.23 ng·μL-1。
2.2 SuSy基因的克隆
以白及葉片總RNA反轉錄cDNA為模板,以簡并引物對保守區片段進行RT-PCR擴增,得到1個2 215 bp保守片段,編碼737個氨基酸,連接到pGEM-T Easy載體上測序驗證,得到的陽性質粒命名為pGEM-SuSy(圖2)。
2.3 SuSy蛋白親疏水性分析
利用 ProtScale在線分析軟件分析顯示,SuSy蛋白質序列具有較高的親水性,其中第563位氨基酸的親水性最強(2.478),第412位氨基酸的疏水性最強(-2.767)。整體來看,親水性氨基酸均勻分布在整個肽鏈中,且多于疏水性氨基酸,因此整個多肽鏈表現為親水性,可認為該酶是親水性蛋白(圖3)。
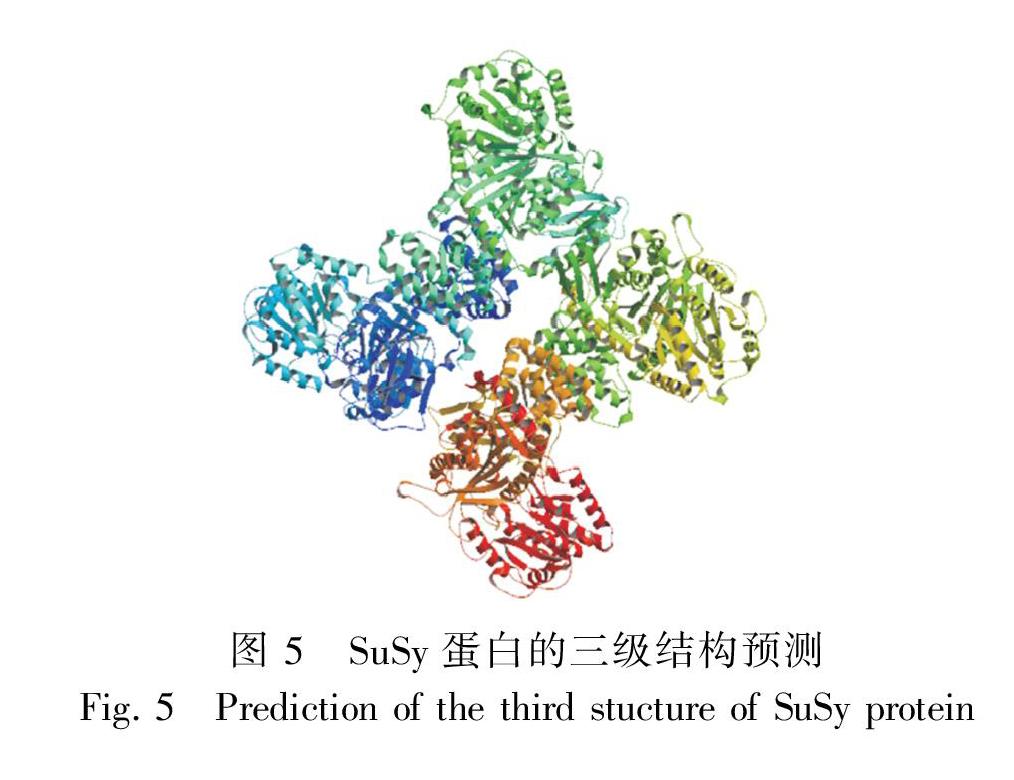
2.4 SuSy蛋白質二級結構和三級結構預測
采用ExPASy網站上的GOR進行蛋白質二級結構預測,結果表明,白及SuSy由39.35%的 α-螺旋(alpha helix)、14.93%的延伸鏈(extended strand)、45.73%的無規則卷曲(random coil)組成(圖4)。圖 2SuSy基因PCR擴增利用SWISS-MODEL軟件分析SuSy氨基酸三級結構,以(3s27.1.A)為模板進行建模,該模板以X-RAY 2.90 方法產生,結果顯示,白及SuSy與擬南芥SuSy蛋白三級結構一致性為75.2%(圖5)。
2.5 SuSy氨基酸序列同源性分析
利用BlastP對SuSy蛋白進行序列同源比對分析,發現白及SuSy在氨基酸水平上與蘭科植物的SuSy蛋白具高度相似性,白及SuSy的氨基酸序列與鐵皮石斛、文心蘭、蝴蝶蘭的相似性分別為97%、92%、95%(圖6)。進一步利用MEGA6.0軟件,采用相鄰連接法構建系統進化樹,根據SuSy氨圖 5SuSy蛋白的三級結構預測基酸序列進行親緣關系分析(圖7),結果顯示,白及SuSy與鐵皮石斛(XP_020697542)處于同一個分支上,和蝴蝶蘭(XP_020583263)的SuSy親緣關系也較近。A、B、C分別代表根、葉和塊莖的不同時期的表達量;a、b、c代表顯著性差異(P<0.001)。
2.6 SuSy基因的表達分析
本試驗根據Real-time PCR的擴增數據,得到SuSy基因各個樣品相對于內參的表達量。將所得數據通過SPSS 17.0(SPSS Inc., Chicago, USA)軟件進行單因素方差分析,SuSy基因在白及的不同組織中均有表達,但有不同的表達水平,SuSy基因在根(P<0.001)、塊莖(P<0.001)中表達量具有極顯著性差異,但在一年生葉和二年生葉(P>0.05)中的表達量無顯著性差異,幼苗葉和一、二年生葉(P<0.001)中表達量具有極顯著性差異。結果顯示,白及幼苗期,根和葉中都有SuSy基因的表達,葉中SuSy基因的表達量高于根;在白及一年生苗中,根、葉和塊莖中都有SuSy基因表達,葉中SuSy基因的表達量高于根和塊莖;在白及二年生苗中,葉中SuSy基因的表達量也最高,根中次之,塊莖中的SuSy基因表達量最少;白及一年生苗塊莖的SuSy基因的表達量高于二年生塊莖的SuSy基因的表達量。在白及葉中成熟葉片的SuSy基因表達量高于未成熟葉片的表達量(圖8)。
3討論與結論
蔗糖是植物體內主要的運輸物質和暫貯物質,蔗糖的合成速率與運輸對植物生長發育及碳水化合物貯藏器官的生物產量影響很大(Klotz & Haagenson, 2008;Persia et al., 2008;Chen et al., 2012)。因此,SuSy活性的高低直接影響多糖的含量及生物產量。本試驗利用同源克隆技術成功克隆了白及SuSy基因序列,該基因長為2 215 bp,編碼737個氨基酸。生物信息學分析結果顯示,SuSy蛋白質二級結構預測結果表明,α螺旋占39.35%,延伸鏈占14.93%,無規則卷曲占45.73%。SuSy蛋白質三級結構預測結果顯示,SuSy蛋白質三級結構與擬南芥的一致性為75.2%。白及SuSy的氨基酸序列與鐵皮石斛、文心蘭、蝴蝶蘭的相似性分別為97%、92%、95%,說明本試驗克隆的SuSy基因可能為蘭科植物SuSy的同源基因。
qRT-PCR結果顯示SuSy基因的表達沒有組織特異性,在白及幼苗、一年生苗和二年生苗的葉、根和塊莖中都有表達,該結果與煙草Ntab0259170和Ntab0259180在葉片發育的整個時期均表達的結論一致(Wang et al., 2015)。SuSy基因在白及葉中的表達具有時間特異性,成熟葉片的表達量高于未成熟葉片的表達量,與柑橘中CitSus5和CitSus6基因主要在果汁囊和成熟葉片中表達的結果一致(Islam et al., 2014)。陳娜等(2013)以花生為試驗材料,通過熒光定量PCR分析了SuSy基因在花生各組織中的表達,結果表明,該基因為組成型表達基因,在葉和根中表達量較高,在花中表達量最低,與白及SuSy基因在葉和根的表達量較高,在塊莖的表達量較低的結果具有一致性。王俊剛等(2017)研究表明甘蔗的SuSy基因差異表達具有時空表達特性,與該試驗的白及葉片中的表達具有時間特異性的結果一致。胡蘿卜(Daucus carota) 中目前發現有2個SuSy 基因,其中一個在花中特異性表達,另一個在莖、根、花以及成熟的種子中都有表達(Duncan et al., 2007)。甜菜(Beta vulgaris) 中的2個SuSy基因在根中都大量表達,而在葉中表達量低(Subbaiah et al., 2006)。甘蔗(Saccharum officinarum ) 中,目前有2個SuSy基因被確定它們的表達水平在節間的不同部位及不同的發育時期有著顯著不同 (Cai et al., 2011),該研究中白及SuSy基因在營養組織中都有表達,在葉中表達量最高,一年生塊莖中的表達量較高。以上研究說明不同植物中不同類型 SuSy 基因的表達具有發育特異性,功能也有特異性。該研究表明SuSy基因可能是影響白及生長發育的主要基因,受生長發育的誘導,可以根據SuSy基因的表達特性指導白及的栽培種植及藥材采收時間。
參考文獻:
CAI G, FALERI C, CASINO CD, et al., 2011. Distribution of callose synthase, cellulose synthase, and sucrose synthase in tobacco pollen tube is controlled in dissimilar ways by actin filaments and microtubules [J]. Plant Physiol, 155(3): 1169-1190.
CHEN AQ, HE S, LI FF, et al., 2012. Analyses of the sucrose synthase gene family in cotton: Structure, phylogeny and expression patterns [J]. BMC Plant Biol, 2012, 12(1):85.
CHEN N, HU DQ, WANG DY, et al., 2013. Expression analysis of the sucrose synthase gene AhSuSy in different tissues and under abiotic stresses in peanut [J]. J Peanut Sci, 42(4): 25-32.? [陳娜, 胡冬青, 王道遠, 等, 2013. 花生中蔗糖合成酶基因AhSuSy在花生中的組織表達及對非生物脅迫響應研 [J]. 花生學, 42(4):25-32.]
DUNCAN KA , HUBER SC, 2007. Sucrose synthase oligome-rization and F-actin association are regulated by sucrose concentration and phosphorylation [J]. Plant Cell Physiol, 48(11):1612-1623.
DUNCAN KA, HARDIN S, HUBER SC, 2006. The three maize sucrose synthase isoforms differ in distribution, localization, and phosphorylation [J]. Plant Cell Physiol, 47(7):959-971.
HIROSET , SCOFIELD GN ,TERAO T, 2008. An expression analysis profile for the entire sucrose synthase gene family in rice [J]. Plant Sci, 174(5):534-543.
ISLAM MZ, HU XM, JIN LF, et al., 2014. Genome-wide identification and expression profile analysis of citrus sucrose synthase genes: Investigation of possible roles in the regulation of sugar accumulation [J]. PLoS ONE, 9(11): e113623.
KLOTZ KL, HAAGENSON DM, 2008.Wounding, anoxia and cold induce sugarbeet sucrose synthase transcriptional changes that are unrelated to protein expression and activity [J]. J Plant Physiol, 165(4):420-434.
LI DM, ZHU GF, CAO JX, et al., 2013. cDNA cloning and sequence analysis of a sucrose synthase gene from Phalaenopsis hybrid [J]. Chin J Trop Crop, 34 (4): 662-668.? [李冬梅, 朱根發, 操君喜, 等, 2013. 蝴蝶蘭蔗糖合成酶基因的 cDNA克隆及其表達分析 [J]. 熱帶作物學報, 34 (4):662-668.]
LUO CL, XU DL, QIAN G, et al., 2018. Bioinformatic analysis of the structure and function of sucrose synthase gene in Bletilla striata [J]. J Zunyi Med Univ, 41(2): 170-175.? [羅才林, 徐德林, 錢剛, 等, 2018. 白及蔗糖合酶基因結構與功能的生物信息學分析 [J]. 遵義醫學院學報, 41(2):170-175.]
MENG HL, DUAN CL, XIAO FH, et al., 2011. Molecular cloning and expression analysis of sucrose synthase gene from Dendrobium officinale [J]. Chin J Chin Mat Med, 36(7):833-837.? [孟衡玲, 段承俐, 蕭鳳回, 等, 2011. 鐵皮石斛蔗糖合成酶基因的克隆及表達分析 [J]. 中國中藥雜志, 36(7):833-837.]
PERSIA D, CAI G, CASINO CD, et al., 2008. Sucrose synthase is associated with the cell wall of tobacco pollen tubes [J]. Plant Physiol, 147(4):1603-1618.
QIAO L, 2012. Preliminary study of the rice sucrose synthase gene family [J]. Jinan: Shandong University: 5-17.? [喬亮, 2012. 水稻蔗糖合成酶基因家族的初步研究 [D]. 濟南:山東大學: 5-17.]
SUBBAIAH CC, PALANIAPPAN A, DUNCAN K,et al., 2006. Mitochondrial localization and putative signaling function of sucrose synthase in maize [J]. J Biol Chem, 281(23):15625-15635.
SUNG SJ, XU DP, BLACK CC, 1989. Identification of actively filling sucrose sinks [J]. Plant Physiol, 89: 1117-1121.
VAUGHN MW, HARRINGTON GN, BUSH DR, 2002. Sucrose-mediated transcriptional regulation of sucrose symporter activity in the phloem? [J]. Proc Natl Acad Sci USA, 99(16): 10876-10880.
WANG JG, ZHAO TT, YANG BP, et al., 2017. Differential expression analysis of sucrose synthase genes in disease-free sugarcane seedlings? [J]. Sugar Crop Chin, 39(4):1-4.? [王俊剛, 趙婷婷, 楊本鵬, 等, 2017. 甘蔗脫毒健康種苗中蔗糖合成酶基因差異表達分析 [J]. 中國糖料, 39(4):1-4.]
WANG LJ, SHI J, WANG YC, 2013. Isolation and expression analysis of sucrose synthase gene cDNA from Lycium barbarum L. [J]. N Hortic, (21): 105-109.? [王麗娟, 石晶, 王彥才, 2013. 枸杞蔗糖合成酶基因cDNA分離及表達分析 [J]. 北方園藝, (21):105-109.]
WANG XQ, ZHENG LL, LIN H, et al., 2017. Grape hexokinases are involved in the expression regulation of sucrose synthase and cell wall invertase-encoding genes by glucose and ABA [J]. Plant Mol Biol, 94(1-2): 61-78.
WANG Z, WEI P, WU MZ, et al., 2015. Analysis of the sucrose synthase gene family in tobacco: Structure, phylogeny, and expression patterns [J]. Planta, 242(1):153-166.
XIAO X, TANG C, FANG Y, et al., 2014. Structure and expression profile of the sucrose synthase gene family in the rubber tree: Indicative of roles in stress response and sucrose utilization in the laticifers [J]. Febs J, 281(1): 291-305.
XU SM, BRILL E, LIEWELLYN DJ, et al., 2012. Overexpression of a potato sucrose synthase gene in cotton accelerates leaf expansion, reduces seed abortion, and enhances fiber production [J]. Mol Plant, 5(2):430-441.
ZHANG DQ, XU BH, YANG XH, et al., 2011. The sucrose synthase gene family in Populus: structure, expression, and evolution [J]. Tree Genet Genome, 7(3): 443-456.
ZHANG J, ARRO J, CHEN Y, et al., 2013. Haplotype analysis of sucrose synthase gene family in three Saccharum species [J]. BMC Genom, 14: 314.
(責任編輯 何永艷)

