中日藥物警戒制度的比較研究
胡歆雅,梁玉清,曾亞莉,伍 洲,梁 毅*
(1 中國藥科大學(xué)國際醫(yī)藥商學(xué)院,南京210000;2 科睿唯安,倫敦 SE18EZ)
藥物警戒是與發(fā)現(xiàn)、評估、理解和預(yù)防各種不良反應(yīng)或與其他任何可能的藥物問題有關(guān)的科學(xué)研究和活動[1]。藥物警戒的目標(biāo)是最大限度地避免藥物對個體患者和人群的有害作用。藥物警戒的研究對象是在藥品正常使用的情況下出現(xiàn)的有害反應(yīng)以及其他與藥品安全相關(guān)的問題,主體內(nèi)容是藥品不良反應(yīng)報告和藥品安全問題。20世紀(jì)60年代,日本腸道感染藥奎諾仿(Vioform,氯碘羥喹)導(dǎo)致嚴(yán)重的急性脊髓視神經(jīng)炎(SMON病)事件,引起日本對藥品安全監(jiān)管的關(guān)注。與歐美國家類似,日本已經(jīng)建立起一套完備的藥物警戒制度,而我國的藥物警戒制度建設(shè)起步相對較晚。本文從法律框架、組織機(jī)構(gòu)、監(jiān)測系統(tǒng)和風(fēng)險管理計(jì)劃四個方面,比較中日藥物警戒制度,為我國藥物警戒制度的建設(shè)提出參考。
1 法律框架
2019年12月1日,《中華人民共和國藥品管理法》(簡稱“新《藥品管理法》”)正式生效。新《藥品管理法》有12章共155條,其中第1章(第12條第2款)規(guī)定國家建立藥物警戒制度,對藥品不良反應(yīng)及其他與用藥有關(guān)的有害反應(yīng)進(jìn)行監(jiān)測、識別、評估和控制;第7章(第77條)規(guī)定藥品上市許可持有人應(yīng)當(dāng)制定藥品上市后風(fēng)險管理計(jì)劃,主動開展藥品上市后研究[2]。此外,2011年,國家發(fā)布《藥品不良反應(yīng)報告和監(jiān)測管理辦法》,規(guī)定不良反應(yīng)的報告、處置、評價和控制等要求。2018年,《關(guān)于藥品上市許可持有人直接報告》進(jìn)一步完善藥品不良反應(yīng)監(jiān)測制度,履行藥品上市許可持有人不良反應(yīng)報告主體責(zé)任。目前,ICH E系列指導(dǎo)原則均處于第5階段,即發(fā)布實(shí)施階段。我國規(guī)定2020年2月12日后受理的新藥上市申請以及2020年5月12日批準(zhǔn)的新藥上市申請將適用ICH E2E藥物警戒計(jì)劃。
2014年11月,日本出臺《藥品和醫(yī)療器械法》(Pharmaceutical and Medical Device Act, PMD Act)取代之前的《藥事法》,成為確保藥品、醫(yī)療器械等質(zhì)量可控性、有效性和安全性的現(xiàn)行法律。該法有17章共91條,其中第11章(第68條第2款至第15款、第68條第24款)和第16章(第80條第2款)規(guī)定了上市前和上市后藥物警戒要求;該法實(shí)施條例第228/20條第1款和第273條第1款規(guī)定了不良反應(yīng)報告的要求。除此之外,2004年,日本將《藥品上市后監(jiān)督管理標(biāo)準(zhǔn)》分為《藥物警戒質(zhì)量管理規(guī)范》(Good Vigilance Practice,GVP)和《藥品上市后研究質(zhì)量管理規(guī)范》(Good Post-Marketing Study Practice,GPSP)[3],其中GVP共17條,規(guī)定與收集評估藥品使用信息有關(guān)的藥品上市后安全管理的標(biāo)準(zhǔn);GPSP共12條,規(guī)定藥品生產(chǎn)和銷售企業(yè)在進(jìn)行上市后監(jiān)督和研究時應(yīng)遵守的要求。2005年,日本落實(shí)ICH E2E藥物警戒計(jì)劃,并將其作為藥品風(fēng)險管理的指導(dǎo)性文件。
2 組織機(jī)構(gòu)
我國藥物警戒的組織機(jī)構(gòu)可分為行政組織和技術(shù)組織兩部分。行政組織即國家藥品監(jiān)督管理局(National Medical Products Administration, NMPA)和地方藥品監(jiān)督管理局;技術(shù)組織即國家藥品評價中心(國家藥品不良反應(yīng)監(jiān)測中心)和34個省級藥品不良反應(yīng)監(jiān)測中心。NMPA設(shè)有9個司。NMPA主要負(fù)責(zé)全國藥品不良反應(yīng)報告和監(jiān)測的管理工作,并組織起草法律法規(guī)及部門規(guī)章草案[4];地方藥品監(jiān)督管理局負(fù)責(zé)行政區(qū)域內(nèi)的藥品不良反應(yīng)監(jiān)測。國家藥品不良反應(yīng)監(jiān)測中心設(shè)有8個部門,負(fù)責(zé)收集和分析藥品不良反應(yīng)報告,指導(dǎo)地方相關(guān)監(jiān)測與上市后安全性評價工作,并運(yùn)作和維護(hù)國家監(jiān)測信息網(wǎng)絡(luò)。
在日本,承擔(dān)藥物警戒工作的機(jī)構(gòu)包括厚生勞動省(Ministry of Health, Labour and Welfare, MHLW)及其下屬機(jī)構(gòu):醫(yī)藥生活衛(wèi)生局(Pharmaceutical Safety and Environmental Health Bureau, PSEHB)和獨(dú)立行政法人醫(yī)藥品醫(yī)療器械局(Pharmaceuticals and Medical Devices Agency, PMDA)。MHLW與PMDA共同協(xié)商,協(xié)調(diào)所有與安全相關(guān)的活動。MHLW設(shè)有11個局。MHLW負(fù)責(zé)日本的藥品監(jiān)管事務(wù)和藥品政策的制定。PSEHB由5個司和1個辦事處組成。PSEHB負(fù)責(zé)臨床研究、批準(zhǔn)審查和上市后安全管理。PMDA由4個部門和28個辦事處組成。PSEHB工作內(nèi)容可分為三大類:一是針對因藥物不良反應(yīng)或生物制品感染引起的健康損害進(jìn)行救濟(jì)補(bǔ)償;二是負(fù)責(zé)收集、評估產(chǎn)品安全報告,并根據(jù)評估結(jié)果提出對應(yīng)的安全措施;三是審查藥品和醫(yī)療器械的上市申請[5]。
3 監(jiān)測系統(tǒng)
我國藥物警戒監(jiān)測系統(tǒng)主要是指國家藥品不良反應(yīng)監(jiān)測系統(tǒng),該系統(tǒng)中的藥品不良反應(yīng)報告與管理由藥品上市許可持有人直接報告不良反應(yīng)監(jiān)測系統(tǒng)、醫(yī)療機(jī)構(gòu)/經(jīng)營企業(yè)報告不良反應(yīng)監(jiān)測系統(tǒng)和監(jiān)測機(jī)構(gòu)不良反應(yīng)管理系統(tǒng)三部分組成。根據(jù)規(guī)定,新的、嚴(yán)重不良反應(yīng)/事件應(yīng)在15日內(nèi)報告,對造成嚴(yán)重人身傷害或死亡的嚴(yán)重不良反應(yīng)/事件應(yīng)立即報告,其他類型的不良反應(yīng)/事件應(yīng)在30日內(nèi)報告;藥品上市許可持有人應(yīng)撰寫和上報定期安全性更新報告(PSUR)和藥物警戒年度報告。2018年,國家藥品不良反應(yīng)監(jiān)測系統(tǒng)收到藥品不良反應(yīng)報告149.9萬份;1999年至2018年,全國藥品不良反應(yīng)監(jiān)測網(wǎng)絡(luò)累計(jì)收到《藥品不良反應(yīng)/事件報告表》1368萬份[6]。我國于1998年成為WHO國際藥物監(jiān)測合作計(jì)劃的正式成員國,向?yàn)跗账_拉監(jiān)測中心(Uppsala Monitoring Centre, UMC)報送不良反應(yīng)監(jiān)測數(shù)據(jù)。在2019年10月,我國與UMC簽署的藥品不良反應(yīng)監(jiān)測工作合作意向草案,將進(jìn)一步提高我國藥物警戒技術(shù)水平。
1979年,日本以法律形式確立“藥品上市后監(jiān)測(post-marketing surveillance, PMS)制度”。PMS制度由藥品不良反應(yīng)和感染收集和報告制度(the ADRs and infections collection and reporting system)、再審查制度(reexamination system)和再評價制度(reevaluation system)組成[7]。目前,日本ADR收集和報告系統(tǒng)由3方構(gòu)成:① 醫(yī)藥企業(yè)向PMDA報告國內(nèi)外發(fā)生的ADR,導(dǎo)致死亡或危及生命的未預(yù)期的藥品不良反應(yīng)在7天內(nèi)報告,導(dǎo)致死亡或危及生命的已知藥品不良反應(yīng)以及其他未預(yù)期的藥品不良反應(yīng)在15天內(nèi)報告,懷疑由未知或不嚴(yán)重的藥品不良反應(yīng)引起的病例應(yīng)定期報告。② 醫(yī)務(wù)人員需要報告除輕微和眾所周知的不良反應(yīng)以外的,與處方藥、非處方藥和醫(yī)療器械等使用相關(guān)的不良反應(yīng),這是一個直接從醫(yī)務(wù)人員收集安全信息的MHLW報告系統(tǒng)。③ 日本自1972年加入WHO國際藥物監(jiān)測合作計(jì)劃,開始向WHO報告藥品不良反應(yīng)信息,并與WHO其他成員國進(jìn)行信息交流。再審查制度通過在批準(zhǔn)上市后的指定時間內(nèi)收集藥品的有效性和安全性信息(如定期安全性更新報告)重新審查藥品的臨床有效性[8]。再評價制度是對包括再審查藥品在內(nèi)的所有上市藥品進(jìn)行重新評價,確保上市藥品的質(zhì)量、有效性和安全性。日本上市后監(jiān)測(PMS)系統(tǒng)見圖1。
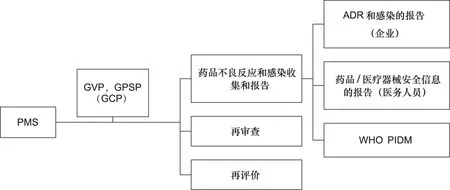
圖1 日本上市后監(jiān)測(PMS)系統(tǒng)
4 風(fēng)險管理計(jì)劃
2017年6月,原國家食品藥品監(jiān)督管理總局正式加入國際人用藥品注冊技術(shù)要求協(xié)調(diào)會(ICH)。此后,我國頒布了多條法律法規(guī)用以督促藥品上市許可持有人對于藥品風(fēng)險的管理,要求其堅(jiān)持風(fēng)險管理的原則,制定風(fēng)險管理計(jì)劃(Risk Management Plan, RMP)。目前,我國還未正式落實(shí)ICH E2E藥物警戒計(jì)劃,但藥品審評中心于2018年發(fā)布的《抗腫瘤藥物上市申請時風(fēng)險管理計(jì)劃撰寫的格式與內(nèi)容要求》可作為RMP的參考。該風(fēng)險管理計(jì)劃包括安全性概述(重要的已識別風(fēng)險、重要的潛在風(fēng)險、重要的缺失信息、需要進(jìn)一步評價的風(fēng)險)、藥物警戒活動(常規(guī)和額外的藥物警戒活動)、上市后有效性研究計(jì)劃、風(fēng)險最小化措施(常規(guī)和額外的風(fēng)險最小化措施)等內(nèi)容[9],目的是確保上市后產(chǎn)品在其說明書中所描述的情況內(nèi)能夠得到令人滿意的獲益風(fēng)險比。
2013年3月,日本將風(fēng)險管理計(jì)劃納入GVP。RMP是根據(jù)研究、評估和降低風(fēng)險工作的進(jìn)展,將一個藥品從研發(fā)到上市后所需的風(fēng)險管理整合成一份易于理解的單一文件[10]。RMP的定義為:① 有關(guān)可疑不良反應(yīng)或所缺少信息的安全性研究;② 上市后ADR收集活動(藥物警戒計(jì)劃);③ 概述如何降低藥品風(fēng)險(風(fēng)險最小化計(jì)劃)的總文件。藥物警戒計(jì)劃和風(fēng)險最小化計(jì)劃包括常規(guī)計(jì)劃和額外計(jì)劃兩種類型,常規(guī)計(jì)劃由醫(yī)藥企業(yè)實(shí)施,包括ADR收集和說明書的提供等,額外計(jì)劃是根據(jù)藥品特性實(shí)施的活動,例如上市后監(jiān)測、療效調(diào)查、上市后臨床試驗(yàn)等。RMP的目的是通過分析收集到的有效性和安全性信息,實(shí)施必要的安全保障措施,降低新藥使用中固有的潛在風(fēng)險,最終實(shí)現(xiàn)新藥的風(fēng)險最小化。日本藥品RMP的基本內(nèi)容見圖2。
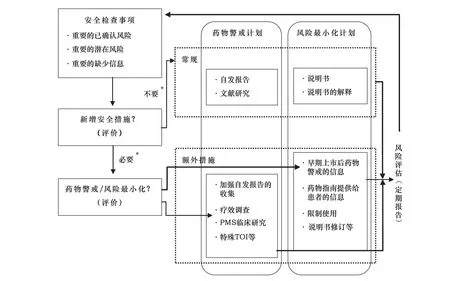
來源:科睿唯安Cortellis全球藥政法規(guī)情報*:是否新增安全措施需要考慮的要點(diǎn)包括:① 預(yù)計(jì)使用患者數(shù)量。② 給藥情況。③ 確定的風(fēng)險組。④ 目標(biāo)病癥的嚴(yán)重性、并發(fā)癥的嚴(yán)重性和發(fā)生率。⑤ 不良反應(yīng)對收益/風(fēng)險比或健康/衛(wèi)生狀況的影響程度。⑥ 嚴(yán)重不良反應(yīng)的程度、頻率、可逆性和可預(yù)防性。⑦ 實(shí)施風(fēng)險最小化活動的預(yù)期效果。⑧ 國外的研制或生產(chǎn)銷售情況。⑨ 與國外安全性配置文件的差異。 在國外調(diào)查和試驗(yàn)的狀況及結(jié)果。 國外采取的安全措施等[11]。
5 中日藥物警戒制度的比較
比較上述中國和日本的藥物警戒制度現(xiàn)狀,可以發(fā)現(xiàn):① 在法律框架方面,我國基本構(gòu)建起了藥物警戒制度的框架,但是與日本相比,缺乏用于指導(dǎo)藥物警戒開展的更為具體的實(shí)施細(xì)則。② 在組織機(jī)構(gòu)方面,由于我國人口眾多、地域遼闊的國情,各機(jī)構(gòu)各司其職;與日本相比,缺乏同級以及上下級機(jī)構(gòu)的溝通協(xié)作,監(jiān)管漏洞相對難以避免。③ 在監(jiān)測系統(tǒng)方面,自加入ICH后,我國藥品不良反應(yīng)報告趨于成熟;但在上市后監(jiān)測方面,尤其是對藥品的有效性和安全性的審查與評價仍有待提高。④ 在風(fēng)險管理計(jì)劃方面,我國和日本均以ICH E2E藥物警戒計(jì)劃為基礎(chǔ),但日本實(shí)施的時間遠(yuǎn)早于中國,我國仍處于磨合階段。
6 對我國藥物警戒制度建設(shè)的建議
6.1 健全我國藥物警戒的法律體系
最近,多項(xiàng)法律法規(guī)的出臺體現(xiàn)了我國對藥物警戒的關(guān)注與重視,但在配套文件無法滿足上位法的方面仍需改進(jìn)。日本在這一方面就處理得很好,PMD Act實(shí)施條例、GVP和GPSP基本能夠滿足藥物警戒的實(shí)踐需要。《關(guān)于藥品上市許可持有人直接報告》是我國對藥物警戒實(shí)踐指南的初步探索,建議我國在此基礎(chǔ)上結(jié)合國情進(jìn)行修訂,出臺正式的藥物警戒實(shí)踐指南,明確藥品上市后安全管理的標(biāo)準(zhǔn)。目前,與新《藥品管理法》配套的實(shí)踐指南仍在修訂中,ICH E2E藥物警戒計(jì)劃還未正式實(shí)施,相信這些文件出臺并落到實(shí)處后,能夠推動我國藥物警戒的法律體系健全和進(jìn)一步完善。
6.2 加強(qiáng)我國藥物警戒組織機(jī)構(gòu)的溝通協(xié)作
日本的PMDA相當(dāng)于我國藥品監(jiān)督管理局下設(shè)的國家藥典委員會、藥品審評中心、藥品評價中心和醫(yī)療器械技術(shù)審評中心,中日兩國的藥監(jiān)機(jī)構(gòu)設(shè)置較為相似。但由于我國人口眾多、信息量大,藥監(jiān)局下設(shè)的機(jī)構(gòu)各司其職,有較大的自主權(quán),機(jī)構(gòu)之間的信息互通較少。藥物警戒是一項(xiàng)涵蓋藥品安全性問題的綜合活動,除了我國藥品評價中心承擔(dān)藥品上市后監(jiān)管關(guān)鍵責(zé)任外,也需要藥品審評中心等其他部門的協(xié)作。建議參考日本,加強(qiáng)我國藥物警戒組織機(jī)構(gòu)在管理藥品安全性問題上的溝通和協(xié)作,實(shí)現(xiàn)藥品全生命周期的藥物警戒。
6.3 完善我國藥物警戒的監(jiān)測系統(tǒng)
藥品安全性監(jiān)測是藥物警戒的核心活動之一。藥品不良反應(yīng)報告制度是藥品進(jìn)入市場后安全性監(jiān)測的主要方式,但并不是唯一方式。Ⅳ期臨床試驗(yàn)、流行病學(xué)研究、處方事件監(jiān)測(PEC)等方法,都可以用于監(jiān)測研究上市后藥品的不良反應(yīng)。因此,建議參考日本的藥品再評價制度,基于我國監(jiān)管現(xiàn)狀,改變監(jiān)測系統(tǒng)單一的問題。同時,加強(qiáng)與WHO的合作交流并與其他成員國互通藥品安全數(shù)據(jù),完善我國監(jiān)測系統(tǒng)的數(shù)據(jù)庫,做到早期發(fā)現(xiàn)、科學(xué)預(yù)判藥品不良反應(yīng)/事件,準(zhǔn)確評價藥品的安全性和有效性。
6.4 推進(jìn)落實(shí)我國風(fēng)險管理計(jì)劃
藥品風(fēng)險管理計(jì)劃根據(jù)已知的藥品安全性信息,為持續(xù)有效地實(shí)施藥物警戒活動,減小風(fēng)險提供了依據(jù)。原則上,企業(yè)應(yīng)針對每一個產(chǎn)品制定風(fēng)險管理計(jì)劃,以實(shí)現(xiàn)藥品風(fēng)險最小化、患者受益最大化。中日兩國的風(fēng)險管理計(jì)劃都以ICH E2E 藥物警戒計(jì)劃為基礎(chǔ),不同點(diǎn)在于日本實(shí)施得更早,內(nèi)容也更加完備。建議我國推進(jìn)落實(shí)風(fēng)險管理計(jì)劃,將其作為藥品上市的必要條件。同時,根據(jù)藥品風(fēng)險的不同,公布不同要求的風(fēng)險管理計(jì)劃模板。對于高風(fēng)險藥品,藥品風(fēng)險管理計(jì)劃應(yīng)有更嚴(yán)格要求。

