GlgC基因種子特異過表達載體的構建及對甘藍型油菜的轉化
趙凱琴,羅延青,俎 峰,王敬喬*,李勁峰,陳 葦,張云云,楊清輝
(1.云南農業大學農學與生物技術學院,云南 昆明 650201;2.云南省農業科學院經濟作物研究所,云南 昆明 650205)
【研究意義】油菜(BrassicanapusL.)是世界上食用植物油的主要來源之一。提高油菜單位面積產量或產油量一直是中國油菜育種重點研究課題。提高油菜品種含油量是提高油菜產油量的最有效方式[1],是提高油菜生產效益的關鍵[2]和油菜育種的主要目標[3]。通過GlgC基因在油菜胚發育前期、中后期表達,以期增加淀粉積累及油脂合成前體物質(果糖)的含量,提高前期胚的生長速度;同時為中、后期胚發育提供最直接的碳源,達到增加種子含油量的目的。【前人研究進展】 AGPase(腺苷二磷酸葡萄糖焦磷酸化酶)是淀粉合成途徑的關鍵限速酶,其催化淀粉合成前體腺苷二磷酸葡萄糖的產生。GlgC是同源四聚體,單基因編碼AGPase。AGPase在細菌和植物及糖原合成中起相似作用[4]。Stark等[5]的研究證明,來源于細菌的AGPase基因GlgC在馬鈴薯球莖中過表達可增加淀粉含量30 %。Sweetlove等[6]通過抑制馬鈴薯AGPase 的活性導致淀粉合成的部分或全部終止。Helence[7]等利用胚特異啟動子降低了AGPase在轉基因油菜中的表達;通過同位素示蹤分析顯示,AGPase活性下降導致淀粉合成效率下降50 %~60 %,淀粉含量下降接近50 %~70 %;同時,通過對種子發育各個時期油含量的分析,AGPase活性下降導致了含油量的下降,特別是在胚發育中期以前,轉基因株系胚含油量比野生型下降50 %以上。目的基因的組織特異性及時空表達對最終產物的作用效果影響極大,如利用組成型的35S啟動子和維管特異啟動子4CL分別過表達蔗糖合酶基因SuSy,前者使楊樹莖干重下降,后者使莖干重上升[8]。因此,啟動子的選擇能直接影響預期結果。【本研究切入點】構建了兩個含特異表達啟動子的GlgC基因種子特異過表達載體,以農桿菌介導法導入甘藍型油菜。【擬解決的關鍵問題】獲得甘藍型油菜轉GlgC基因陽性株,為利用遺傳改良技術實現上述途徑在油菜基因工程育種中的應用提供材料基礎。
1 材料與方法
1.1 材料
1.1.1 受體 甘藍型油菜BrassicanapusL. ‘ westar’(加拿大引進)。
1.1.2 菌種 大腸桿菌(Escherichiacoli)DH5α感受態及根癌農桿菌(Agrobacteriumtumefaciens) LB4404感受態均購于Takara 大連寶生物工程有限公司。
1.1.3 載體 克隆載體pMD18-T Vector 購于Takara 大連寶生物工程有限公司;載體pMB-TG、pMB3-14、pMB-Fad2為本實驗室保存及構建。
1.1.4 分子試劑及化學試劑 所有酶、核酸分子量標準DNA Marker 購于Takara 大連寶生物工程有限公司;化學試劑均為國產分析純。
1.2 方法
1.2.1 擬南芥胚特異啟動子DOF的克隆(At4g21080) 根據Genbank 中已公布的擬南芥早期胚特異啟動子At4g21080(DOF4.5)的核苷酸序列設計引物(表1),以野生型擬南芥基因組DNA為模板,擴增985 bp啟動子片段。PCR程序: 94 ℃,5 min;94 ℃,30 s,55 ℃,1 min,72 ℃,1 min 30 s,35個循環;72 ℃,10 min。將PCR產物連接到PMD18T上,載體命名為pMD18T-DOF。
1.2.2GlgC特異啟動子過表達載體的構建 擬南芥胚特異啟動子DOF+ GlgC突變基因表達載體的構建:①載體pMB-TG上有2個XbaI位點,為下一步的重組克隆要先消除3′端的XbaI位點。用XbaI部分酶切pMB-TG,klenow補平,自連,轉化大腸桿菌DH5自連挑菌落提取質粒進行XbaI單酶切和XbaI+KpnI雙酶切鑒定,酶切結果應為線性和-330 bp片段。將消除3′端的XbaI位點的pMB-TG命名為pMB-TG-XbaI。②連接頭:XbaI單酶切pMB-TG-XbaI,klenow補平,膠回收,去磷酸化,連接PXhoI,轉化大腸桿菌DH5腸桿挑菌落提取質粒進行XhoI+KpnI雙酶切鑒定(-330 bp)。將消除5′端XbaI并連上PXhoI的pMB-TG-XbaI命名為pMB-TG-XhoI。③用SmaI+SalI雙酶切pMD18T-DOF,電泳回收~1.0 kB的擬南芥早期胚特異啟動子At4g21080(DOF4.5)片段插入到經PmeI+XhoI雙酶切的pMB-TG-XhoI并去磷酸化的開環載體上(SmaI和PmeI為平末端;SalI和XhoI為同鏈末端),轉化后鑒定的陽性正向克隆送測序。
種子特異蛋白啟動子Cruc+GlgC突變基因表達載體的構建:將實驗室已構建的含Cruc啟動子的pMB3-14進行SalI酶切,切下Cruc啟動子片段,連接到經過相同酶切,回收載體大片段的pMB-Fad2載體上,命名為pMB-Cruc。XbaI單酶切含~1.6 kBGlgC片段的pMD18T-TG,將目的片段連接到經XbaI 酶切的pMB-Cruc上,轉化大腸桿菌DH5α,鑒定后的陽性正向克隆送測序。
1.2.3GlgC基因表達載體的甘藍型油菜遺傳轉化GlgC基因表達載體的農桿菌轉化:將重組質粒pMB-DOF-TG、pMB-Cruc-TG導入根癌農桿菌LBA4404(采用凍融法)。
農桿菌介導法轉化油菜及抗Kan再生植株篩選:①將轉化受體‘Wester’種子用25 %次氯酸鈉滅菌,在MS培養基中25 ℃暗培養7 d;②挑取農桿菌單克隆,置于相應抗性的10 mL YEP液體培養基,27 ℃震蕩培養(200 r/min)至對數生長期,OD 值0.3備用;③取上述已制備好的農桿菌吸取0.5 mL加入20 mL MS培養基,將幼苗下胚軸切成0.5~1.0 cm 的小段浸入60 min,將下胚軸用濾紙吸干后轉入共培養基培養3 d,25 ℃;④轉入誘導培養基中光照培養14 d;其后在分化培養基中15 d繼代1次,至分化幼苗;再轉入篩選培養5~7 d繼代1次;待幼苗2~3 cm時轉入生根培養(培養基配方參考文獻[9])。
1.2.4 轉化植株的分子生物學鑒定 PCR檢測:PCR直接擴增,以轉基因kan陽性植株葉片為模板。引物為GlgC及NP TⅡ(表1)。PCR程序:98 ℃2 min;98 ℃10 s,60 ℃15 s,68 ℃1 min,40 個循環;68 ℃10 min。PCR產物進行瓊脂糖凝膠水平電泳。
半定量RT-PCR檢測:取經PCR檢測為陽性的轉基因植株葉片100 mg,提取總mRNA。按PrimeScript RT reagent Kit with gDNA Eraser說明書合成 cDNA。內參基因為Brasicanapusactin,擴增引物為BnAc;目的片段AlgC擴增引物為GlgCsq(表1)。PCR程序:94 ℃ 5 min;94 ℃ 40 s,58 ℃ 1 min,72 ℃ 1 min,34個循環;72 ℃ 延伸10 min。PCR產物進行瓊脂糖凝膠水平電泳。

表1 本文所涉及的引物序列

圖1 DOF克隆序列比對

1: M. DL5000 bp;2~5: pMD18T-DOF用EcoRI+SalI酶切1: M DL5000; 2-5: pMD18T-DOF digested by EcoRI+SalI
2 結果與分析
2.1 DOF啟動子的克隆及序列分析
對pMD18T-DOF陽性克隆菌液測序,結果顯示成功獲得DOF基因的克隆(圖1);對pMD18T-DOF質粒進行EcoRI+SalI雙酶切,瓊脂糖電泳得到1025 bp條帶,成功獲得連有DOF啟動子的pMD18T-DOF載體(圖2)。
2.2 特異啟動子GlgC表達載體構建
2.2.1 擬南芥胚特異啟動子DOF(At4g21080)+GlgC突變基因表達載體的構建 對轉化后鑒定的陽性正向克隆進行測序,測序驗證目標序列與pMB-TG-XhoI(去磷酸化)載體融合表達的讀碼框正確。結果顯示成功得到重組質粒pMB-DOF-TG(構建流程見圖3)。
2.2.2 種子特異蛋白啟動子Cruc+GlgC突變基因表達載體的構建 重組載體經SacI+XbaI雙酶切驗證及測序比對,結果顯示成功構建pMB-Cruc-TG載體(圖4)。
2.3 GlgC特異過表達載體在甘藍型油菜中的轉化
通過農桿菌介導將GlgC基因轉入甘藍型油菜中,受體材料為油菜下胚軸,經再生、分化及篩選,共獲得甘藍型油菜kan陽性植株228 株。
2.4 轉化植株的分子生物學鑒定
2.4.1 轉化植株的PCR鑒定 以kan陽性株DNA為模板,PCR產物經瓊脂糖凝膠水平電泳顯示獲得750 bp NPTII及1300 bpGlgC目標條帶。228 株kan抗性轉化株中有202 株為PCR陽性株(圖5~6)。
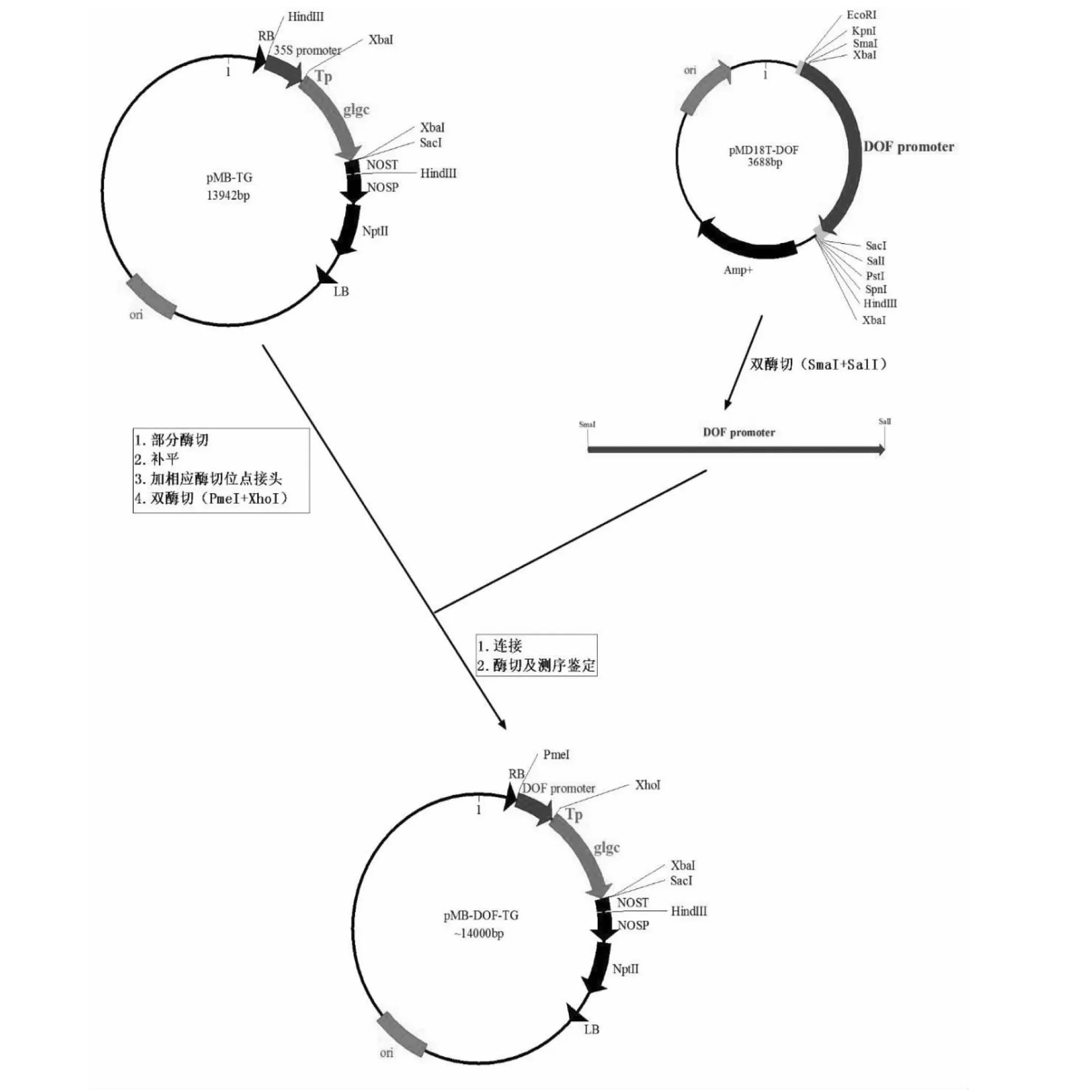
圖3 種子特異過表達載體pMB-DOF-TG構建流程
2.4.2GlgC基因的RT-PCR表達與分析 結果顯示,外源導入的GlgC基因在PCR陽性化株內能夠表達。圖7為部分RT-PCR產物瓊脂糖凝膠電泳結果。
3 討 論
在油菜種子中淀粉與油脂都在質體中進行合成,淀粉的降解可能為油脂的快速合成提供最近的碳源[10]。淀粉合成與環境條件、營養供應密切相關,淀粉在植物生長速度較慢時(如營養物質缺乏,低溫等條件下)積累[11];低溫和長日照均有利于淀粉的合成與積累[12]。同樣,對油菜和擬南芥的研究顯示環境條件對種子油含量也存在相當大的影響[13]。欒運芳等[14]的研究表明,在全國范圍內,西藏種植的油菜含油量最高,與西藏地區晝夜溫差大、日照長的環境條件密切相關。付三雄[15]在對南京(海拔8.9 m)和拉薩(海拔3652 m)2個不同海拔地區種植的甘藍型油菜高油品系H105的研究中發現,該材料含油量在兩地分別為46.04 %±1.42 %和53.09 %±1.35 %,顯示同一品種在西藏種植時含油量更高。這一結果間接表明了淀粉與油脂合成間存在正相關關系。
另外,目的基因的組織特異性及時空表達對最終產物的作用效果影響極大,在過表達研究中,啟動子的選擇能直接影響預期結果。
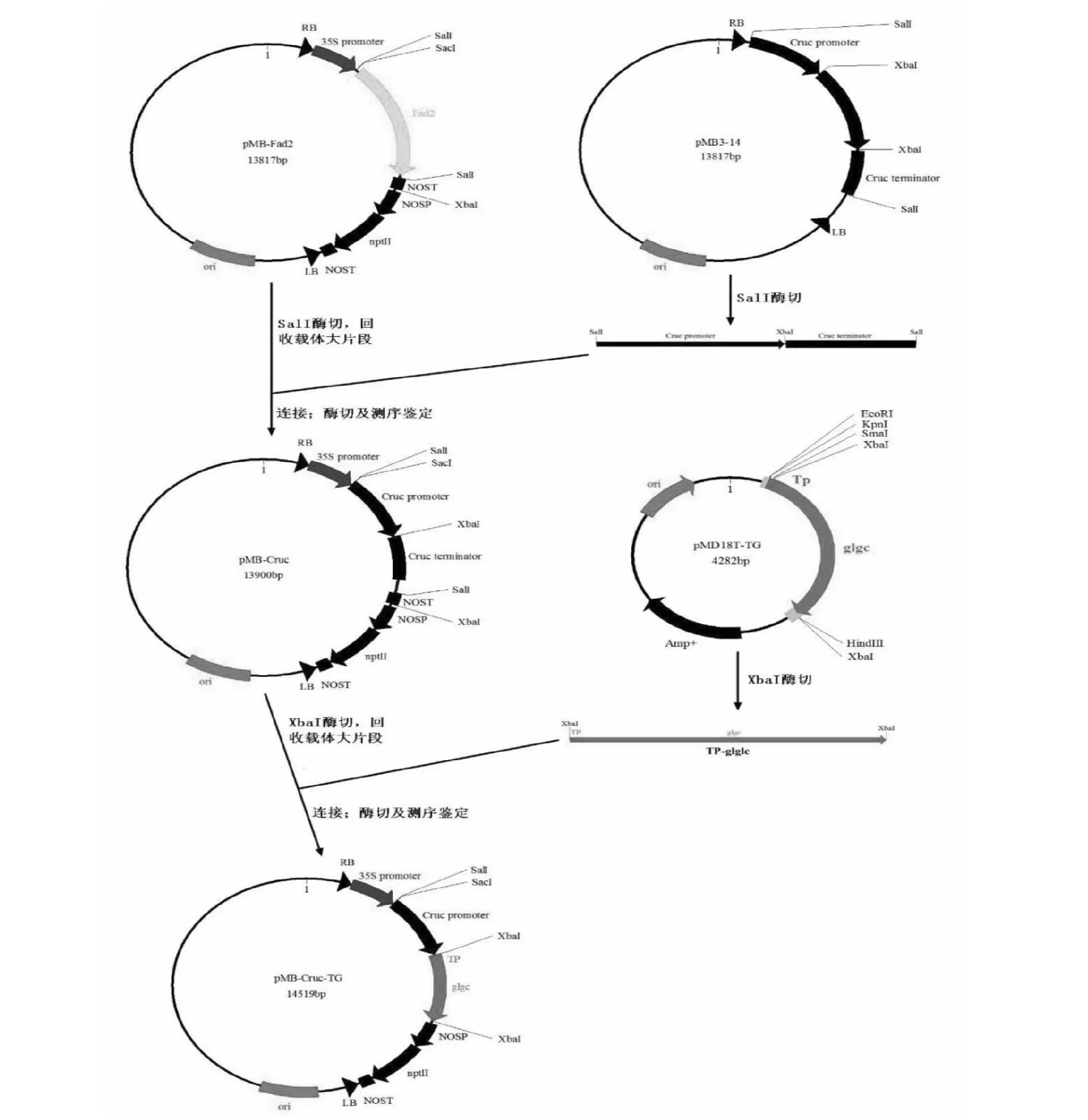
圖4 種子特異過表達載體pMB-Cruc-TG構建流程

1: DL15000(M);2: 陰性對照(非轉基因植株);3: 陽性對照(pMB-DOF-TG);4~25: 轉基因植株1: DL15000(M); 2: Negative control(non-transgenic plants); 3: Positive control(pMB-DOF-TG); 4-25: Transgenic plants

1:DL5000(M);2:陽性對照(pMB-Cruc-TG);3:陰性對照(非轉基因植株);4~25:轉基因植株1: DL5000(M);2: positive control(pMB-Cruc-TG); 3: Negative control(non-transgenic plants); 4-25: Transgenic plants

1:陰性對照;2:陽性對照;3~12:轉基因植株1: Transgenic lines; 2: Positive control; 3-12: Negative control
4 結 論
筆者在前期研究中克隆了淀粉合成途徑的關鍵酶AGPase的大腸桿菌同源基因GlgC并進行了突變,獲得突變體GlgC16基因,降低對無機磷酸鹽敏感性,并進行了質體定位[8]。本研究在油菜AGPase小亞基導肽基因片段與上述GlgC突變基因構建融合基因的基礎上,將GlgC突變基因分別和兩個特異表達啟動子DOF(擬南芥早期胚(球形胚階段)啟動子)、Cruc(油菜種子蛋白啟動子)重組,構建了2個GlgC過表達載體pMB-DOF-TG和pMB-Cruc-TG,轉化農桿菌LBA4404。通過油菜農桿菌轉化體系進行轉化,并驗證了外源導入的GlgC基因在陽性轉基因油菜植株內獲得表達,獲得了甘藍型油菜轉GlgC基因陽性株,為利用遺傳改良技術實現上述途徑在油菜育種中的應用奠定了前期基礎。期望通過GlgC基因的過表達,增加淀粉含量,為胚中油脂的快速合成提供最直接的碳源,達到增加含油量的目的。

