腹腔鏡下卵巢子宮內膜異位囊腫剝除術后用GnRH-a聯合戊酸雌二醇治療子宮內膜異位癥的臨床效果
付 萍
(昆山市第一人民醫院友誼分院,江蘇 昆山 215300)
子宮內膜異位癥(Endometriosis,EMs)指引具有活性內膜組織種植在子宮腔外引起的婦科疾病,該癥以育齡女性為高發群體。EMs病因與遺傳、免疫防御功能缺陷、子宮內膜種植等有關,臨床可見性交痛、月經異常、痛經及不孕等。腹腔鏡手術(即腹腔鏡下卵巢子宮內膜異位囊腫剝除手術)因具有微創特征在EMs得到廣泛應用。相關研究稱,受病灶組織與周圍正常卵巢組織緊密粘連影響,給剝離造成了一定難度,難以徹底切除病灶,術后可能出現復發情況[1]。另外,EMs患者可能存在一些尚未形成,肉眼難以發現的微小病灶,單純腹腔鏡手術并不能徹底根除病灶。術后輔以藥物進行鞏固治療有望進一步提高療效,減少復發。促性腺激素釋放激素激動劑(GnRH-a)有調節垂體分泌促性腺激素作用,抑制子宮內膜生長,但長期使用可能引起骨質丟失和更年期癥狀,降低術后生活質量。戊酸雌二醇是雌激素類藥物,目前多用于更年期綜合征、閉經、性腺功能不良等疾病治療中。本研究用腹腔鏡下卵巢子宮內膜異位囊腫剝除術后聯合GnRH-a聯合戊酸雌二醇治療EMs,通過觀察性激素指標、妊娠率、復發率等指標,以此客觀評估其臨床效果。
1 資料與方法
1.1 一般資料
研究納入2015年6月至2020年6月收治的EMs患者共70例,以隨機法將患者分為2組。觀察組35例,年齡25~46歲,平均(35.52±5.69)歲;病程4個月~5年,平均病程(2.68±0.76)年;美國生育學會(AFS)分期:Ⅲ期19例,IV期16例。對照組35例,年齡26~44歲,平均(35.43±5.62)歲;病程3個月~5年,平均病程(2.80±0.79)年;AFS分期:Ⅲ期20例,IV期15例,兩組EMs患者臨床資料相仿(P>0.05)。
納入標準:(1)符合EMs診斷標準[2];(2)患者均經腹腔鏡下卵巢子宮內膜異位囊腫剝除術治療;(3)患者知情,并簽署知情同意書;(4)獲醫院倫理委員會批準。
排除標準:(1)治療前2個月有激素類藥物治療史或使用過影響激素水平藥物患者;(2)合并子宮內膜癌、乳腺癌;(3)存在人體重要臟器功能障礙,如心、肺、肝、腎等;(4)存在出血傾向。
1.2 治療方法
對照組患者于手術后月經來潮第1天用GnRH-α治療,即醋酸亮丙瑞林(Takeda Pharmaceutical ComPany Limited;國藥準字J20150109;規格:3.75mg)皮下注射,3.75mg/次,每28天注射1次,連續注射6次。觀察組患者加用戊酸雌二醇片(JenaPharm GmbH & Co.KG;國藥準字J20171038;規格:1mg),即在第2次使用醋酸亮丙瑞林后開始口服戊酸雌二醇片,1mg/次,1次/d,連續治療3個月。
1.3 療效評判標準
參照《NOVAK婦科學》[3]中標準評估療效,患者癥狀消失或顯著改善,婦檢包塊消失,月經及排卵恢復評為顯效;癥狀好轉,婦檢可見包塊,月經不規律,排卵尚未恢復正常評為有效;癥狀未緩解,或病情惡化評為無效。總有效率計算:(顯效率+有效率)/n×100%。
1.4 觀察指標
(1)性激素指標:采集患者清晨空腹(>8h)靜脈血3mL,采用放射免疫吸附試驗對患者治療前、治療后4周雌二醇(E2)、黃體生成素(LH)、促卵泡成熟激素(FSH)予以檢測,試劑盒由Roche公司提供。(2)隨訪6個月,對妊娠率、卵巢子宮內膜異位囊腫復發率予以統計。
1.5 統計學分析
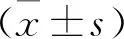
2 結果
2.1 兩組性激素指標
與治療前比較,兩組治療后E2、LH、FSH水平均有所降低,觀察組E2、LH、FSH水平高于對照組(P<0.05),詳見表1。

表1 兩組性激素指標對比
2.2 兩組臨床療效
觀察組總有效率94.29%,與對照組77.14%相比,明顯更高(P<0.05),見表2。

表2 兩組總有效率對比[n(%)]
2.3 兩組妊娠率及復發率
隨訪6個月,觀察組與對照組失訪病例分別為1例、2例,與對照組相比,觀察組妊娠率更高,復發率更低(P<0.05),詳見表3。

表3 兩組妊娠率、復發率對比[n(%)]
3 討論
EMs指子宮內膜組織種植在子宮體外的慢性婦科疾病,近年來發病率逐年升高,而發病年齡逐年降低。EMs作為雌激素依賴性疾病,可引起下腹疼痛、不孕,隨著病情進展,可出現增生、浸潤、轉移等惡性行為,甚至發生組織學改變,引起癌瘤[4]。臨床治療EMs以切除病灶、緩解腹部疼痛、促進妊娠及防止復發為原則。
腹腔鏡手術是治療EMs的常用手段,該方法具備創傷小、出血少、預后佳等優勢。由于EMs患者病灶與正常卵巢粘連,分界不清,增加了分離難度。另外,當患者EMs病灶破裂后,破裂后異位內膜病灶散播后可能會種植在盆腹腔,從而造成病灶組織殘留,增加復發幾率。陳觀美[5]研究指出,腹腔鏡手術治療EMs,術后復發率10%~20%。鑒于此,術后輔以藥物治療有望進一步提高治療效果。
GnRH-a是人工合成短肽化合物,該藥物結構與人體促性腺激素釋放激素結構相似,其可抑制卵巢釋放雌孕激素,形成假絕經,引起內膜萎縮。GnRH-a生物活性較高,是天然GnRH-a10倍,該藥作用機制與天然GnRH-a相似,通過抑制卵巢類固醇激素,下調促性腺素水平,使機體雌激素水平維持在相對低的狀態,對子宮內膜病灶生長產生阻礙作用,誘導病灶萎縮,起到消除微小病灶,預防復發。GnRH-α可直接抑制異位子宮內膜,并促進其凋亡、增殖,同時抑制血管新生。雖然GnRH-α作為EMs腹腔鏡術后預防復發的中藥藥物,王琳[6]研究指出,EMs術后應用GnRH-α治療5年復發率為20%,相較術后未用藥53.4%明顯降低。但GnRH-α通過抑制雌激素分泌所引起的低雌激素狀態、潮熱盜汗、陰道干澀等圍絕經癥狀亦不容忽視。戊酸雌二醇口服后經人體代謝分解為天然E2,能抑制E2分泌。由于皮下注射GnRH-α 3~6周后,性激素水平顯著降低,E2水平持續降低促使子宮內膜進入“冬眠狀態”,此時應用雌激素治療時削弱了異位病灶對E2反應性,可防止子宮內膜重新增殖,從而降低復發風險。
遺傳及環境、免疫功能異常等因素在EMs發病中起到了推動作用,且存在E2、LH、FSH異常[7]。本研究結果顯示,與治療前比較,兩組治療后E2、LH、FSH均降低,且觀察組水平較對照組高,提示腹腔鏡下卵巢子宮內膜異位囊腫剝除術后應用GnRH-α聯合戊酸雌二醇可糾正EMs術后低雌激素情況,促使異位病灶消退。本研究中,觀察組總有效率較對照組高,隨訪6個月,觀察組妊娠率較對照組高,而復發率較對照組低,證實腹腔鏡卵巢子宮內膜異位囊腫剝除術后應用GnRH-a聯合戊酸雌二醇治療EMs療效確切,能促進妊娠,減少復發,其研究結果與汪濤[8]研究相符。分析原因是腹腔鏡手術后應用GnRH-a聯合戊酸雌二醇可促進下丘腦——垂體傳導突出前物質耗竭,經垂體反向調節性激素分泌,一方面抑制病灶種植生長,促使已經形成的病灶發生萎縮退化,增強療效;另一方面,通過糾正患者機體低刺激素狀態,有益妊娠,防止復發。
綜上所述,針對EMs患者治療,在腹腔鏡下卵巢子宮內膜異位囊腫剝除術后應用GnRH-a聯合戊酸雌二醇治療,可糾正患者術后低激素水平,療效確切,提高妊娠率,減少復發。

