雷帕霉素聯合甲霜·噁霉靈對馬鈴薯早疫病菌的抑制效應
呂秀蘭 金良 鄭先喆 張美權 董攀 李正國 任茂智
摘? ?要? ?2018年3—5月,利用菌絲生長速率法,測定雷帕霉素對馬鈴薯早疫病的抑菌活性,雷帕霉素聯合甲霜·噁霉靈的協同效應;并通過透射電鏡及掃描電鏡在超微結構上觀察,揭示雷帕霉素抑制馬鈴薯早疫病的機制。結果表明,雷帕霉素能有效抑制病原菌菌絲生長;雷帕霉素可導致病原菌菌絲節間膨大,細胞隔膜消失,胞內細胞器消失及細胞死亡;雷帕霉素聯合甲霜·噁霉靈具有明顯的協同效應。甲霜·噁霉靈單獨處理時,其IC50藥物濃度約為0.5 mL·L-1;雷帕霉素+甲霜·噁霉靈組合處理時,達到IC50所需要的甲霜·噁霉靈的濃度降低為0.05 mL·L-1。
關鍵詞? ?雷帕霉素;甲霜·噁霉靈;馬鈴薯早疫病菌;抑菌效果;協同作用
中圖分類號:S436.32? ? 文獻標志碼:A? ? DOI:10.19415/j.cnki.1673-890x.2020.7.001
馬鈴薯是世界第三大糧食作物[1]。馬鈴薯早疫病在世界各大馬鈴薯種植區域均有發生,被普遍認為是繼晚疫病后影響馬鈴薯生產的第二大病害[2-3]。馬鈴薯早疫病的病原菌主要有茄鏈格孢菌(Alternaria solani)、鏈格孢菌(Alternaria alternate)、極細鏈格孢菌(Alternaria tenuissima)等[4],其中茄鏈格孢菌是優勢病原菌,歸屬于半知菌綱鏈格孢屬。由于化學農藥防控具有快速、防效穩定和操作簡便等優點,目前仍是防治馬鈴薯早疫病的主要方法[5]。但是長期大量使用化學農藥會導致環境污染、危及人體健康及食品安全等嚴重問題,因此,研發有效、安全及環保的生物農藥是保障馬鈴薯生產,減少環境污染的重要措施之一。
雷帕霉素(Rapamycin,RAP)又名西羅莫司(Sirolimus),是一種大環內酯類免疫抑制劑,主要作用于TOR蛋白激酶(Target of Rapamycin)。TOR蛋白激酶具有高度的保守性,普遍存在于真核細胞中,其突變可誘使細胞死亡[6]。雷帕霉素能與FKBP12蛋白結合形成二元復合物[7],該復合物再與TOR蛋白激酶的FRB結構域結合,從而抑制TOR蛋白激酶的活性。已有研究表明,雷帕霉素對番茄灰霉病菌、油菜菌核病菌及棉花枯萎病菌等表現出極強的抑制活性[8]。但其是否能夠有效抑制馬鈴薯早疫病菌及其與農藥混配是否具有協同效應,目前尚不清楚。
本研究于2018年3—5月在重慶大學虎溪校區生命科學學院任茂智課題組613真菌實驗室進行,目的在于觀察雷帕霉素對馬鈴薯早疫病菌的室內抑制效果,使用透射電鏡及掃描電鏡在超微結構上揭示雷帕霉素抑菌的機制,并聯合甲霜·噁霉靈探索協同抑制效應,以期為安全有效防治馬鈴薯早疫病提供參考。
1 材料與方法
1.1 菌株及藥劑
馬鈴薯早疫病菌NDL及NBF-5小種由北京北納創聯生物技術研究院提供,該菌株保存在本實驗室。將早疫病菌NDL及NBF-5小種接種于PDA培養基上,于25 ℃黑暗條件下培養。
雷帕霉素,美國Selleck Chemicals公司生產;甲霜·噁霉靈,飛翔農資有限公司;馬鈴薯葡萄糖瓊脂培養基(Potato Dextrose Agar,PDA),北京索萊寶公司。
1.2 雷帕霉素處理早疫病菌
雷帕霉素處理早疫病菌的濃度參照用雷帕霉素處理番茄灰霉病菌、油菜菌核病菌等4種植物病原真菌[8]的方法,設置濃度梯度為1、10和50 nmol·L-1。
固體PDA培養基中添加了DMSO(Dimethyl sulfoxide,作為溶劑對照)及前述不同濃度的雷帕霉素。然后,將直徑為7 mm的NDL及NBF-5菌塊接種于上述PDA培養基上。25 ℃黑暗條件下培養8 d后,測量DMSO對照組及雷帕霉素處理組的菌落直徑。數據利用Students t-test和標準差進行統計分析。上述試驗每個處理重復3次。
1.3 透射電鏡及掃描電鏡觀察
早疫病菌絲接種于PDA液體培養基中,震蕩培養5 d,形成菌絲小球。然后將菌絲小球接種于DMSO對照組及雷帕霉素處理組(20 μmol·L-1)的PDA液體培養基中,25 ℃黑暗培養5 d。5 d后收集菌絲小球,送至重慶醫科大學電鏡室制片并觀察。
1.4 農藥甲霜·噁霉靈處理早疫病菌
甲霜·噁霉靈處理早疫病菌的體積濃度參照其使用說明書,設置濃度梯度為0.05 mL·L-1、0.5 mL·L-1和1 mL·L-1。
固體PDA培養基中添加了DMSO(溶劑對照)及前述不同濃度的甲霜·噁霉靈。然后,將直徑為7 mm的NDL及NBF-5菌塊接種于上述PDA培養基上。25 ℃黑暗條件下培養8 d后,測量DMSO對照組及甲霜·噁霉靈處理組的菌落直徑。數據利用Students t-test和標準差進行統計分析。上述試驗每個處理重復3次。
1.5 雷帕霉素+甲霜·噁霉靈組合用藥處理早疫病菌
將雷帕霉素和甲霜·噁霉靈按不同濃度分別兩兩組合來處理早疫病菌,得到9種組合。組合用藥時,“雷帕霉素(nmol·L-1)+甲霜·噁霉靈(mL·L-1)”的濃度分別為:“1+0.05”“1+0.5”“1+1”“10+0.05”“10+0.5”“10+1”“50 +0.05”“50+0.5”和“50+1”。將兩種菌株NDL及NBF-5接種于上述濃度組合固體培養基中,黑暗培養8 d后觀察記載菌落直徑。采用CompuSyn軟件計算CI(Combination index)值[9],藥物相互作用關系分別如下:CI<1(協同作用)、CI=1(累加作用)及CI>1(拮抗作用)。
2 結果與分析
2.1 雷帕霉素對早疫病菌的抑制效應
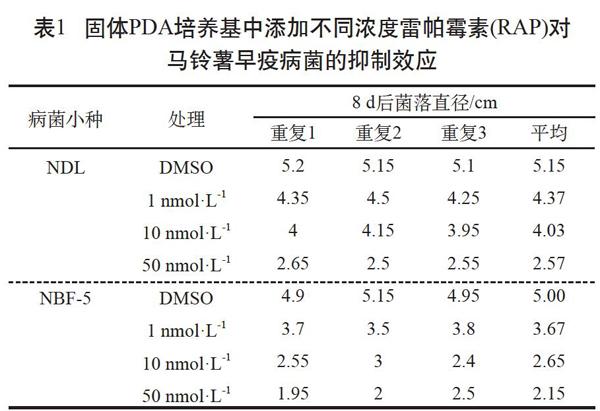
由表1可見,當用雷帕霉素處理早疫病菌菌株NDL時,菌落生長受到顯著抑制且呈劑量依賴效應,在以菌株NBF-5為研究對象時也得到相似的結果。
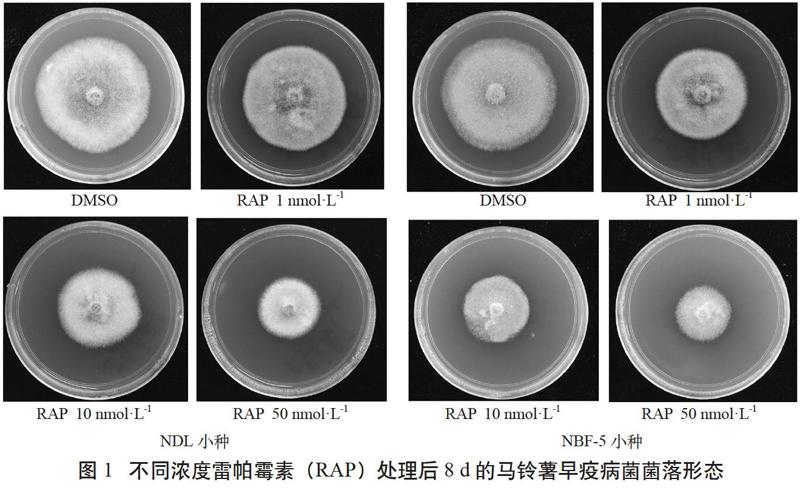
由圖1可見,雷帕霉素抑制NDL的IC50值(50%抑制率的濃度)約為50 nmol·L-1,抑制NBF-5的IC50值約為10 nmol·L-1。
2.2 雷帕霉素對早疫病菌超微結構的影響
為揭示雷帕霉素抑制早疫病菌的作用機制,本研究使用掃描電鏡及透射電鏡分析雷帕霉素對該病原菌NDL及NBF-5兩小種超微結構的影響。
據圖2掃描電鏡觀察結果顯示:與對照相比,經過雷帕霉素處理的早疫病菌NDL及NBF-5兩小種,菌絲節間膨大,隔間距縮短,這可阻礙菌絲延伸[10]。
據圖3透射電鏡觀察結果顯示:1)與空白對照組及DMSO對照組相比,用雷帕霉素處理早疫病菌NDL真菌菌絲后,其細胞產生空腔,細胞呈壞死狀態;2)細胞內脂滴減少;3)細胞間隔膜發生斷裂。在以NBF-5為研究對象時也獲得相似結果,即細胞隔膜破裂,細胞空腔增大、壞死等。脂滴在病原菌的各種生理過程中發揮著重要作用,例如,推動細胞生長及病原菌的侵染等[11-14]。雷帕霉素導致細胞內空腔增多且脂滴減少,這可能會致使早疫病菌生長受到抑制及致病力減弱。并且,細胞隔膜在細胞分裂及增殖中作用顯著,雷帕霉素可通過破壞細胞隔膜抑制細胞分裂增殖,起到抑菌作用。掃描電鏡與透射電鏡觀察結果表明,雷帕霉素可通過破壞病原菌的超微結構起到抑菌作用。
2.3 甲霜·噁霉靈對早疫病菌的抑制效應
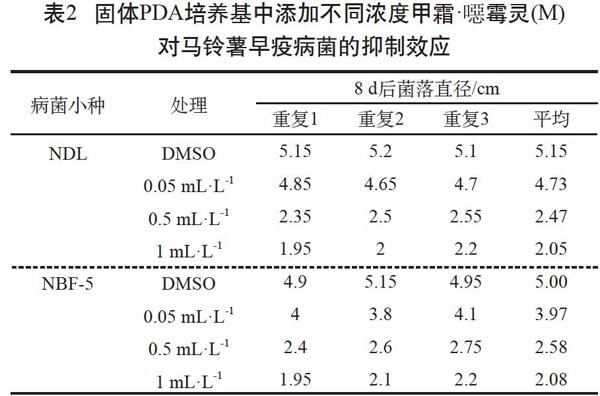
由表2可見,用甲霜·噁霉靈處理早疫病菌株NDL時,隨著甲霜·噁霉靈濃度的增加,真菌菌絲生長受到明顯抑制。甲霜·噁霉靈抑制NDL和NBF-5的IC50值皆約為0.5 mL·L-1。因此,甲霜·噁霉靈可有效抑制早疫病菌且呈現出劑量依賴效應。
2.4 雷帕霉素+甲霜·噁霉靈組合用藥對早疫病菌的協同抑制效應
為探索雷帕霉素與農藥聯用是否具有協同作用,本研究以甲霜·噁霉靈為農藥代表進行相關試驗。試驗結果發現,當雷帕霉素處理濃度為1~50 nmol·L-1與甲霜·噁霉靈處理濃度為0.05~1.00 mL·L-1組合處理馬鈴薯早疫病菌株NDL時,雙藥組合處理NDL的菌落直徑明顯小于單藥處理的菌落直徑,說明雙藥藥效大于單藥藥效(見表3)。如使用雷帕霉素1 nmol·L-1+甲霜·噁霉靈0.05 mL·L-1組合處理NDL的菌落直徑,明顯小于雷帕霉素1 nmol·L-1(見表1)或甲霜·噁霉靈0.05 mL·L-1單獨處理時的菌落直徑(見表2)。其中,雷帕霉素抑菌的IC50值是50 nmol·L-1,甲霜·噁霉靈的IC50值是0.5 mL·L-1,兩種藥物組合后的IC50值是50 nmol·L-1+0.05 mL·L-1,即雙藥組合降低了甲霜·噁霉靈使用量9倍。進一步,根據CompuSyn軟件計算得到CI<1,說明這兩種藥物之間存在協同效應。在以早疫病NBF-5為研究對象時也得出相似的結論。
以上試驗結果說明,與單藥相比,雙藥聯用增強了藥效且降低了藥物用量。
3 小結與討論
雷帕霉素為TOR蛋白激酶的第一代抑制劑,雷帕霉素與FKBP12形成的復合體作用于TOR蛋白激酶的FRB結構域[7],從而抑制其活性。已有研究發現,雷帕霉素可導致小麥赤霉病菌菌絲膨大扭曲,細胞超微結構發生變化,對小麥赤病菌具有明顯抗菌活性[15]。本研究以馬鈴薯早疫病菌的兩個小種為研究對象,探索了雷帕霉素對早疫病的抑菌效果,發現雷帕霉素能夠有效抑制早疫病菌生長;通過透射電鏡及掃描電鏡揭示雷帕霉素可導致菌絲節間膨大,胞內空腔增多及隔膜破裂等,這些超微結構的明顯改變都可導致菌絲生長受阻,達到抑菌效果。
協同作用又稱增效作用,是指兩種或兩種以上藥物聯合使用時,藥效增強。在臨床醫學中,藥物協同作用的原理被廣泛應用,如:Aplidin與阿糖胞苷可聯合協同治療白血病[16],大黃素與姜黃素聯用協同抑制肝癌細胞生長[17]。同時,一些復合型農藥制劑也應用了藥物協同作用的原理,如:聯合使用氟吡菌胺和霜霉威鹽酸鹽組成的銀法利可有效防治致病疫霉[18]。兩種抗真菌藥物聯合使用,從而產生協同抑菌作用,有效減少藥量且大幅度增強藥效,是一種簡單易行的防治病害的策略。本研究發現,當雷帕霉素與化學農藥甲霜·噁霉靈聯用時,可有效增強對馬鈴薯早疫病菌的抑制作用且降低藥物使用量,即具有明顯的協同效應。
參考文獻:
[1] 徐建飛,金黎平.馬鈴薯遺傳育種研究:現狀與展望[J].中國農業科學,2017,50(6):990-1015.
[2] 周岱超.馬鈴薯早疫病季節流行動態及病原菌侵染關鍵天氣條件[D].保定:河北農業大學,2014.
[3] Harrison M D, Venette J R. Chemical control of potato early blight and its effect on potato yield[J]. American Potato Journal, 1970, 47(3): 81-86.
[4] 李雅南,Shah S R A,孫少慧,等.黑龍江省馬鈴薯葉斑類病害Alternaria屬病原組成和分布[J].分子植物育種,2017(3):303-309.
[5] 鄭寰宇.馬鈴薯早疫病菌生物學特性及致病力分化的研究[D].大慶:黑龍江八一農墾大學,2010.
[6] Harrison D E, Strong R, Sharp Z D, et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice[J]. Nature, 2009, 460(7253): 350-356.
[7] Dolinski K, Scholz, C, Muir, R S, et al. Functions of FKBP12 and Mitochondrial Cyclophilin Active Site Residues In Vitro and In Vivo in Saccharomyces cerevisiae[J]. Molecular Biology of the Cell, 1997, 8(11): 2267-2280.
[8] 王彥,徐曦,張立欽,等.雷帕霉素對4種植物病原真菌的抑菌活性[J].農藥學學報,2016,18(3):393-396.
[9] Chou T C, Talalay P. Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors[J]. Advances in Enzyme Regulation, 1984, 22: 27-55.
[10] Zhao C, Waalwijk C, De Wit PJGM, et al. EBR1, a novel Zn 2 Cys 6 transcription factor, effects virulence and apical dominance of the hyphal tip in Fusarium graminearum[J]. Mol Plant-Microbe Interact, 2011, 24(12): 1407-1418.
[11] Bago B, Zipfel W, Williams R M, et al. Translocation and utilization of fungal storage lipid in the arbuscular mycorrhizal symbiosis[J]. Plant Physiol, 2002, 128(1): 108-124.
[12] Kobae Y, Gutjahr C, Paszkowski U, et al. Lipid droplets of arbuscular mycorrhizal fungi emerge in concert with arbuscule collapse[J]. Plant Cell Physiol, 2014, 55(11): 1945-1953.
[13] Radulovic M, Knittelfeldero, Cristobal-Sarramian A, et al. The emergence of lipid droplets in yeast: current status and experimental approaches[J]. Curr Genet, 2013, 59(4): 231-242.
[14] Stehr M, Elamin A A, Singh M. Cytosolic lipid inclusions formed during infection by viral and bacterial pathogens[J]. Microb Infect, 2012, 14(13): 1227-1237.
[15] Yu F, Gu Q, Yun Y, et al. The TOR signaling pathway regulates vegetative development and virulence in Fusarium graminearum[J]. New Phytologist, 2014, 203(1): 219-232.
[16] Jia J, Zhu F, Ma X, et al. Mechanisms of drug combinations: interaction and network perspectives[J]. Nat Rev Drug Discov, 2009, 8(2): 111-128.
[17] 雷湘,李娟,陳科力.大黃素與姜黃素聯用對肝癌細胞BEL-7402生長抑制的協同作用[J].中國醫院藥學雜志,2009,29(12):971-973.
[18] Samoucha Y, Hugelshofer U, Gisi U. Effects of disease intensity and application type on efficacy and synergy of fungicide mixtures against Phytophthora infestans[J]. J Phytopathol, 2010, 120(1): 44-52.
(責任編輯:丁志祥)
收稿日期:2019-12-29
基金項目:政府間國際科技創新合作重點專項(National key R&D program of China)(2017YFE0115500);重慶市基礎研究與前沿探索專項(cstc2018jcyjAX0753);國家自然科學基金項目(31972469);成都農業科技中心地方財政專項(NASC2019TI13);中央科研單位基本科研業務費項目(19-001-09);重慶市科技攻關項目(cstc2015SHMS-ZTZX80003);中央高校基本科研業務費研究生科研創新項目(2018CDYJSY0055)。
作者簡介:呂秀蘭(1993—),女,湖北恩施人,重慶大學生命科學學院生物學專業2017級在讀碩士研究生,研究方向為植物病理學。E-mail: 1392814143@qq.com。※為通信作者,E-mail: renmaozhi01@caas.cn。

