利用CRISPR/Cas9技術對水稻香味品質進行遺傳改良
周俊飛,高利芬,汪偉航,陳利紅,方治偉,李 論,李甜甜,彭 海
(江漢大學 系統生物學研究院,湖北 武漢 430056)
水稻是人類賴以生存的主要糧食作物之一,稻米品質一直備受水稻育種家的關注,也是水稻品種改良的主要方向,其中香味是最受消費者歡迎的一個重要蒸煮品質。稻米的香味主要來源于一類揮發性物質-2-乙酰基-1-吡咯啉(2-acetyl-1-pyrroline, 2AP)[1],因此2AP含量成為衡量稻米香味的重要指標。研究表明,當甜菜醛脫氫酶基因Badh2功能缺失時,合成2AP的前體物質氨基丁醛積累,并轉化成吡咯啉,與乙酰基團結合形成2-乙酰基-吡咯啉,從而使2AP含量增多[2-3]。因此,可通過對Badh2基因進行遺傳改造,實現對水稻香味品質的遺傳改良。
傳統的雜交育種方法改良水稻的香味品質需要數年的雜交選育,而且選育過程中不可避免地會引入其他非目的性狀,耗時費力。基因編輯技術的興起和不斷發展,為香稻育種提供了新途徑,使得定向編輯基因、快速獲得具有理想性狀的品種成為可能。近年來,最主要的基因編輯技術包括人工介導的鋅指核酸酶技術(Zinc finger nucleases, ZFNs)[4]、類轉錄激活因子效應核酸酶技術(Transcription activator-like effectors nucleases, TALENs)[5]和規律成簇的間隔回文重復相關蛋白技術(CRISPR/Cas9)[6-7],其中CRISPR/Cas9技術具有靈活高效的特點,成為最受歡迎的基因編輯工具,發展最為迅速,應用范圍最廣。高彩霞課題組利用TALEN技術成功獲得badh2突變體,突變體的香味物質含量明顯提高[8]。然而TALEN技術在構建載體時過程較為繁雜,需要將多個重復單元進行克隆并串聯起來,構建難度大,成本高。因此,邵高能等[9]利用CRISPR/Cas9系統對Badh2基因進行編輯,也成功獲得香味物質提高的突變體材料。目前所知,香稻的badh2基因突變類型有2種,一種是在第2個外顯子上存在7 bp的堿基缺失,另一種是在第7個外顯子上缺失8 bp,這2種堿基缺失均會造成移碼突變,使Badh2不表達,功能缺失[10-11]。以上研究表明,通過對Badh2基因進行靶向編輯以改良水稻的香味品質是切實可行的。
超級稻品種龍粳31是由黑龍江省農業科學院育成,具有早熟、高產、抗稻瘟病、抗倒伏、耐寒等諸多優良性狀[12-13],因其綜合性狀表現突出,近年來成為黑龍江省種植面積最大的水稻品種,但沒有明顯的香味,食味品質有提升空間。
本研究利用CRISPR/Cas9基因編輯系統,對龍粳31品種的Badh2基因進行靶向編輯,在T1選育出純合的、無轉基因序列遺留且香味品質明顯改良的香稻株系,創制具有香味的龍粳31品種,不僅提高了龍粳31的食味品質,也為香稻品種育種提供了很好的育種材料,本研究具有非常重要的現實意義和經濟價值。
1 材料和方法
1.1 植物材料
水稻轉化受體材料是超級稻品種龍粳31,受體材料種植于湖北省武漢市實驗基地,與武漢地區的早稻種植時間一致,常規田間種植管理。
1.2 載體構建和遺傳轉化
根據水稻基因組注釋網址(http://rice.plantbiology.msu.edu/)提供的Badh2基因(登錄號LOC_Os08g32870)序列信息,設計sgRNA-E2和sgRNA-E32個靶位點,靶位點sgRNA-E2跨Badh2基因的第2個內含子和第2個外顯子(20380166-20380188),靶位點sgRNA-E3位于第3外顯子(20381374-20381396)(圖1),靶序列長20 bp,其后面是PAM序列(Protospacer adjacent motif)NGG,2個靶位點均位于現有香稻品種突變位置的上游,使獲得有效突變的概率更大。載體構建參照Gao等[14]的方法,簡述如下:以含U6表達框的載體pCXUN-Cas9/U6為模板進行2輪PCR擴增,第1輪用引物對sgRNA-E2-F和OsU6-R進行擴增,第2輪用sgRNA-E2-R和OsU6-F進行擴增;將2輪PCR擴增產物混合,以OsU6-F和OsU6-R為引物進行擴增,擴增產物連接到用KpnⅠ酶切后的pCXUN-Cas9載體骨架上,獲得最終的表達載體pCXUN-Cas9-E2。sgRNA-E3的表達載體pCXUN-Cas9-E3構建方法同pCXUN-Cas9-E2。通過酶切和測序確定表達載體是否構建成功。將正確的表達載體轉化農桿菌EHA105。植物受體材料的遺傳轉化由杭州百格生物技術有限公司完成。
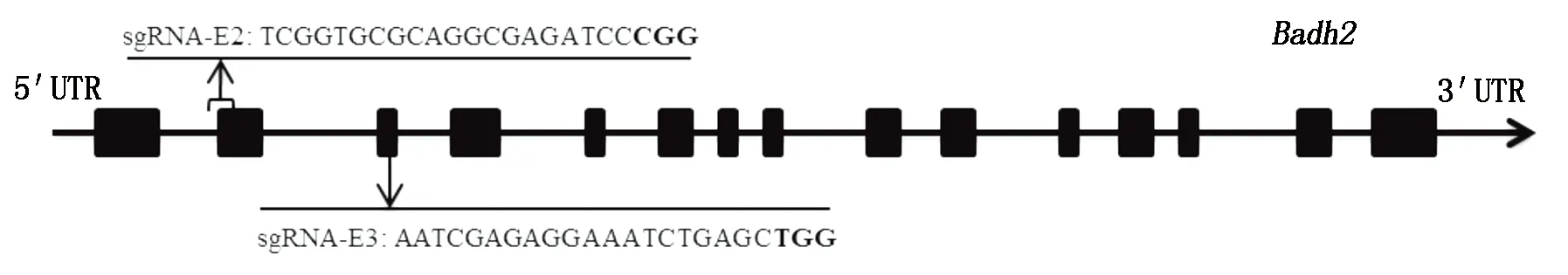
圖1 2個靶位點在Badh2基因上的位置Fig.1 Positions of the two target sites of the gRNA in Badh2
1.3 轉基因陽性水稻株系檢測及突變植株的篩選
用CTAB法提取野生型龍粳31和轉基因T0植株葉片的基因組DNA,用潮霉素引物Hpt-F/Hpt-R(表1)進行PCR擴增,鑒定轉基因陽性單株。
在2個gRNA的靶位點上下游分別設計引物GPE2-F/GPE2-R和GPE3-F/GPE3-R(表1),對2個靶位點分別進行PCR擴增,擴增產物連接到pEASY-T載體后,每個單株選10個單克隆用M13F通用引物進行Sanger測序。突變體和野生型的測序結果用MEGA 6軟件進行序列比對。
1.4 突變體中Badh2基因表達情況
針對水稻Badh2基因的CDS序列,用在線引物設計工具Primer-Blast(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)設計熒光定量PCR引物QBadh2-F/QBadh2-R(表1)。用TRIzol法提取野生型和突變株系成熟植株葉片的總RNA,用DNase Ⅰ消化總RNA中殘留的DNA之后,以Oligo(dT)18為引物,按照M-MuLV反轉錄酶(NEB,英國)的使用說明書反轉錄為cDNA。用SYRB GREEN方法對Badh2在野生型和突變體中的表達進行相對定量,以水稻Ubiquitin基因作為內參基因,用TransStart?TipTop Green qPCR SuperMix reagent(全式金,北京)進行qRT-PCR反應,qPCR儀為ABI StepOne Plus。數據處理采用2-ΔΔCT法計算基因的相對表達量[15]。用Student′st-test方法計算Badh2基因在野生型和突變體中表達的差異顯著性。

表1 所用引物列表Tab.1 List of primers used in this study
1.5 香味物質測定
用氣相色譜-質譜聯用(GC-MS)技術測定香稻特征化合物2-乙酰-1-吡咯啉(2AP)的含量。方法參照Bergman等[16],用2AP和2,4,6-三甲基吡啶(2,4,6-trimethylpyridine, TMP)制作標準曲線。取2 g T1水稻種子脫殼,研磨成粉末置于頂空瓶中,加入TMP作為內標物,在Agilent 7890氣相色譜質譜聯用儀上檢測。色譜柱為HP-INNOWax(32 m×250 μm×0.25 μm),色譜及質譜條件參照應興華等[17],檢測工作由上海百趣生物醫學科技有限公司完成。
1.6 轉基因T1突變體農藝性狀調查
龍粳31是超級稻品種,在改良稻米香味的同時,不能破壞該品種原有的優良性狀。因此,統計并分析了T0突變單株的自交后代群體的基本農藝性狀,株高、有效分蘗數和千粒質量。每個株系選10個單株,測量株高,記錄有效分蘗數、千粒質量的計算方式是隨機選取300粒飽滿的種子稱質量,然后換算成千粒質量。
1.7 無轉基因序列的突變株鑒定
對6個突變株系的T1單株用引物Hpt-F/Hpt-R和Cas9-F/Cas9-R(表1)進行PCR擴增,2對引物都不能擴增出載體目的片段的植株為無轉基因序列的突變株。同時用靶位點擴增引物GPE2-F/GPE2-R和GPE3-F/GPE3-R(表1)檢測T1植株的突變情況。
所有結果用Graphpad軟件進行統計分析。
2 結果與分析
2.1 突變體的獲得及靶位點突變類型分析
提取轉基因植株葉片的基因組DNA,用潮霉素特異引物檢測T0轉基因植株,2個轉化載體pCXUN-Cas9-E2和pCXUN-Cas9-E3分別獲得轉基因陽性單株7,4株(圖2-A)。
進一步對轉基因陽性植株的突變類型進行分析,現有報道將CRISPR/Cas9技術獲得的突變體分為三類:純合突變、復雜雜合突變和雙等位突變[18]。結果發現(圖2-B),在轉基因T0獲得2個純合突變株badh2-E2-6和badh2-E2-11,4個雙等位突變株badh2-E2-9、badh2-E2-13、badh2-E3-6和badh2-E3-14,這些株系的突變類型包括堿基缺失堿基插入、堿基突變。所有的突變均出現在gRNA區間,純合突變株badh2-E2-6缺失7 bp,badh2-E2-11株插入8 bp;雙等位突變株badh2-E2-9缺失7,2 bp,badh2-E3-6株插入1 bp(A/T),badh2-E3-14株缺失1 bp和插入1 bp。其中,badh2-E2-13出現不同程度的大片段缺失,在靶位點上下游分別缺失64,108 bp。

A.潮霉素基因PCR檢測;B.T0突變位點序列分析。M.Marker DL2000;P.質粒;WT.野生型;E2-6、E2-9、E2-11、E2-13、E3-6、E3-14.Badh2的突變體。黑色粗體大寫字母為靶位點序列,帶下劃線的字母為PAM序列;加粗小寫字母.堿基插入或突變;-.堿基缺失。Ho.純合突變;di.雙等位突變。圖3-4同。
A.PCR detectingHpt; B.Sequence analysis of T0mutation sites.M. Marker DL2000; P.Plasmid; WT.Wild type;E2-6,E2-9,E2-11,E2-13,E3-6,E3-14.Indicates mutant ofBadh2. The target site is shown in bold capital letters; The underlined letter is the PAM sequence; Bold lowercase letter.Base insertion or mutation; Bolddashes.Deleted base. Ho.Homozygote; di.Di-allelic mutations.The same as Fig.3-4.
圖2 T0突變位點序列分析
Fig.2 Sequence analysis of T0mutation sites
2.2 突變體中Badh2基因的表達量顯著降低
基因組水平上Badh2基因的突變體在靶位點處發生了堿基變化,為了檢測這種變化在轉錄水平上是否延續,進一步檢測了Badh2基因在突變體和野生型植株的表達情況。實時熒光定量PCR結果顯示(圖3-A):在突變體中,Badh2基因的表達量相對野生型顯著下調。其中在badh2-E2-6、badh2-E2-9、badh2-E2-11、badh2-E2-13、badh2-E3-6和badh2-E3-14的表達相比野生型差異顯著(P<0.05),表明2個靶點的突變能顯著降低Badh2基因的表達。
2.3 香味物質含量的測定
利用氣相質譜聯用的方法測定部分突變體的香味物質2AP含量,結果發現(圖3-B),這些突變體的2AP濃度在0.032~0.098 mg/kg,badh2-E2-6、badh2-E2-9、badh2-E2-11、badh2-E2-13、badh2-E3-6這5個株系較野生型差異顯著(P<0.05),與應興華等[17]測定的結果相符。其中,突變體badh2-E2-13相比野生型2AP的含量提高了4倍,相比對照香稻品種信香粳1號提高了1倍,顯著提高了香味物質的含量。
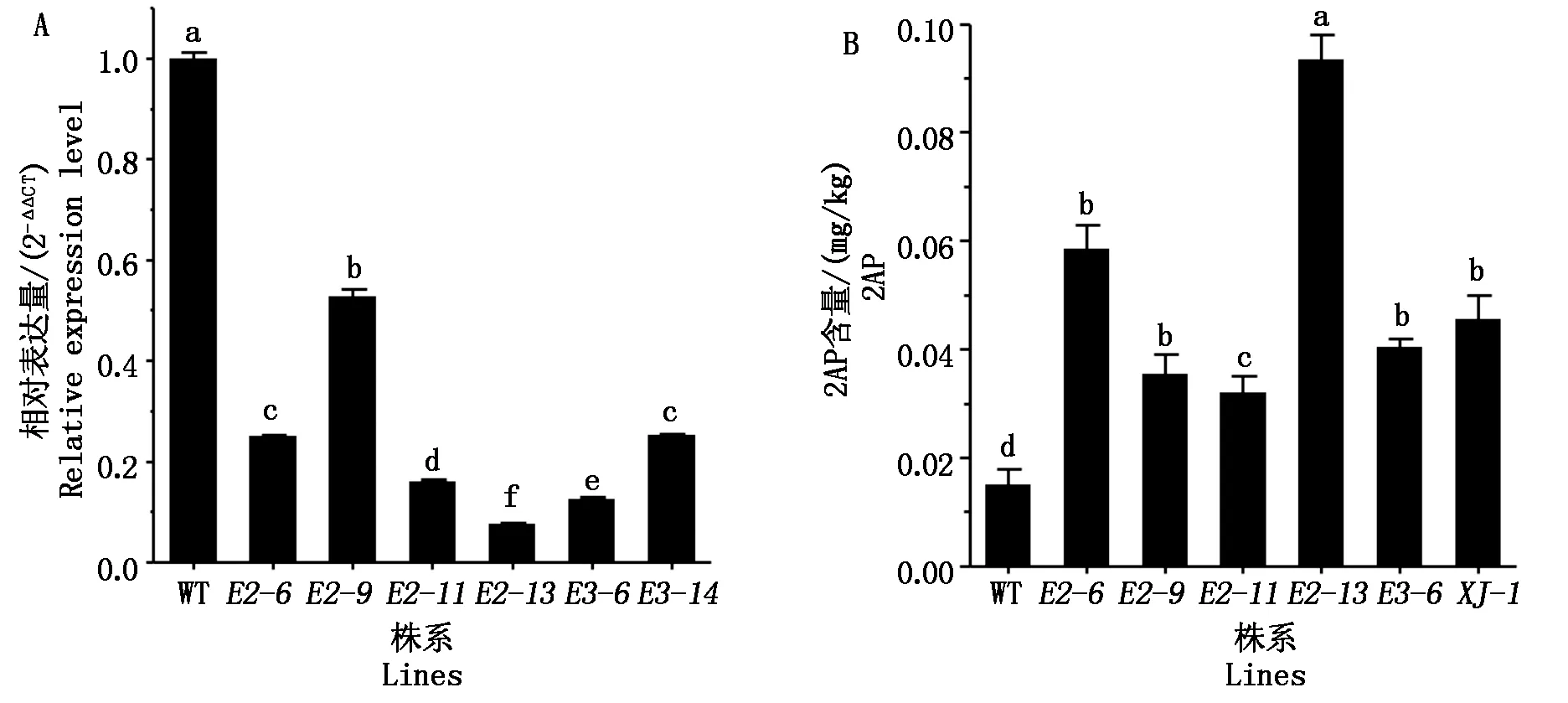
A.突變體Badh2基因的表達情況;B.突變體中香味物質(2AP)的含量測定。 XJ-1.信香粳1號。不同小寫字母表示差異顯著(P<0.05)。圖4同。 A.The expression of Badh2 in the mutants; B.The content determination of aroma components (2AP). XJ-1.Xinxiangjing 1.Different lowercase letter indicate significant differences(P<0.05).The same as Fig.4.
2.4 突變體農藝性狀調查
為了確定在編輯Badh2基因的同時是否對受體材料的其他農藝性狀尤其是產量相關性狀造成影響,調查了6個突變株系T1的株高、分蘗數和千粒質量。統計分析表明,株高和有效分蘗數沒有差異,有3個株系的千粒質量在P<0.05水平差異顯著(圖4)。綜合農藝性狀的調查結果,篩選出3個株系(badh2-E2-6、badh2-E2-9、badh2-E3-6),在香味品質較野生型均顯著改良的同時,其他主要農藝性狀和受體保持一致,對這3個株系分單株套袋收種,用于后續的繁種和育種應用。
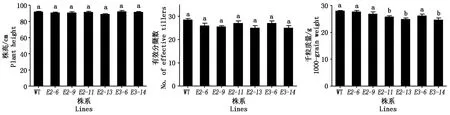
圖4 T1突變體與野生型農藝性狀調查Fig.4 Investigation of agronomic traits in wild type and T1 mutants
2.5 無轉基因序列遺留的突變體獲得
轉基因序列在突變體中的存在會對其繼續進行基因編輯,為了得到能穩定遺傳的轉基因突變體,在T1中對無標記基因Hpt和載體骨架序列整合的單株進行篩選。總共調查了6個突變體的T1單株,絕大部分單株的轉基因元件與突變靶點發生分離,共篩選到Cas9和Hpt基因檢測陰性的單株10株(表2),badh2-E3-14株系沒有獲得無轉基因序列的單株。進一步檢測這些不含轉基因序列的突變單株的突變情況,結果發現(圖5),在T0表現為純合突變的單株badh2-E2-6,其后代的突變與T0保持一致;突變株badh2-E2-9的T13個單株均為純合突變(PCR產物測序峰圖為單峰),其中2株表現為缺失7 bp,1株為缺失2 bp;badh2-E3-6的T1分別檢測到2株純合單株,均表現為插入1 bp(A/T),與T0突變類型保持一致。同時也發現突變株系badh2-E2-11和badh2-E2-13的T1與T0的突變沒有保持一致,badh2-E2-11-3表現為缺失7 bp,badh2-E2-13檢測到2種純合單株,缺失19 bp和缺失50 bp,仍然存在大片段缺失(圖5)。將10個篩選到的無轉基因元件的純合單株套袋收種。
注:+.檢測到;-.未檢測到。
Note:+.Cas9orHptdetected;-.Cas9orHptnot detected.
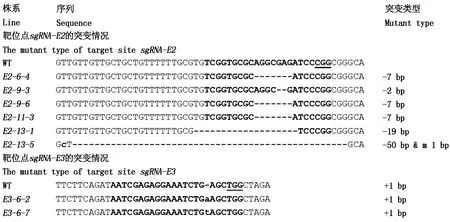
WT.野生型;E2-6-4、E2-9-3、E2-11-3、E2-13-1、E2-13-5、E3-6-2、E3-6-7.Badh2突變體的T1單株。m.堿基突變。 WT.Wild type; E2-6-4,E2-9-3,E2-11-3,E2-13-1,E2-13-5,E3-6-2,E3-6-7.T1 of Badh2 mutants. m.Base mutation.
3 討論與結論
稻米的蒸煮品質是水稻改良育種的一個主要方向,香味是其中一個最重要的食味品質。獲得香稻的傳統育種方法是通過與香稻品種進行雜交選育,再經過多年的回交獲得性狀穩定的純合品種。此過程繁雜,而且費時費力,易與產量、抗病等性狀產生連鎖累贅,導致選育結果不理想。已有研究報道,利用RNAi和TALEN技術對水稻Badh2基因進行編輯[8, 19],有助于加快香稻育種進程。近年來興起的CRISPR/Cas9技術能靶向編輯目標基因,快速穩定的獲得可遺傳的突變,可實現單堿基變異,可在轉基因當代就可以獲得純合突變[20],該體系已經成功應用于動植物中,在水稻中的應用也日漸成熟[21]。
中國水稻育種經歷高產、超高產到超級稻,單產不斷突破,但是存在高產不優質的普通問題[22]。本研究中選用的受體材料是超級稻品種龍粳31,是我國年種植面積最大的超級稻品種,具有高產、抗病、抗倒伏等優良性狀,但是稻米香味不明顯。邵高能等[9]利用CRISPR/Cas9技術對中花11的Badh2基因進行編輯,獲得在第1個外顯子上突變1個堿基的突變體材料,香味物質含量顯著提高。本研究通過CRISPR/Cas9技術對龍粳31的Badh2基因進行編輯,獲得香味物質含量較受體顯著提高的突變體,達到現有香稻的水平。本研究與邵高能等[9]的突變位點不同,分別在水稻Badh2基因的第2個內含子與第2個外顯子間和第3個外顯子上設計gRNA,以超級稻品種龍粳31為受體,進行靶向編輯,成功獲得多種Badh2基因序列有變化的突變體,在轉基因當代就獲得純合突變的單株badh2-E2-6和badh2-E2-11,且突變穩定遺傳至T1。而突變體Badh2-E2-13在T0是雙等位突變,表現為缺失64,108 bp,在T1則出現與T0不同的2種純合突變株系,表現為19,50 bp的缺失,這與前人報道的結果一致,可能是T1仍存在gRNA的識別位點,從而再次對靶位點進行編輯[23-24],產生新的突變,到了T2以后轉基因元件被剔除,突變即可穩定遺傳[25]。因此,為了獲得穩定的基因編輯系,有必要選擇無轉基因元件遺留的單株進行傳代,在T1獲得10個無轉基因元件的株系以供后續研究。
通過改良香味基因來提高稻米香味物質含量已經被報道,但是提高的程度各不一樣。有報道指出非香稻品種并非不含香味物質,而是香味不明顯[26]。本研究中所用的受體材料本身的2AP含量有0.018 mg/kg,而突變體相對于受體提高了1~4倍,達到已報道的香稻水平[17],但沒有邵高能、Shan等[8-9]報道的2AP含量高,這可能與受體材料本身特性有關。
突變Badh2基因可能會影響部分株系的產量,在本研究中調查了突變體T1植株的主要農藝性狀,2AP含量最高的突變體Badh2-E2-13的千粒質量較野生型有顯著降低,這可能與其大片段缺失有關,同時轉基因過程也可能會影響突變株系的農藝性狀。后期可以通過與野生型回交,結合香味物質含量和產量性狀進行田間選育,優先地選擇沒有影響受體主要農藝性狀的單株進行后續的育種應用,或者可以通過與野生型進行回交,選育出既保留龍粳31品種原有的優良性狀,同時香味物質含量高的單株進行后續的應用。
本試驗利用CRISPR/Cas9技術改良超級稻品種龍粳31的香味品質,對香味基因Badh2進行準確的基因編輯,獲得了Badh2基因的表達量顯著降低、香味物質含量顯著提高且無轉基因元件遺留的穩定突變株系,提高了龍粳31的經濟價值,也為香稻品種選育提供了育種材料。

