孕酮對綿羊輸卵管上皮細胞β-防御素-1 mRNA表達的影響
王東陽,楊燕燕,白薩日娜,納仁高娃,包圖雅
(1.內蒙古醫科大學 基礎醫學院,呼和浩特 010110;2.內蒙古農牧科學院,呼和浩特 010031)
防御素作為抗菌肽的主要成分,能夠抵御外來病原體的感染,在免疫、預防生殖道感染及胎兒正常發育等方面起到重要作用[1]。山羊乳腺炎使β-防御素-3的表達量增加,說明β-防御素-3在乳腺炎發生和發展的過程中起重要作用[2]。在綿羊體內有兩種β-防御素的表達,包括β-防御素-1 (SBD-1)和β-防御素-2(SBD-2)[3],主要分布在生殖、消化、呼吸等各大系統[4-6]。在綿羊的陰道黏膜上皮、子宮頸、輸卵管等組織內均存在SBD-1的廣泛表達。雌性生殖系統中β-防御素具有中和內毒素活性、抑制補體系統和抵御病毒感染等多種功能[7]。而生殖系統內β-防御素的表達與生理周期有關,主要受孕酮(P4)和雌二醇(E2)的調控[8]。P4具有調節輸卵管上皮細胞分泌的活性,同時也能夠促進胚胎分裂及發育,為正常妊娠提供一個良好的環境[9],P4可通過作用于LPS受體、TLR信號通路影響抗菌肽的表達[10]。研究發現P4對輸卵管上皮細胞SBD-2的表達主要通過核受體途徑和膜受體途徑介導,據此筆者推測P4影響SBD-1的表達也可能與這兩種途徑有關,進而調節自身免疫和預防生殖道感染。
國內外已有研究證實SBD-1在輸卵管上皮細胞表達[6,11],但P4對綿羊輸卵管上皮細胞SBD-1基因表達的調控及相關信號通路的研究較少。因此,本試驗通過體外培養綿羊輸卵管上皮細胞,探究P4對SBD-1mRNA表達的影響,并用蛋白激酶A(PKA)、蛋白激酶C(PKC)及孕酮核受體(PR)信號通路的阻斷劑研究P4在SBD-1mRNA表達過程中的作用,以明確P4調節SBD-1mRNA表達的具體信號通路。
1 材料與方法
1.1 材料
1.1.1 實驗動物 在呼和浩特市屠宰場獲得間情期健康成年母綿羊。
1.1.2 主要試劑 DMEM/F12,Thermo公司產品;孕酮、RU-486(P4核受體阻斷劑)、H-7(PKC通路阻斷劑)、H-89(PKA通路阻斷劑),Sigma公司產品;極速抽提總RNA試劑盒RNAfast200,上海聯邁生物工程有限公司產品;RNA反轉錄試劑盒Prime ScriptTMRT Regent Kit、實時熒光定量PCR試劑盒SYBR Premix ExTaqTMKit,寶生物工程(大連)有限公司產品;引物由上海生工生物工程技術服務有限公司合成。
1.2 方 法
1.2.1 綿羊輸卵管上皮細胞培養 將屠宰后的綿羊迅速解剖并采集輸卵管組織,放入無Ca2+的PBS溶液,并在2 h內轉運到無菌實驗室,進行如下處理:用無菌玻片輕輕刮除輸卵管周圍組織,去除輸卵管內黏液,用體積分數為70%乙醇沖洗縱向剖開的輸卵管管腔,然后用PBS溶液洗滌3次,將輸卵管放入2%青霉素-鏈霉素的培養基上,用無菌刀片輕刮,取下輸卵管內面組織,用吸管輕輕分散細胞形成單細胞懸液,置于離心機中離心5 min (1 000 r/min),用PBS溶液洗滌2次,重復離心,移除上清液,置于DMEM/F12培養液中,將細胞懸液以10×105mL-1的濃度接種在25 cm2培養瓶中,在37 ℃、φ=95%空氣、φ=5% CO2條件下培養,每2~3 d更換1次培養基,肉眼觀察細胞形態及生長情況。
1.2.2 細胞干預試驗 原代細胞融合至80%~90%,換無血清培養液培養24 h。然后在細胞培養液中添加10-8mol/L P4[12],分別記錄不同時間(0 h、2 h、6 h、12 h、24 h、48 h)細胞的生長情況并收集細胞,分別提取總RNA。用無血清DMEM/F12洗滌傳代細胞,繼續培養24 h,各處理組分別添加10-6mol/L RU-486、50 μmol/L H-7和50 μmol/L H-89信號通路阻斷劑。將綿羊輸卵管上皮細胞用信號通路阻斷劑預處理 1 h,確保每種通路阻斷劑的有效性,然后根據P4誘導SBD-1mRNA表達的最佳時間處理細胞,并設P4+阻斷劑組、阻斷劑組、P4組和對照(Control)組,均置于“1.2.1”所述條件下培養,研究SBD-1mRNA的表達水平。
1.2.3 引物設計 根據GenBank上公布的綿羊SBD-1基因和內參基因β-肌動蛋白(β-actin)序列(U75250,U39357),設計引物見表1。

表1 引物序列Table 1 Primer sequence
1.2.4 總RNA提取和cDNA的合成 按照RNAfast200試劑盒說明提取總RNA,然后按照Prime ScriptTMRT Regent Kit說明書反轉錄合成cDNA。基因組DNA的去除反應體系:gDNA Eraser 1 μL,5×gDNA Eraser 2 μL,RNase free dH2O 6 μL,總RNA 1 μL。反應條件為42 ℃ 2 min,然后置于4 ℃。進行反轉錄,反應體系:5×Prime script buffer 2(for real time) 4 μL,Prime Script RT enzyme Mix 1 μL,RT Prime Mix 0.5 μL,RNase Free dH2O 4 μL,基因組DNA的去除反應液10 μL。反應條件為37 ℃ 15 min,85 ℃ 5 s。cDNA產物置于-20 ℃保存,備用。
1.2.5 qPCR 按照SYBR Premix ExTaqTMKit的操作步驟,以cDNA產物為模板,利用iCycleriQTM5實時熒光定量PCR檢測系統(美國Bio-Rad公司)檢測基因的相對表達量,每個樣品重復3次,反應體系20 μL:cDNA模板2 μL,SYBR Premix ExTaqTM10 μL,上游引物(10 μmol/L)與下游引物(10 μmol/L)各0.4 μL,RNase Free dH2O 7.2 μL。反應條件:95.0 ℃ 1 min;95.0 ℃ 10 s,63.0 ℃20 s,72.0 ℃10 s,讀板,40個循環;72 ℃延伸7 min。測定熔解曲線:初始溫度為70 ℃,每6 s增加0.5 ℃,直至95 ℃。
1.2.6 數據處理 使用IBM SPSS Statistics 19.0(美國IBM公司)中單因子方差(One -way ANOVA)中的最小顯著差數法(Least significant difference,LSD)程序分析數據,采用2-△△Ct公式計算基因的相對表達量。結果以“平均值±標準差”表示。
2 結果與分析
2.1 P4對 SBD-1 mRNA表達的影響
在綿羊輸卵管上皮細胞中添加10-8mol/L P4,培養2 h、6 h、12 h、24 h、48 h,探究P4對SBD-1mRNA誘導表達的影響。結果顯示(圖1):2 h時,SBD-1mRNA的表達量與對照組無顯著性差異(P>0.05);6 h時,SBD-1mRNA的表達量達到最高峰(P<0.01),為SBD-1mRNA最大誘導量;12 h時,SBD-1mRNA表達量有所下降(P<0.05);24 h與48 h時,SBD-1mRNA的表達量持續下降,與對照組比較,SBD-1mRNA的表達量均無顯著性差異(P>0.05)。
2.2 RU-486對輸卵管上皮細胞 SBD-1 mRNA表達的影響
使用P4核受體阻斷劑RU-486預處理培養細胞1 h,然后添加10-8mol/L P4,6 h后觀測SBD-1mRNA的表達量,探究RU-486對P4誘導SBD-1mRNA表達的作用。結果顯示:P4組與對照組比較,SBD-1mRNA的表達量顯著增加(P<0.05)。RU-486+P4組與P4組比較,SBD-1mRNA的表達量顯著下調(P<0.05),表明SBD-1的表達與孕酮核受體有關。RU-486組與對照組比較,SBD-1mRNA的表達量無顯著性差異(P>0.05),表明RU-486未參與單獨誘導SBD-1mRNA的表達(圖2)。

不同字母表示差異顯著(P<0.05),下同
Different lowercase letters cindicate significant difference,P<0.05,the same below
圖1 綿羊輸卵管上皮細胞通過孕酮不同處理時間影響SBD-1mRNA的表達
Fig.1 Effect of progesterone on expressions ofSBD-1mRNA in ovine oviduct epithelial cells at different processing times

圖2 綿羊輸卵管上皮細胞通過RU-486影響 SBD-1 mRNA的表達Fig.2 Effect of RU-486 on the SBD-1 mRNA expressions in ovine oviduct epithelial cells
2.3 H-89對輸卵管上皮細胞中 SBD-1 mRNA表達的影響
用PKA通路阻斷劑H-89預處理細胞1 h,再添加10-8mol/L P4,確定PKA信號通路是否參與P4誘導的SBD-1mRNA表達。6 h后結果顯示:與P4組比較,H-89+P4組SBD-1mRNA的表達量下調(P<0.05),表明P4誘導SBD-1表達與PKA通路激活有關。H-89組與對照組比較,SBD-1mRNA的表達量無顯著性差異(P>0.05),表明H-89單獨存在并不能誘導SBD-1mRNA的表達(圖3)。
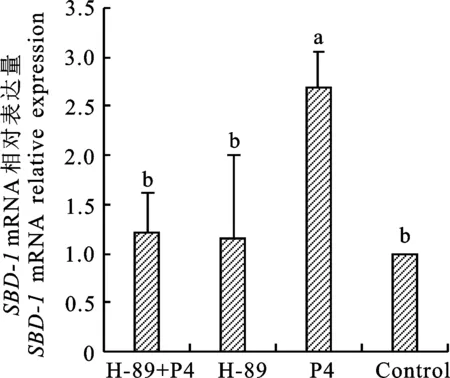
圖3 綿羊輸卵管上皮細胞通過H-89影響 SBD-1 mRNA的表達Fig.3 Effect of H-89 on the SBD-1 mRNA expressions in ovine oviduct epithelial cells
2.4 H-7對輸卵管上皮細胞中 SBD-1 mRNA表達的影響
用PKC通路阻斷劑H-7預處理細胞1 h,然后添加10-8mol/L P4,6 h后檢測SBD-1mRNA的表達量,確定PKC途徑是否介導P4誘導的SBD-1mRNA表達。結果顯示:H-7+P4組與P4組比較,SBD-1mRNA表達量無顯著性差異(P>0.05),表明H-7不參與SBD-1mRNA的表達,P4上調SBD-1mRNA的表達與PKC通路無關。H-7組與對照組比較,SBD-1mRNA的表達水平上調(P<0.05),表明單獨應用H-7可能會誘導SBD-1mRNA的表達(圖4)。
2.5 不同信號通路阻斷劑對P4誘導 SBD-1 mRNA表達的影響
與對照組相比,10-8mol/L P4可顯著上調輸卵管上皮細胞SBD-1mRNA的表達(P<0.05);與P4組相比,H-89+P4組SBD-1mRNA相對表達量顯著低于P4組(P<0.05),說明H-89抑制P4對SBD-1mRNA的上調作用;RU-486+P4組SBD-1mRNA的相對表達量顯著低于P4組 (P<0.05),表明RU-486可抑制P4對SBD-1mRNA的上調表達,且抑制效果為H-89> RU-486(圖5)。而H-7+P4組與P4組SBD-1mRNA的表達量無顯著性差異(P> 0.05),表明P4對SBD-1mRNA的誘導可能不存在PKC 通路。

圖4 綿羊輸卵管上皮細胞通過H-7影響 SBD-1 mRNA的表達Fig.4 Effect of H-7 on the SBD-1 mRNA expressions in ovine oviduct epithelial cells

圖5 不同信號通路阻斷劑影響孕酮誘導 SBD-1 mRNA的表達Fig.5 Effect of various antagonists on SBD-1 mRNA transcription induced by progesterone
3 討 論
防御素作為抗菌肽的主要成分,對原核、真核病原體及病毒具有較強的殺菌活性[13],可在適應性免疫啟動前控制感染,也可作為獲得性免疫的中介,刺激抗原發生特異性免疫反應[14-15]。在哺乳動物生殖系統中P4對β-防御素表達的調控成為近年研究的新熱點。P4可以降低脂多糖介導的炎性因子的釋放,能夠上調綿羊輸卵管上皮細胞防御素的表達[16-17],其具體調控機制有待研究,本研究通過使用P4處理體外培養細胞,添加相應信號通路阻斷劑,進而檢測SBD-1mRNA的表達,以明確P4調節SBD-1mRNA表達的具體信號通路。
P4與孕酮受體(PR)結合,主要通過基因組途徑(核受體途徑)和非基因組途徑(膜受體途徑)兩種主要機制作用于其靶細胞。在基因組途徑中,P4的生物學作用由核受體轉錄因子超家族的PR介導[18-19]。P4與核受體結合后使其構象發生變化,引發寡聚復合體的分離、易位,并與靶基因的孕酮應答元件(PRES)結合調控目的基因的轉錄[20]。而細胞內多種信號通路及蛋白激酶介導膜受體途徑,從而調控P4對輸卵管上皮細胞SBD-1mRNA的表達,與基因組途徑相比,非基因組途徑作用迅速,這和信號級聯蛋白激活第二信使和激酶,以及P4與膜受體(mPR)的相互作用有關[21]。P4通過激活腺苷酸環化酶提高cAMP含量,從而激活PKA通路,這個過程涉及到Ca2+的內流[22]。
本研究發現綿羊輸卵管上皮細胞存在SBD-1mRNA的表達,P4能顯著增加SBD-1mRNA的表達量,并且P4誘導其表達呈時間依賴性,在6 h時SBD-1mRNA的表達量最高,隨后表達上調水平逐漸下降(圖1)。在未添加P4的培養細胞中仍能檢測到SBD-1mRNA的表達,這說明β-防御素是生殖系統先天性免疫系統的成分,P4并不是使其分泌的唯一因素,但加入P4后可以上調SBD-1mRNA的表達水平。
本研究中不同信號通路阻斷劑在培養6 h時對比發現,單獨加入P4能顯著增加SBD-1mRNA的表達;RU-486+P4組與P4組相比,SBD-1mRNA的表達顯著下調,阻斷P4核受體后,RU-486顯著抑制P4對SBD-1mRNA表達的上調作用(P<0.05),而與對照組相比,RU-486組SBD-1mRNA的表達無顯著性差異(P>0.05)(圖2)。這表明RU-486對SBD-1mRNA表達本身無明顯影響,但可通過阻斷孕酮核受體抑制P4對SBD-1mRNA表達的上調作用。P4的生理作用是通過與孕酮核受體(PR)結合,激活PR基因表達,從而調控相關蛋白質的生物合成。RU-486能夠使P4下調白細胞蛋白酶抑制劑(SLPI)的作用降低[23],P4能有效抑制TLR-4的表達,而添加RU-486后這種抑制作用減弱,這種抑制作用可能與P4作用于糖皮質激素受體和孕酮核受體有關[24]。阻斷PKA信號通路后P4對SBD-1mRNA的表達水平明顯下調(P<0.05);而PKC阻斷劑H-7對SBD-1mRNA的表達無影響(圖3、圖4)。這可能與P4和膜受體結合,通過cAMP激活絲裂原活化蛋白激酶調控蛋白質的表達有關[25]。以上結果表明,P4對綿羊輸卵管上皮細胞SBD-1mRNA的表達調節作用不僅受孕酮核受體信號通路作用,而且也受孕酮膜受體的影響。PKA信號通路可能參與SBD-1mRNA的表達,PKC信號通路不參與SBD-1mRNA的表達,而有研究報道HBD-2的表達受PKC途徑的調控[26]。
圖5顯示,對P4誘導SBD-1mRNA表達的阻斷效果為H-89優于RU-486,而H-7影響最小。P4膜受體阻斷劑通過非基因組途徑起到快速的調節作用,而P4與核受體結合后需要經過轉錄和翻譯的過程,而轉錄mRNA及合成蛋白質的過程需要數小時,這可能是6 h時膜受體阻斷劑的阻斷效果更好的原因[27-28]。
綜上所述,綿羊輸卵管上皮細胞β-防御素的表達受激素水平的調節,而P4對輸卵管上皮細胞SBD-1mRNA的表達也受不同時間的影響,其調控機制主要涉及核受體途徑(PR)和膜受體途徑(PKA)。本研究結果為進一步探索防御素表達的信號通路及機制提供基礎,同時為合理使用生殖相關藥物提供依據。

