急性低氧脅迫對翹嘴鱖抗氧化酶、呼吸相關酶活性及相關基因表達的影響
徐暢 丁煒東 曹哲明 邴旭文 張晨光 谷心池 劉雨

摘要:【目的】從酶活性和基因表達水平分析低氧脅迫對翹嘴鱖(Siniperca chuatsi)應激的生理響應過程,為其健康養殖及耐低氧品種選育提供科學依據。【方法】選取體表無損傷、體重450±20 g/尾、體長24.0±0.7 cm的健康翹嘴鱖進行低氧(溶解氧含量2.8±0.2 mg/L)脅迫,設常氧(溶解氧含量6.5±0.2 mg/L)為對照組,分別在低氧脅迫0、6、12、24、48和96 h時采集翹嘴鱖的肝臟和鰓組織樣品,進行抗氧化酶、呼吸相關酶活性及低氧誘導反應相關基因表達測定。【結果】在整個急性低氧脅迫過程中,翹嘴鱖肝臟過氧化氫酶(CAT)活性、還原型谷胱甘肽(GSH)含量及谷丙轉氨酶(GPT)活性均呈先升高后降低的變化趨勢,GSH含量從低氧脅迫6 h起顯著高于對照組(P<0.05,下同),CAT和GPT活性從低氧脅迫12 h起顯著高于對照組。鰓組織乳酸脫氫酶(LDH)活性先升高后降低再升高,在脅迫6 h時達最高值(849.67 U/mg),顯著高于對照組;超微量總ATP酶(ATPase)活性呈降低—升高—降低的變化趨勢,且顯著低于對照組。低氧脅迫組翹嘴鱖肝臟HIF-1α基因的相對表達量在脅迫48 h后顯著上調;EPO基因的相對表達量先升高后降低,在脅迫12 h時顯著上調;HSP90α基因的相對表達量在脅迫6和48 h分別出現峰值,其他時間點與對照組持平。【結論】急性低氧脅迫對翹嘴鱖肝臟抗氧化酶、鰓組織呼吸相關酶及低氧誘導反應相關基因表達均產生顯著影響。雖然翹嘴鱖能通過自我調節抗氧化酶和呼吸相關酶活性及上調低氧誘導反應相關基因表達,促使機體適應低氧環境,但溶解氧降至2.8 mg/L以下即對其產生不利影響,因此在實際養殖過程中須密切關注養殖水體溶解氧變化。
關鍵詞: 翹嘴鱖;低氧脅迫;抗氧化酶;呼吸相關酶;低氧誘導反應相關基因
0 引言
【研究意義】溶解氧(Dissolved oxygen,DO)是影響魚類生存和生長的重要環境因子。在水產養殖過程中,影響水體溶解氧的因素很多,包括天氣、水流和水溫等(Wu et al.,2020)。大多數魚類具有適應溶解氧波動的能力,但溶解氧長期處于較低水平,則會對魚類造成不可逆損傷,甚至導致死亡(Abdel-Tawwab et al.,2019),給水產養殖業帶來嚴重損失。因此,探究低氧脅迫下魚類生理生化指標及相關基因的表達變化規律,明確魚類對低氧的效應及耐受限度,對科學指導魚類高密度養殖具有重要意義。【前人研究進展】隨著養殖水體中溶解氧水平的降低,魚類的呼吸和攝食活動會隨之降低,其生理和代謝活動也受到不利影響(Wedemeyer,1996)。魚類響應低氧脅迫是一個復雜的生理過程,是多種因素相互作用的結果(熊向英等,2016),通常需要在基因水平、信號通路及低氧信號途徑網絡調控等不同層面進行深入探討。Pichavant等(2002)研究表明,在嚴重低氧條件下魚類的有氧呼吸速率受到影響,腺苷三磷酸(ATP)產生減慢,導致肌肉組織中乳酸含量發生變化;Rinaldi等(2005)研究發現,在輕度低氧條件下歐洲鱸(Dicentrarchus labrax)的鰓組織結構會受到影響;Omlin和Weber(2010)在研究虹鱒(Oncorhynchus mykiss)時發現,由低氧引起的乳酸增加在降低循環中乳酸負荷具有戰略性作用;狄治朝等(2018)研究表明,斑馬魚(Danio rerio)在低氧脅迫下Hsp90ab1基因相對表達量呈上調趨勢;Sun等(2020)研究表明,大嘴鱸(Micropterus salmoides)受低氧脅迫時其肝臟的過氧化氫酶(CAT)和谷胱甘肽過氧化物酶(GSH-Px)活性明顯升高;張凱強等(2020)研究發現,HIF-1α基因在花鱸的低氧應答中發揮重要作用。此外,在團頭魴(Megalobrama amblycephala)(王慧娟,2015)、卵形鯧鲹(Trachinotus ovatus)(陳世喜等,2016)、河川沙塘鱧(Odontobutis potamophila)(賈秀琪等,2017)、花鱸(常志成等,2018)、黃顙魚(Pelteobagrus fulvidraco)(孫俊霄等,2019)的相關研究中均發現低氧脅迫能誘導抗氧化酶呈規律性變化。【本研究切入點】翹嘴鱖(Siniperca chuatsi)是人工養殖鱖魚的主要品種,但其耐低氧能力較弱,尤其隨著養殖規模化和集約化的發展,養殖水體中的溶解氧水平已成為翹嘴鱖養殖不可忽視的重要環境因素之一。至今,有關鱖魚耐氧能力的研究主要集中在窒息點和耗氧率探析(楊春等,2003)及利用池塘微孔增氧進行生態高效養殖(蔡建中等,2011;劉林,2011;章愛華,2017)等方面,而針對翹嘴鱖的耐低氧機制研究尚無報道。【擬解決的關鍵問題】探究急性低氧脅迫下翹嘴鱖抗氧化酶、呼吸相關酶活性及低氧誘導反應相關基因表達的變化規律,從酶活性和基因表達水平分析低氧脅迫對翹嘴鱖應激的生理響應過程,為其健康養殖及耐低氧品種選育提供科學依據。
1 材料與方法
1. 1 試驗用魚
供試翹嘴鱖取自南京農業大學無錫漁業學院南泉養殖基地,選取體表無損傷、體重450±20 g/尾、體長24.0±0.7 cm的健康成魚,暫養于室內控溫循環水養殖系統(450 L)內。暫養期間以鯪魚(體長4.0±1.0 cm)為餌料,每2 d投餌1次,投喂量為翹嘴鱖體重的2倍;同時保持水體溶解氧含量6.5±0.2 mg/L、pH 7.55±0.20,水溫(22.0±0.5)℃。暫養14 d后進行低氧脅迫試驗。
1. 2 試驗設計及樣品采集
根據司亞東等(1995)、熊向英等(2016)的相關研究可知,魚類的飽和溶解氧濃度為7.0 mg/L,缺氧臨界值為4.0 mg/L,鱖魚成魚的溶解氧窒息點在l.0 mg/L左右。考慮到實際生產過程中,低于魚類缺氧臨界值可能會給翹嘴鱖養殖帶來影響,故設常氧對照組(溶解氧含量6.5±0.2 mg/L)和低氧試驗組(溶解氧含量2.8±0.2 mg/L),每組設3個平行,即6個450 L的養殖桶,桶內水體積約320 L。通過調節充入水中的氮氣和空氣速率改變其溶解氧含量,利用HACH-LDO溶氧儀檢測溶解氧變化情況,使溶解氧含量維持在預設值上。待對照組和試驗組的水體溶解氧降至預設值并保持穩定時,將180尾翹嘴鱖隨機平均放養到6個養殖桶內(每桶30尾)。試驗期間每2 h用HACH-LDO溶氧儀檢測并調整水體溶解氧含量,保持水體靜止,停止進食,水溫(22.0±0.5)℃,pH 7.55±0.20。分別在低氧脅迫0、6、12、24、48和96 h時,每桶隨機選取3尾翹嘴鱖,以100 mg/L MS-222麻醉后解剖采集肝臟和鰓組織樣本,經液氮速凍后置于-80 ℃冰箱保存備用。
1. 3 酶活性檢測
過氧化氫酶(CAT)、還原型谷胱甘肽(GSH)、谷丙轉氨酶(GPT)、乳酸脫氫酶(LDH)及超微量總ATP酶(ATPase)均采用南京建成生物工程研究所研發的試劑盒進行測定。取0.1 g肝臟、鰓組織按重量體積比1∶9加入生理鹽水,制成10.0%組織勻漿,離心收集上清液制備待測溶液。其中,鰓組織再加10和100倍生理鹽水分別制成1.0%和0.1%組織勻漿,然后按試劑盒說明進行測定。使用BioTek EonTM微孔板分光光度計進行檢測讀數。
1. 4 總RNA提取及實時熒光定量PCR檢測
取0.1 g翹嘴鱖肝臟置于RNAiso Plus[寶生物工程(大連)有限公司]中勻漿,按說明提取總RNA。以微量紫外分光光度計和1.5%瓊脂糖凝膠電泳分別檢測總RNA純度及完整性后,使用HiFiScript cDNA Synthesis Kit試劑盒(北京康為世紀生物科技有限公司)將其反轉錄合成cDNA,-20 ℃保存備用。在NCBI中檢索HIF-1α(Hypoxia inducible factor-1alpha)、EPO(Erythropoietin)和HSP90α(Heat shock protein 90 alpha)基因序列,以β-actin為管家基因,利用Primer-BLAST程序設計引物(表1),委托生工生物工程(上海)股份有限公司合成。實時熒光定量PCR反應體系20.0 μL:2×UltraSYBR Mixture 10.0 μL,上、下游引物各0.4 μL,cDNA模板0.8 μL,ddH2O 8.4 μL。擴增程序:95 ℃預變性10 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 32 s,進行39個循環;60 ℃ 30 s,95 ℃ 15 s。以2-ΔΔCt法換算目的基因的相對表達量。
1. 5 統計分析
試驗數據采用Excel 2013進行統計整理,并以SPSS 22.0分別進行單因素方差分析(One-way ANOVA)和Duncans多重比較。
2 結果與分析
2. 1 急性低氧脅迫對翹嘴鱖肝臟抗氧化酶活性的影響
由圖1可知,對照組翹嘴鱖肝臟CAT活性無顯著變化(P>0.05,下同),試驗組翹嘴鱖在整個急性低氧脅迫過程中其肝臟CAT活性呈先升高后降低的變化趨勢。試驗組翹嘴鱖肝臟CAT活性在低氧脅迫初期持續升高但與對照組相比無顯著差異,至脅迫12 h時顯著升高(P<0.05,下同),CAT活性達最高值(40.13 U/mg),是對照組的1.70倍;隨后呈逐漸下降趨勢,但至脅迫96 h時CAT活性仍顯著高于對照組。
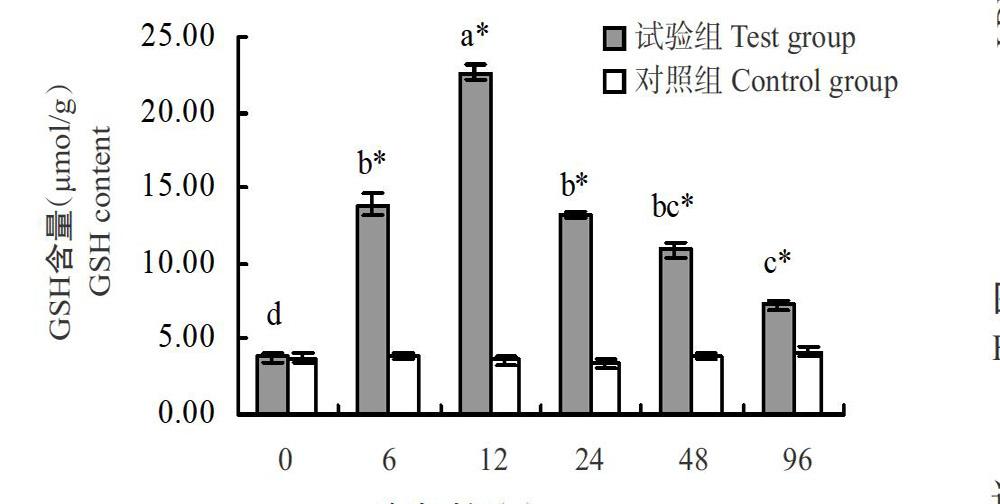
由圖2可知,對照組翹嘴鱖肝臟GSH含量無顯著變化,試驗組翹嘴鱖在整個急性低氧脅迫過程中其肝臟GSH含量變化趨勢與CAT活性相似,均呈先升高后降低的變化趨勢,但較CAT活性變化更明顯。低氧脅迫6 h時試驗組翹嘴鱖肝臟GSH含量顯著高于對照組,且呈持續升高趨勢;至脅迫12 h時GSH含量達最高值(22.65 μmol/g),是對照組的6.24倍;隨后開始下降,但直至脅迫96 h時試驗組翹嘴鱖肝臟GSH含量仍顯著高于對照組。
由圖3可知,對照組翹嘴鱖肝臟GPT活性無顯著變化,試驗組翹嘴鱖在整個急性低氧脅迫過程中其肝臟GPT活性變化也呈先升高后降低的變化趨勢。在低氧脅迫6 h時,試驗組翹嘴鱖肝臟GPT活性與對照組間無顯著差異;至脅迫12 h時GPT活性顯著高于對照組,至脅迫48 h時GPT活性達最高值(12.93 U/g),是對照組的2.26倍;隨后開始下降,但直至脅迫96 h時GPT活性仍顯著高于對照組。
2. 2 急性低氧脅迫對翹嘴鱖鰓組織呼吸相關酶活性的影響
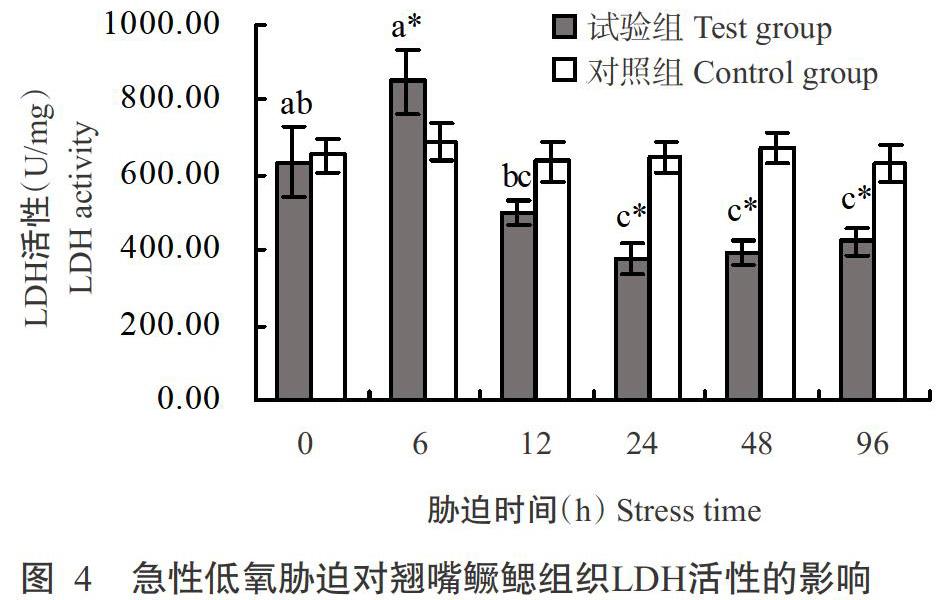
由圖4可知,對照組翹嘴鱖鰓組織LDH活性無顯著變化,試驗組翹嘴鱖在整個急性低氧脅迫過程中其鰓組織LDH活性呈先升高后降低再升高的變化趨勢。低氧脅迫6 h時試驗組翹嘴鱖鰓組織LDH活性達最高值(849.67 U/mg),是對照組的1.34倍,顯著高于對照組;隨后開始下降,至脅迫24 h時LDH活性達最低值(380.32 U/mg),顯著低于對照組;至脅迫96 h時LDH活性略有回升,但仍顯著低于對照組。
由圖5可知,對照組翹嘴鱖鰓組織ATPase活性無顯著變化,試驗組翹嘴鱖在整個急性低氧脅迫過程中其鰓組織ATPase活性呈降低—升高—降低的變化趨勢。低氧脅迫6 h時,試驗組翹嘴鱖鰓組織ATPase活性顯著低于對照組,至脅迫24 h時達最低值(0.35 U/mg),僅為對照組的16%;隨后ATPase活性略有回升,但仍顯著低于對照組。
2. 3 急性低氧脅迫對翹嘴鱖低氧誘導反應相關基因表達的影響
如圖6所示,在整個急性低氧脅迫過程中,試驗組翹嘴鱖肝臟HIF-1α基因的相對表達量呈逐漸升高趨勢。低氧脅迫24 h內,試驗組翹嘴鱖肝臟HIF-1α基因的相對表達量與對照組的差異均不顯著;從脅迫48 h起HIF-1α基因的相對表達量顯著高于對照組,至脅迫96 h時其相對表達量達最高值,是對照組的9.57倍。
如圖7所示,在整個急性低氧脅迫過程中,試驗組翹嘴鱖肝臟EPO基因的相對表達量呈先升高后降低的變化趨勢。低氧脅迫12 h時,試驗組翹嘴鱖肝臟EPO基因的相對表達量達最高值,顯著高于對照組;隨后呈下調趨勢,但至脅迫24 h時EPO基因的相對表達量仍顯著高于對照組;從脅迫48 h起,試驗組翹嘴鱖肝臟EPO基因的相對表達量與對照組相比無顯著差異。
如圖8所示,在整個急性低氧脅迫過程中,試驗組翹嘴鱖肝臟HSP90α基因的相對表達量呈升高—降低—升高—降低的波動變化趨勢。低氧脅迫6 h時,試驗組翹嘴鱖肝臟HSP90α基因的相對表達量達最高值,顯著高于對照組;隨后開始下調,至脅迫12 h時其相對表達量開始與對照組持平;至脅迫48 h時試驗組翹嘴鱖肝臟HSP90α基因的相對表達量又出現一個峰值,且顯著高于對照組,但至脅迫96 h時HSP90α基因的相對表達量又降至對照組水平。
3 討論
3. 1 翹嘴鱖肝臟抗氧化酶活性對急性低氧脅迫的響應
需氧生物的正常新陳代謝均會產生少量活性氧自由基(ROS),參與其體內的各種生理活動。當機體受到逆境脅迫時,體內產生的ROS大量積累而造成氧化損傷。抗氧化酶類在清除多余ROS的過程中發揮重要作用(亢玉靜等,2013),CAT和GSH是抗氧化酶類的重要組成部分,是反映機體健康與否的重要指標(梁俊平等,2019)。本研究結果表明,低氧脅迫下翹嘴鱖肝臟的CAT活性和GSH含量均呈先升高后降低的變化趨勢。低氧脅迫6 h時翹嘴鱖肝臟GSH含量升高顯著高于對照組,至脅迫12 h時GSH含量達最高值;與此同時,翹嘴鱖肝臟CAT活性升高,至脅迫12 h時顯著高于對照組。說明低氧脅迫致使翹嘴鱖體內的ROS含量升高,從而引起抗氧化酶系統誘導CAT活性和GSH含量升高,以清除體內過多的ROS,將ROS誘導的脂質過氧化程度控制在其生理可耐受范圍內(Lushchak et al.,2001),保護機體不受損害,與陳世喜等(2016)的研究結果相似。至脅迫24 h時,翹嘴鱖肝臟CAT活性和GSH含量分別出現下降趨勢,可能是因低氧脅迫時間過長,翹嘴鱖體內的ROS得不到及時清除而大量積累,超過體內抗氧化酶系統的耐受極限,致使抗氧化酶活性下降,與常志成等(2018)的研究結果相似。至脅迫96 h時,翹嘴鱖肝臟CAT活性和GSH含量雖然顯著高于對照組,但相對于脅迫12 h時明顯降低,其原因可能是翹嘴鱖體內ROS含量已超過體內抗氧化酶系統的耐受極限,導致抗氧化系統受損,但仍具有抗氧化作用。可見,低氧脅迫前期翹嘴鱖體內抗氧化酶系統被激活,隨著脅迫時間的延長,其抗氧化酶系統雖然受到影響,但仍然繼續行使抗氧化功能。
GPT能催化氨基從丙氨酸向α-酮戊二酸轉移,形成谷氨酸和丙酮酸(劉沛,2014),其活性反映蛋白合成與分解代謝的狀況(李開放和徐奇友,2019),是判斷肝細胞損傷的重要指標之一(羅莎等,2016)。本研究結果表明,低氧脅迫下翹嘴鱖肝臟GPT活性呈先升高后降低的變化趨勢。低氧脅迫12 h時翹嘴鱖肝臟GPT活性顯著高于對照組,表明低氧脅迫導致翹嘴鱖體內的ROS含量升高,雖然激活了抗氧化酶系統,但由于未能及時清除過多的ROS,致使肝細胞受損傷,GPT活性升高,與陳靜怡等(2018)的研究結果一致;同時說明CAT和GSH的協同作用對GPT的影響具有滯后性。在脅迫48 h時,GPT活性升高至最高值,表明隨著脅迫時間的延長,大量ROS在體內積累而得不到及時清除,嚴重影響抗氧化酶系統。至脅迫96 h時,可能是機體進行自我調節后稍有恢復,GPT活性有所下降,但仍顯著高于對照組。
3. 2 翹嘴鱖鰓組織呼吸相關酶活性對急性低氧脅迫的響應
LDH的功能是催化乳酸氧化形成丙酮酸,在糖酵解與有氧氧化的轉換過程中起關鍵作用(毛瑞鑫等,2009;揭小華等,2015),其活性反映機體的無氧呼吸代謝水平。鰓組織是魚類的呼吸器官,是溶解氧進行氣體交換的場所(王曉雯等,2016)。本研究結果表明,低氧脅迫6 h時試驗組翹嘴鱖鰓組織LDH活性顯著高于對照組,但隨后呈逐漸下降趨勢,與李根瑞(2016)的研究結果相似。說明在低氧脅迫下,翹嘴鱖通過無氧代謝為機體提供能量,并進行自我生理調節恢復。無氧呼吸代謝能力增強,促進乳酸積累,而積累的乳酸誘導LDH活性上升,形成一種調節機制。脅迫24~96 h,試驗組翹嘴鱖鰓組織LDH活性略有回升但仍顯著低于對照組,與區又君等(2017)的研究結果基本吻合,可能是低氧脅迫時間過長,機體為應對低氧脅迫帶來的影響而將乳酸轉化為葡萄糖,以維持機體酸堿平衡及葡萄糖供應(Oliveira et al.,2004),從而引起乳酸含量下降;也可能是低氧脅迫已超出機體LDH的調節范圍,使其不能發揮調節功能。
ATPase能將三磷酸腺苷(ATP)催化水解為二磷酸腺苷(ADP)和磷酸根離子,釋放能量供給生命活動,但ATPase的合成及活性均受外界溶解氧變化的影響(王曉雯等,2016)。本研究結果表明,低氧脅迫下翹嘴鱖鰓組織ATPase活性呈降低—升高—降低的變化趨勢,且顯著低于對照組,與王春枝等(2014)的研究結果相似。王春枝等(2014)認為在低氧條件下魚類能通過自我調節作用,促使ATPase活性升高,但溶解氧降至一定程度時,可能超過魚類自我調節的范圍,因此ATPase活性呈急速下降趨勢。在整個急性低氧脅迫過程中,LDH活性顯著低于對照組,可能也影響ATPase活性,究其原因可能是急性低氧脅迫時間過長造成翹嘴鱖線粒體或線粒體內膜的損傷,從而影響ATPase活性。
3. 3 翹嘴鱖低氧誘導反應相關基因對急性低氧脅迫的響應
在缺氧條件下,基因表達變化主要由缺氧誘導因子(HIF alpha)介導(Kalle et al.,2007)。其中,HIF-1α是低氧信號傳導途徑中的關鍵因子,對調控低氧信號傳導途徑起重要作用,在多數高低等動物體內均有表達(肖武漢,2014)。孫俊霄等(2019)在黃顙魚低氧(溶解氧含量1.48±0.27 mg/L)脅迫24 h、張凱強等(2020)在花鱸低氧(溶解氧含量1.56±0.24 mg/L)脅迫12 h的研究中發現HIF-1α基因呈上調表達,但Geng等(2014)研究表明斑點叉尾鮰在低氧(溶解氧含量1.0 mg/L)脅迫下,HIF-1α基因在脅迫1.5 h時呈下調表達,至脅迫5.0 h時則上調表達;Mu等(2015)研究發現許氏平鲉在低氧條件下其肝臟HIF-1α基因表達無顯著差異。本研究結果表明,低氧脅迫48 h時翹嘴鱖肝臟HIF-1α基因的相對表達量開始顯著上調,可能是本研究的溶解氧含量較高,翹嘴鱖肝臟HIF-1α信號通路在低氧脅迫前期未被激活,直至低氧脅迫48 h時才引起轉錄因子HIF累積,HIF-1α基因上調表達促使翹嘴鱖能量代謝由有氧向無氧轉變(王國善等,2014),以適應低氧環境。
EPO是一種糖蛋白激素,具有促紅細胞生成的調節功能(Chu et al.,2007)。周智涓等(2016)研究證實缺氧環境能影響BMSCs細胞EPO蛋白的表達。本研究結果也表明,低氧脅迫12 h時翹嘴鱖肝臟EPO基因的相對表達量顯著上調,說明低氧誘導了機體低氧應激反應,通過上調EPO基因表達以促進翹嘴鱖肝臟紅細胞的生成,進而應對缺氧導致的血氧能力下降,提高機體的低氧耐受能力。隨后EPO基因表達持續下調,至低氧脅迫48 h時與對照組差異不顯著,可能是翹嘴鱖通過上調EPO基因表達而促使機體對氧氣的獲取能力和利用率有所提高,同時通過反饋機制抑制EPO基因生成,維持紅細胞正常水平,以獲得生命活動需要的氧氣,使機體適應低氧環境,進而導致EPO基因表達下調,與趙永麗等(2018)的研究結論一致。HIF-1α基因和EPO基因具有協同作用,但在急性低氧脅迫下的應激反應不同步,可能是二者的響應過程及承擔功能不同,也可能是存在一定的組織特異性,具體原因有待進一步探究。
HSP(熱休克蛋白)是一整套高度保守的蛋白,除熱應激外,缺氧、局部缺血、毒素等均會促使其上調表達(Roberts et al.,2010)。HSP90家族是HSP最重要的基因家族,常被用作環境脅迫因子的分子生物標志物(劉童,2015)。本研究結果表明,低氧脅迫后翹嘴鱖肝臟HSP90α基因的相對表達量顯著上調,說明肝臟在低氧脅迫下受到影響,機體通過上調HSP90α基因表達而發揮對細胞的保護作用;隨后其相對表達量下調,可能是HSP90α基因表達上調發揮作用,使機體能適應低氧環境,與徐賀(2015)的研究結果相似。至脅迫48 h時HSP90α基因的相對表達量又出現一個峰值,且顯著高于對照組,可能是隨低氧脅迫時間的延長,再次激活機體氧化應激效應,保護肝臟細胞,與王曉雯等(2019)研究發現急性熱應激下西伯利亞鱘幼魚肝臟受到影響但脅迫96 h后能恢復的結果相似。
4 結論
急性低氧脅迫對翹嘴鱖肝臟抗氧化酶、鰓組織呼吸相關酶及低氧誘導反應相關基因表達均產生顯著影響。雖然翹嘴鱖能通過自我調節抗氧化酶和呼吸相關酶活性及上調低氧誘導反應相關基因表達,促使機體適應低氧環境,但養殖水體溶解氧降至2.8 mg/L以下即對翹嘴鱖產生不利影響,因此在實際養殖過程中須密切關注養殖水體溶解氧變化。
參考文獻:
蔡建中,李洪進,唐玉華. 2011. 魚蝦蟹池塘微孔增氧高產高效養殖技術初探[J]. 漁業致富指南,(1):55-57. [Cai J Z,Li H J,Tang Y H. 2011. Preliminary study on microporous oxygenation and high yield and high efficient aquaculture technology for fish,prawn and crab ponds [J]. Fishery Guide to be Rich,(1):55-57.]
常志成,溫海深,張美昭,李吉方,李昀,張凱強,王偉,劉陽,田源,王曉龍. 2018. 溶解氧水平對花鱸幼魚氧化應激與能量利用的影響及生理機制[J]. 中國海洋大學學報(自然科學版),48(7):20-28. [Chang Z C,Wen H S,Zhang M Z,Li J F,Li Y,Zhang K Q,Wang W,Liu Y,Tian Y,Wang X L. 2018. Effects of dissolved oxygen levels on oxidative stress response and energy utilization of juvenile Chinese sea bass(Lateolabrax maculatus) and associate physiological mechanisms[J]. Periodical of Ocean University of China,48(7):20-28.]
陳靜怡,王曉雯,朱華,馬國慶. 2018. 不同水溫下低氧脅迫對西伯利亞鱘生理狀態的影響[J]. 水產科技情報,45(2):70-76. [Chen J Y,Wang X W,Zhu H,Ma G Q. 2018. Effects of hypoxia stress on the physiological status of Siberian cormorants at different water temperatures[J]. Fisheries Science and Technology Information,45(2):70-76.]
陳世喜,王鵬飛,區又君,溫久福,李加兒,王雯,謝木嬌. 2016. 急性和慢性低氧脅迫對卵形鯧鲹幼魚肝組織損傷和抗氧化的影響[J]. 動物學雜志,51(6):1049-1058. [Chen S X,Wang P F,Ou Y J,Wen J F,Li J E,Wang W,Xie M J. 2016. The Effect of acute and chronic hypoxia stress on liver tissue structure and oxidation in juvenile Golden Pompano(Trachinotus ovatus)[J]. Chinese Journal of Zoology,51(6):1049-1058.]
狄治朝,周濤,許強華. 2018. 低氧脅迫與常氧條件下斑馬魚鰓中熱休克蛋白基因家族的表達差異比較[J]. 大連海洋大學學報,33(6):690-695. [Di Z C,Zhou T,Xu Q H. 2018. Expression comparisons of heat shock proteins gene in gills of zebrafish exposed to both normoxia and hypoxia[J]. Journal of Dalian Ocean University,33(6):690-695.]
賈秀琪,張宏葉,王麗,于興達,王佩佩,張國松,尹紹武. 2017. 低氧脅迫對河川沙塘鱧抗氧化酶及ATP酶活性的影響[J]. 海洋漁業,39(3):306-313. [Jia X Q,Zhang H Y,Wang L,Yu X D,Wang P P,Zhang G S,Yin S W. 2017. Effect of hypoxia stress on the antioxidant enzyme and ATP enzyme activity in tissues of Odontobutis potamophila[J]. Marine Fisheries,39(3):306 -313.]
揭小華,彭雄,黃波,肖影群,羅達亞. 2015. 乳酸脫氫酶編碼基因在腫瘤中表達及其轉錄調控機制的研究進展[J]. 腫瘤,35(11):1271-1277. [Jie X H,Peng X,Huang B,Xiao Y Q,Luo D Y. 2015. Progress in research on expression and transcriptional regulation of lactate dehydrogenase coding genes in cancer[J]. Tumor,35(11):1271-1277.]
亢玉靜,郎明遠,趙文. 2013. 水生生物體內抗氧化酶及其影響因素研究進展[J]. 微生物學雜志,33(3):75-80. [Kang Y J,Lang M Y,Zhao W. 2013. Advance in antioxi-dant enzymes and its effect factors in aquatic organisms[J]. Journal of Microbiology,33(3):75-80.]
李根瑞. 2016. 仿刺參對環境低氧脅迫的生理生化響應研究[D]. 上海:上海海洋大學. [Li G R. 2016. Study on the physiological and biochemical responses of Apostichopus japonicus to environmental hypoxia stress[D]. Shanghai:Shanghai Ocean University.]
李開放,徐奇友. 2019. 白藜蘆醇對松浦鏡鯉生長性能、腸道消化酶活性、肝臟抗氧化指標和血清生化指標的影響[J]. 動物營養學報,31(4):1833-1841. [Li K F,Xu Q Y. 2019. Effects of resveratrol on growth performance,intestinal digestive enzyme activities,liver antioxidant indices and serum biochemical indices of Songpu mirror carp[J]. Chinese Journal of Animal Nutrition,31(4):1833-1841.]
梁俊平,張靜,覃寶利,王宣朋,藺玉華,丁辰龍,吳學軍. 2019. 維生素C對氨氮脅迫下大鱗鲃幼魚存活及鰓抗氧化酶活性的影響[J]. 河南農業科學,49(1):157-164. [Liang J P,Zhang J,Qin B L,Wang X P,Lin Y H,Ding C L,Wu X J. 2019. Effects of vitamin C on the survival and antioxidant enzyme activities of juvenile Barbus ca-pito under ammonia-N stress[J]. Journal of Henan Agricultural Sciences,49(1):157-164.]
劉林. 2011. 蟹、鱖池塘微孔增氧高效生態混養技術[J]. 漁業致富指南,(18):47-48. [Liu L. 2011. High efficiency ecological mixed culture technology of micro hole oxygena-tion for Eriocheir sinensis H. Milne-Edwards and Siniperca chuatsi[J]. Fishery Guide to be Rich,(18):47-48.]
劉沛. 2014. 光學核酸分子探針信號放大策略用于生化分析的研究[D]. 長沙:湖南大學. [Liu P. 2014. Reaserch of signal amplification methods of nucleic acid molecular optical probes in biochemical analysis[D]. Changsha:Hunan University.]
劉童. 2015. 基于菲律賓蛤仔的近海多環芳烴生物監測技術的研究[D]. 青島:中國海洋大學. [Liu T. 2015. Biological monitoring technology research of offshore PAHs in the clam Ruditapes philippinarum[D]. Qingdao:Ocean University of China.]
羅莎,王秋舉,鞠雪,厲菲菲,高永生,張東鳴. 2016. 氧化魚油對草魚幼魚磷酸酶和轉氨酶活性的影響[J]. 吉林農業大學學報,38(3):357-363. [Luo S,Wang Q J,Ju X,Li F F,Gao Y S,Zhang D M. 2016. Effects of oxidized fish oil on activities of phosphatase and aminotransferase in juvenile grass carp(Ctenopharyngodon idella)[J]. Journal of Jilin Agricultural University,38(3):357-363.]
毛瑞鑫,劉福軍,張曉峰,張研,曹頂臣,魯翠云,梁利群,孫效文. 2009. 鯉魚乳酸脫氫酶活性的QTL檢測[J]. 遺傳,31(4):407-411. [Mao R X,Liu F J,Zhang X F,Zhang Y,Cao D C,Lu C Y,Liang L Q,Sun X W. 2009. Studies on quantitative trait loci related to activity of lactate dehydrogenase in common carp(Cyprinus carpio)[J]. Gene-tics,31(4):407-411.]
區又君,陳世喜,王鵬飛,李加兒,溫久福,王雯,謝木嬌. 2017. 低氧環境下卵形鯧鲹的氧化應激響應與生理代謝相關指標的研究[J]. 南方水產科學,13(3):120-124. [Ou Y J,Chen S X,Wang P F,Li J E,Wen J F,Wang W,Xie M J. 2017. Study on oxidative stress response and physiological metabolism related indices of Trachinotus ovatus under hypoxic stress[J]. South China Fisheries Science,13(3):120-124.]
司亞東,陳英鴻,曾繼參. 1995. 鱖魚的耗氧率及其池塘養殖[J]. 水生生物學報,19(4):327-332. [Si Y D,Chen Y H,Zeng J S.1995. The oxygen consumption and cultivation of mandarin fish,Siniperca chuatsi[J]. Acta Hydrobiolo-gica Sinica,19(4):327-332.]
孫俊霄,韓廣坤,劉婭,李明波,袁勇超,樊啟學,王銀海,楊賀舒,莫愛杰. 2019. 雜交黃顙魚與普通黃顙魚幼魚生長性能及耐低氧能力的比較[J]. 水生生物學報,43(6):1271-1279. [Sun J X,Han G K,Liu Y,Li M B,Yuan Y C,Fan Q X,Wang Y H,Yang H S,Mo A J. 2019 .The crowth characteristics and hypoxia tolerant ability of ye-llow catfish and hybrid catfish[J]. Acta Hydrobiologica Sinica,43(6):1271-1279.]
王春枝,李忠,梁宏偉,王丹,吳奎,鄒桂偉. 2014. 低氧脅迫對鰱線粒體ATP酶活性及F1-δ基因表達的影響[J]. 中國水產科學,21(3):454-463. [Wang C Z,Li Z,Liang H W,Wang D,Wu K,Zou G W. 2014. The effects of hypoxia stress on mitochondrial ATPase activity and the expression of F1-δ in Hypophthalmichthys molitrix[J]. Journal of Fishery Sciences of China,21(3):454-463.]
王國善,甄毓,王敏曉,王建艷,石巖,米鐵柱,孫松,于志剛. 2014. 急性低氧脅迫下海月水母HIF-1α基因的表達[J]. 科學通報,59(18):1715-1722. [Wang G S,Zhen Y,Wang M X,Wang J Y,Shi Y,Mi T Z,Sun S,Yu Z G. 2014. Hypoxia induced gene expression under acute hypoxic stress in Aurelia sp.1[J]. Chinese Science Bulletin,59(18):1715-1722.]
王慧娟. 2015. 低氧對團頭魴生理生化指標及低氧應答基因表達的影響[D]. 武漢:華中農業大學. [Wang H J. 2015. Hypoxia effect on changes of biochemical and physiolo-gical parameters and the expression of hypoxia response genes in Megalobrama amblycephala[D]. Wuhan:Huazhong Agricultural University.]
王曉雯,張蓉,朱建亞,劉麗麗,馬國慶,朱華. 2019. 急性熱應激對西伯利亞鱘肝功指標及肝臟熱休克蛋白表達的影響[J]. 四川農業大學學報,37(1):122-128. [Wang X W,Zhang R,Zhu J Y,Liu L L,Ma G Q,Zhu H. 2019. Effects of acute heat stress on hepatic biochemical index and gene expression of heat shock proteins in Acipenser baeri[J]. Journal of Sichuan Agricultural University,37(1):122-128.]
王曉雯,朱華,胡紅霞,馬國慶. 2016. 低氧脅迫對西伯利亞鱘幼魚生理狀態的影響[J]. 水產科學,35(5):459-465. [Wang X W,Zhu H,Hu H X,Ma G Q. 2016. Effects of hypoxia on physiological status of Siberian sturgeon Acipenser baeri juvenile[J]. Fisheries Science,35(5):459-465.]
肖武漢. 2014. 低氧信號傳導途徑與魚類低氧適應[J]. 中國科學:生命科學,44(12):1227-1235. [Xiao W H. 2014. Hypoxia signaling pathway and hypoxia adaptation of fishes[J]. Science China:Life Science,44(12):1227-1235.]
熊向英,黃國強,彭銀輝,劉旭佳. 2016. 低氧脅迫對鯔幼魚生長、能量代謝和氧化應激的影響[J]. 水產學報,40(1):73-82. [Xiong X Y,Huang G Q,Peng Y H,Liu X J. 2016. Effect of hypoxia on growth performance,energy metabolism and oxidative stress of Mugil cephalus[J]. Journal of Fisheries of China,40(1):73-82.]
徐賀. 2015. 丙氨酰—谷氨酰胺和γ-氨基丁酸對建鯉生長、免疫和抗低氧脅迫的影響[D]. 長春:吉林農業大學. [Xu H. 2015. Effect of Ala-Gln and γ-GABA on growth,immunity and resistance to hypoxia stress of Cyprinus carpio var. jian[D]. Changchun:Jilin Agricultural University.]
楊春,李達,徐光龍,張力. 2003. 鄱陽湖鱖魚窒息點與耗氧率的初步研究[J]. 江西農業學報,10(4):96-98. [Yang C,Li D,Xu G L,Zhang L. 2003. Preliminary study on asphyxiation point and oxygen consumption rate of Siniperca chuatsi[J]. Acta Agriculturae Jiangxi,10(4):45-48.]
張凱強,常志成,溫海深,李吉方,齊鑫,張曉燕,李昀. 2020. 花鱸低氧誘導因子基因(hifs)的序列分析及低氧誘導表達[J]. 中國海洋大學學報(自然科學版),50(1):39-47. [Zhang K Q,Chang Z C,Wen H S,Li J F,Qi X,Zhang X Y,Li Y. 2020. Sequence analysis and hypoxia-induced expression of hypoxia inducible factor gene(hifs) in La-teolabrax maculatus[J]. Periodical of Ocean University of China,50(1):39-47.]
章愛華. 2017. 蟹、鱖池塘微孔增氧生態高效養殖技術[J]. 河北漁業,(3):39-41. [Zhang A H. 2017. Microporous aera-tion and ecological high-efficiency aquaculture technology for Eriocheir sinensis H. Milne-Edwards and Siniperca chuatsi[J]. Hebei Fisheries,(3):39-41.]
趙永麗,吳蓉蓉,晁燕,陳祺昌,夏明哲,祁得林. 2018. 花斑裸鯉Epo和Epor基因克隆及其低氧誘導的mRNA表達[J]. 動物學雜志,53(2):220-233. [Zhao Y L,Wu R R,Chao Y,Chen Q C,Xia M Z,Qi D L. 2018. cDNA cloning and hypoxia-induced mRNA expression of Epo and Epor genes in Gymncypris eckloni[J]. Chinese Journal of Zoo-logy,53(2):220-233.]
周智涓,伍衛,黃穗花,劉茂,陳劍. 2016. 低氧環境對大鼠骨髓間充質干細胞交感神經重構相關因子表達的影響[J]. 中西醫結合心腦血管病雜志,14(6):599-603. [Zhou Z J,Wu W,Huang S H,Liu M,Chen J. 2016. Effect of hypoxic environment on expression of sympathetic nerve remodeling related factors in rat bone marrow mesenchymal stem cells[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease,14(6):599-603.]
Abdel-Tawwab M,Monier M N,Hoseinifar S H,Faggio C. 2019. Fish response to hypoxia stress:Growth,physiolo-gical,and immunological biomarkers[J]. Fish Physiology and Biochemistry,45(3):997-1013.
Chu C Y,Cheng C H,Chen G D,Chen Y C,Hung C C,Huang K Y,Huang C J. 2007. The zebrafish erythropoietin:Functional identification and biochemical characte-rizations[J]. FEBS Letters,581(22):4265-4271.
Geng X,Feng J B,Liu S K,Wang Y P,Arias C,Liu Z J. 2014. Transcriptional regulation of hypoxia inducible factors alpha(HIF-α) and their inhibiting factor(FIH-1) of channel catfish(Ictalurus punctatus) under hypoxia[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry and Molecular Biology,169:38-50.
Kalle T R,Vuori K A M,Primmer C R,Nikinmaa M. 2007. Comparison of hypoxia-inducible factor-1 alpha in hypo-xia-sensitive and hypoxia-tolerant fish species[J]. Compa-rative Biochemistry and Physiology. Part D: Genomics and Proteomics,2(2):177-186.
Lushchak V I,Lushchak L P,Mota A A,Hermes-Lima M. 2001. Oxidative stress and antioxidant defenses in goldfish Carassius auratus during anoxia and reoxygenation[J]. American Journal of Physiology Regulatory,Integrative and Comparative Physiology,280(1):R100-R107.
Mu W J,Wen H S,Li J F,He F. 2015. HIFs genes expression and hematology indices responses to different oxygen treatments in an ovoviviparous teleost species Sebastes schlegelii[J]. Marine Environmental Research,110:142-151.
Oliveira G T,Eichler P,Rossi I C,Da Silva R S M. 2004. Hepatopancreas gluconeogenesis during anoxia and post-ano-xia recovery in Chasmagnathus granulata crabs maintained on high-proteinor carbohydrate-rich diets[J]. Journal of Experimental Zoology. Part A:Comparative Experi-mental Biology,301(3):240-248.
Omlin T,Weber J M. 2010. Hypoxia stimulates lactate dispo-sal in rainbow trout[J]. Journal of Experimental Biology,213(22):3802-3809.
Pichavant K,Maxime V,Thébault M T,Ollivier H,Garnier J P,Bousquet B,Diouris M,Boeuf G,Nonnotte G. 2002. Effects of hypoxia and subsequent recovery on turbot Scophtalmus maximus:Hormonal changes and anaerobic metabolism[J]. Marine Ecology Progress Series,225:275-285.
Rinaldi L,Basso P,Tettamanti G,Grimaldi A,Terova G,Saroglia M,de Eguileor M. 2005. Oxygen availability causes morphological changes and a different VEGF/FIk-1/HIF-2 expression pattern in sea bass gills[J]. Italian Journal of Zoology,72(2):103-111.
Roberts R J,Agius C,Saliba C,Bossier P,Sung Y Y. 2010. Heat shock proteins(chaperones) in fish and shellfish and their potential role in relation to fish health:A review[J]. Journal of Fish Diseases,33(10):789-801.
Sun J L,Zhao L L,Liao L,Tang X H,Cui C,Liu Q,He K,Ma J D,Jin L,Yan T,Zhou J,Yang S. 2020. Interactive effect of thermal and hypoxia on largemouth bass(Micropterus salmoides) gill and liver:Aggravation of oxidative stress,inhibition of immunity and promotion of cell apoptosis[J]. Fish & Shellfish Immunology,98:923-936.
Wedemeyer G A. 1996. Interactions with water quality conditions[J]. Physiology of Fish in Intensive Culture Systems,4:60-110.
Wu C B,Zheng G D,Zhao X Y,Zhou S,Zou S M. 2020. Hypoxia tolerance in a selectively bred F4 population of blunt snout bream(Megalobrama amblycephala) under hypoxic stress[J]. Aquaculture,518:734484. doi:10.1016/ j.aquaculture.2019.734484.
(責任編輯 蘭宗寶)

