枯草芽孢桿菌表達與調控工具相關研究進展
張維嬌 金學榮 徐雅晴 李江華 堵國成 康振
(江南大學生物工程學院 工業生物技術教育部重點實驗室,無錫 214122)
枯草芽孢桿菌與真核系統相比具有生長快,發酵周期短且易于培養等優勢;與其他原核系統相比具有較強的分泌表達能力[1-2],能有效避免細胞內蛋白質的積累和不溶性包涵體的形成,其遺傳背景清晰,被認為是下一代超高效分泌的細胞工廠[3]并具有開發成底盤細胞的潛力[4]。
利用傳統的代謝工程手段可以實現一定時間內目的產物的積累,但是由于局部途徑的過表達,往往會造成細胞代謝流的失衡[5]。如何平衡細胞的生長與產物的高效合成是代謝工程的一個重要問題[6]。微生物代謝流的分配在生長過程中并非一成不變,而是隨著胞內代謝物水平及環境的變化而發生動態調整。動態調控手段能在保證目的產物高效合成的情況下,同時平衡細胞的生長,實現高產量和高底物轉化率的統一。
本文主要從轉錄水平和轉錄后水平上綜述了近幾年來枯草芽孢桿菌動態表達調控工具的開發,并就其調控機制進行了介紹,最后對這些調控工具在產物合成中的應用做了簡要概述。
1 轉錄水平調控
目的基因表達的第一步就是轉錄,在轉錄水平上進行基因表達調控是最直接和最方便的。基因的轉錄過程通常與外界物質、轉錄因子、胞內代謝物以及群體環境等相關[7],通過控制這些影響因子可以實現基因轉錄水平的調控。
1.1 基于誘導型啟動子的調控
與組成型啟動子相比,誘導型啟動子具有可以人為控制基因轉錄的開啟或者關閉等獨特優勢,從而有效地應用于基因的調控表達。近幾年來,多種類型的誘導型啟動子被開發,應用于代謝調控中。常見的誘導型啟動子有Pgrac(IPTG 誘導)、PspaS(枯草菌素誘導)、PxylA(木糖誘導)、Pglv(麥芽糖誘導)和PsacB(蔗糖誘導),這些啟動子已被普遍用于產物的代謝調控[8]。Jiao 等[9]將啟動子PgroE和PsacB融合構建了蔗糖誘導型啟動子Pg1,同時將PgroE與lacO融合構建了IPTG 誘導型啟動子Pg2,并進一步通過在-35 與-10 區域進行突變獲得啟動子Pg3,最終使表面活性素高達9.74 g/L。為實現多個基因的表達調控,Zhou 等[10]將來源于巨大芽孢桿菌的PxylA木糖誘導啟動子和來源于大腸的IPTG誘導型啟動子Pgrac組合生產紫穗槐二烯,成功實現了在枯草芽孢桿菌中的調控。最近,Toymentseva等[11]開發了基于lial啟動子的LIKE 系統,其相似于乳酸菌NICE 系統[12]和枯草芽孢桿菌SURE 系統[13],其能嚴格調控基因表達,在非誘導條件下緊密關閉啟動子。
考慮到誘導劑的補充和發酵過程的簡化性,環境誘導型啟動子也逐漸被開發。Welsch 等[14]通過將des啟動子與冷休克蛋白cspB基因的下游表達框或5'-UTR 莖環結構融合構建成冷誘導啟動子,在發酵培養過程中,只需要通過溫度的控制即可以實現對木聚糖酶表達的調控。Li 等[15]從枯草芽孢桿菌中分離和鑒定了兩個溫度敏感型啟動子,構建了有效的溫度誘導型表達系統。此外,還有一些環境依賴型的啟動子,Yang 等[16]選擇了枯草芽孢桿菌114 個內源啟動子,以綠色熒光蛋白(GFP)為報告基因,分別對不同的溫度和pH 條件下啟動子的表達強度進行了表征,通過將不同表達時期的啟動子組合可以實現脂酶、角蛋白酶和堿性果膠酶的差異性表達。
1.2 基于核糖開關介導的表達調控
2002 年核糖開關(Riboswitch)在細菌中被發 現,Riboswitch 是mRNA上的一段5'非翻譯區(5'UTR),包括核糖體結合位點(RBS)、操縱基因等元件,大多數核糖開關由適體和表達平臺兩個部分組成。適體是其RNA 元件最保守的部分,可以與特定的小分子代謝物結合誘發mRNA 變構,表達平臺作為遺傳控制元件將適體中的折疊變化轉化為基因表達的變化。
Riboswitch 主要有4 種調控形式,分別為轉錄水平和翻譯水平的抑制和激活調控,如圖1 所示。在轉錄水平,若適體未結合配體之前處于打開狀態,與配體結合后會使表達平臺形成不依賴ρ 因子(poly U)或依賴ρ 因子(rho)的終止結構,表現為關閉狀態,從而導致轉錄終止,如枯草芽孢桿菌的S-腺苷甲硫氨酸(SAM)riboswitch[17]、賴氨酸(lysC)riboswitch[18]和yitJ riboswitch[19]都屬于這類調控方式。然而與之調控機制相反的腺嘌呤(pbuE)riboswitch[20],當在胞內存在高濃度的腺嘌呤時,腺嘌呤的結合可穩定核糖開關的適體結構域充當抗終止元件,從而導致下游基因的表達上調。大多數核糖開關可分為適體和表達平臺兩個結構域,而甘氨酸核糖開關[21]存在兩個類似適體的配體結構域,這些結構域以一個短的保守序列連接,與配體結合后激活基因的表達,這種獨特結構需確保過量的甘氨酸提供檸檬酸循環中的碳通量,當甘氨酸濃度減小時,核糖開關會快速關閉并保持足夠量的氨基酸用于蛋白質合成[22]。除此之外,翻譯水平的riboswitch 將在下文進行介紹。
1.3 基于群體感應的表達調控
群體感應(Quorum sensing,QS)是細菌細胞間通訊的一種形式[23],多存在革蘭氏陰性菌中,主要是通過響應細胞密度進行基因的表達調控,該過程的調控途徑是復雜的,需要多個酶和轉錄因子的共同作用。依賴于細胞密度調控的電路主要由誘導分子和受體蛋白兩部分組成,誘導分子與受體結合激活靶基因,靶基因在細菌中發揮必要的功能,QS 系統可以動態平衡目標產物的有效合成與細胞生長之間的關系。
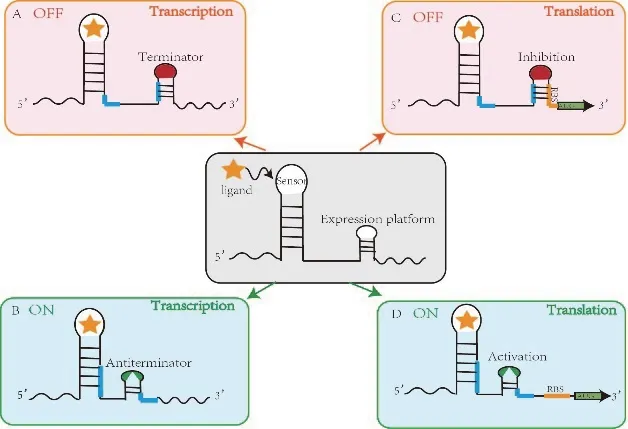
圖1 核糖開關調控基因表達的機理
革蘭氏陽性菌和革蘭氏陰性菌均存在QS 系統,革蘭氏陰性菌的QS 系統已經得到了很好的開發[24],目前在枯草芽孢桿菌中存在的QS 主要有ComPComA系統[25]和Phr-Rap系統[26],Phr60-Rap60-Spo0A 系統是枯草芽孢桿菌中研究較多的群體感應系統,Spo0A 是孢子形成的主要調節劑,必須磷酸化才能發揮活性。此外,隨著細胞的生長,細胞密度的增加會促使Phr60 增加[27],并通過Opp 轉運體進入細胞,而Phr60 抑制Rap60 的活性,Rap60 通過調節磷酸化基來負調控Spo0A 的活性,從而激活Spo0A 調控基因的表達。其QS 調控途徑如圖2 所示,Cui 等[28]利用Phr60-Rap60-Spo0A 系統構建了雙功能表達的分子開關,通過增加前體磷酸烯醇丙酮酸(PEP)和庚二烯二磷酸(HDP)的供應,以改善甲基萘醌-7(MK-7)的合成。Spo0A 抑制pyk和uppS 的表達導致從PEP 到TCA 途徑代謝通量受到限制,IPP 的消耗減少,在后期階段因為丙酮酸的生成,細胞生長迅速下降,其最終MK-7 的產量增加,Spo0A 上調ispH 和hepS/T 的表達,將碳通量推向MK-7 合成途徑,動態平衡有毒物質HMBPP 和DMAPP 對細胞生長的影響。Boguslawski 等[29]確定了Rap 蛋白調節ComA 活性的新機制,提出了Rap60 結合ComA 并抑制其活性,而不會干擾ComA與DNA 的結合的新研究。Wolf 等[30]分析了ComA激活基因的轉錄機制,通過對比rapA,rapC,srfAA和lutP 等啟動子序列發現ComA 除了結合反向重復序列(Inverted repeat,IR),還會結合直接重復序列(Direct repeat,DR),并以熒光為報告基因驗證了DR 是ComA 與啟動子結合的功能序列,同時利用凝膠電泳表明ComA 是通過與α 亞基相互作用而促進RNAP 募集到啟動子的過程。但ComP-ComA 系統還未見在代謝調控中的應用。
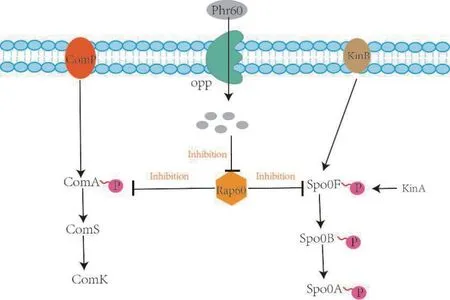
圖2 QS 調控系統原理圖
2 轉錄后水平調控
轉錄后水平調控是在mRNA水平上進行的調控,主要有小RNA(small ribonucleic acids,sRNAs)、 Riboswitch 和CRISPR 系統。
2.1 基于sRNAs介導的表達調控
sRNAs 是重要的轉錄后調節因子,在枯草芽孢桿菌中目前預測和鑒定的sRNAs 一共有108 個[31],sRNAs 通過與mRNA 堿基互補配對可改變mRNA的二級結構并激活或抑制翻譯,從調節方式上可分為順式作用(trans-encoded)和反式作用(cis- encoded)。FsrA 是枯草芽孢桿菌發現的第一個transencoded RNAs,其參與鐵代謝相關的靶標mRNA,同時需要伴侶蛋白FbpA、FbpB 和FbpC[32]的參與。SR1 是枯草芽孢桿菌第一個雙功能的sRNAs,一方面可以與靶標ahrC 的mRNA 堿基配對抑制翻譯,還參與精氨酸的分解代謝[33];另一方面也可以充當編碼肽SR1P 的mRNA。SR1P 與糖酵解酶GapA 形成GapA/SR1P 復合物并與RNase J1 相互作用,從而促進RNase J1 目標的降解[34]。
Cis-encoded RNAs 一般存在毒素-抗毒素(Toxin-Antitoxin)系統中,毒素基因編碼一個有毒性蛋白,抗毒素基因轉錄的sRNAs 與毒素基因形成sRNAsmRNA 配對復合物,從而抑制翻譯和影響mRNA 的穩定性。Yang 等[35]以GFP 為報告基因,通過對TypeI毒素-抗毒素bsrG/sr4進行優化,構建了MSDOS(Modulation via the sRNA-dependent operation system)轉錄后調控表達系統,其調控機理如圖3 所示,將MS-DOS 系統應用于透明質酸(HA)合成過程中,發現通過下調參與磷酸戊糖徑途、糖酵解途徑和細胞壁多糖合成的9 種基因,其抑制zwf、pfkA和galE基因表現了對HA 合成明顯的積極影響,基因pfkA的下調使得HA 的最高產量達1.52 g/L,是原始菌株的1.6 倍。編碼6-磷酸果糖激酶的pfkA基因是糖酵解途徑中的關鍵酶,pfkA失活會引起嚴重的生長缺陷[36]。應用MS-DOS,可以在任何指定的時間點通過添加IPTG 抑制pfkA 基因,以協調細胞生長和HA 的合成,此處MS-DOS 僅通過引入單個RNAsr4即可實現多個基因的同時精確抑制,這與其他報道的干擾系統完全不同。為進一步促進枯草芽孢桿菌的應用,Yang 等[37]構建了新型、穩定的枯草芽孢桿菌食品級表達系統(Type Ⅱ毒素-抗毒素系統ydcD/ydcE),該系統在不添加抗生素的條件下,菌株傳代100 后質粒仍然穩定存在,利用該系統將透明質酸合酶構建于HA 合成途徑中,同對照相比,獲得了更大的生物量(OD600)和更高的HA產量0.6 g/L,與由抗生素維持的常用表達系統相比,該新型表達系統消除了代謝負擔并促進了細胞生長。類似的txpA/ratA和bsrE/sr5毒素-抗毒素系統也通過影響mRNA 降解的機制達到調控基因的目的[38]。
2.2 基于Riboswitch表達調控
Riboswitch 一方面是通過對RBS 序列遮蔽和暴露進行調控,枯草芽孢桿菌yjdF riboswitch[39]處于關閉狀態,與RBS 區域配對遮蔽RBS 序列,導致翻譯被抑制;其與配體結合后表達平臺的莖環結構發生改變,RBS 區域被暴露出來進而激活下游基因的表達。許多細菌的mRNA 翻譯起始取決于同核糖體結合的RBS 與起始密碼子的距離[40],Suess 等[41]創建了一種新型的茶堿核糖開關,通過在距離RBS不同位置處插入莖環結構,該元件可干擾核糖體結合并能將其位置可逆地移動1 nt,配體茶堿結合后誘導結構轉變,并調整合適的核糖體結合位點。
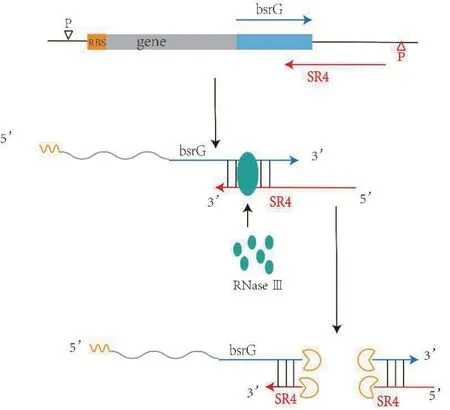
圖3 bsrG/sr4 毒素-抗毒素系統原理圖
Riboswitch 還可以通過對mRNA 的穩定性進行基因的表達調控,通常與胞內代謝物的濃度相關。枯草芽孢桿菌glmS核酶riboswitch[42],如圖4 所示,其與代謝物6-磷酸氨基葡萄糖(GlcN6P)發生響應,當細胞中過量積累GlcN6P 時glmS核酶將被激活,在5'位點附近發生自催化特異性裂解,從而導致glmSmRNA 不穩定和表達量降低。Klein 等[43]證實了在glmS核酶第40 位發現了重要的鳥嘌呤(G)位點,將其突變為腺嘌呤(A)后消除了glmS核酶的催化作用。Winkler 等[44]進一步對glmS核酶進行了一系列突變,其中將裂解位點AG 突變為CC 的M9 突變體顯示了20 倍以上的β-半乳糖苷酶活性,表明glmS核酶活性被抑制。根據這一原理,Niu 等[45]設計了GlcN6P 響應性glmS核酶開關,動態控制GlcN6P 供應和消耗所涉及的pgi、pfkA和glmM基因的表達,使得GlcNAc 的產量可達16.26 g/L,形成了GlcNAc 合成途徑、肽聚糖合成途徑(PSP)、糖酵解途徑(EMP)和磷酸戊糖途徑(HMP)之間的代謝平衡,細胞內GlcN6P 濃度的水平影響代謝途徑中關鍵酶的活性調節,其可以形成反饋路徑,動態的平衡細胞生長和GlcNAc 的合成,減少了副產物乙偶姻的產生。這一glmS核糖開關的調控機制在釀酒酵母和大腸桿菌中也普遍進行了研究。
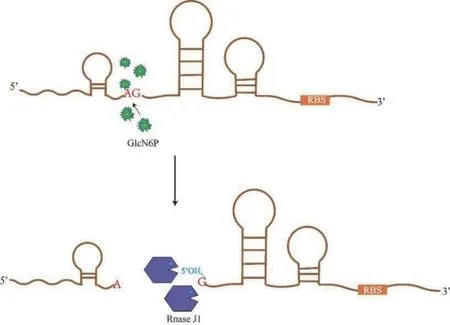
圖4 glms mRNA 的失穩機制
2.3 基于CRISPR系統的表達調控
CRISPR 系統由核酸內切酶Cas9 和sgRNA(single-guide RNA)兩部分組成,這個sgRNA 可以幫助Cas9 定位到目標序列,從而對 DNA 序列進行定點切割,PAM 基序(Proto-spacer adjacent motifs)有利于識別目的序列的位點,位于切割序列的下游。CRISPR系統調控可分 為CRISPRi(CRISPR inhibition)和CRISPRa(CRISPR activator)[46],如圖5 所示,Cas9 的D10A 和H840A 位點突變形成失活的dCas9(deactivated Cas9),該突變體缺乏核酸內切酶活性,保留了結合DNA 的活性[47],將dCas9定位到靶序列會阻礙基因的轉錄,而與激活因子結合后可以募集RNA 聚合酶(RNA polymerase,RNAP),促進基因的轉錄。
Wang 等[48]為了提高枯草芽孢桿菌中表面活性素的產生,使用CRISPRi 技術分別抑制了氨基酸生物合成分支代謝途徑上的20 個基因,由于細胞會將能量從生長轉移到生產,因此高生產率可能會降低細胞生長,然而,其中對單基因yrpC、racE的抑制表現了更高的細胞生物量和較高的表面活性素產量,因為其具有高的底物利用速率。在枯草芽孢桿菌中,由Pxyl啟動子介導的dCas9 表達比其他啟動子具有更高的抑制效率[49],Wu 等[50]開發了一種基于木糖誘導的枯草芽孢桿菌CRISPRi 系統,當抑制PSP 中的glmM時,較高的碳通量被導向EMP,對EMP 中pfkA基因抑制可以緩解碳溢出,基因zwf表達被抑制,其利用葡萄糖量減少而木糖增多,說明zwf的缺失抑制了葡萄糖流入HMP,導致大量碳通量導向EMP,同時對PSP、EMP 和HMP 這三個途徑進行抑制,可以減少葡萄糖分解代謝并促進木糖的利用,使GlcNAc 產量提高了13.2%。Westbrook等[51]通過CRISPRi 減少pfkA和zwf的表達從而減少中間代謝碳的流失,可以將碳通量分別從EMP 和HMP 途徑重新定向到細胞壁的生物合成,并通過適當調節pfkA和zwf的抑制強度可以顯著提高HA的產生,而不會影響HA 的分子量,同時對細胞生理的影響較小。研究發現RNAP 的ω 亞基與啟動子上游區域的dCas9 融合可以實現基因的轉錄激活(CRISPRa)[52],最近,Lu 等[53]首次在枯草芽孢桿菌中應用CRISPRa 系統,dCas9-α/ω 介導的轉錄調控高度依賴靶位,因此可以通過設計特定的sgRNA來同時激活和抑制不同基因的表達,結合dCas9-ω介導的轉錄和新型啟動子工程OAPS(Oligonucleotide annealing based promoter shuffling),枯草芽孢桿菌中淀粉酶的產量增加了260 倍。
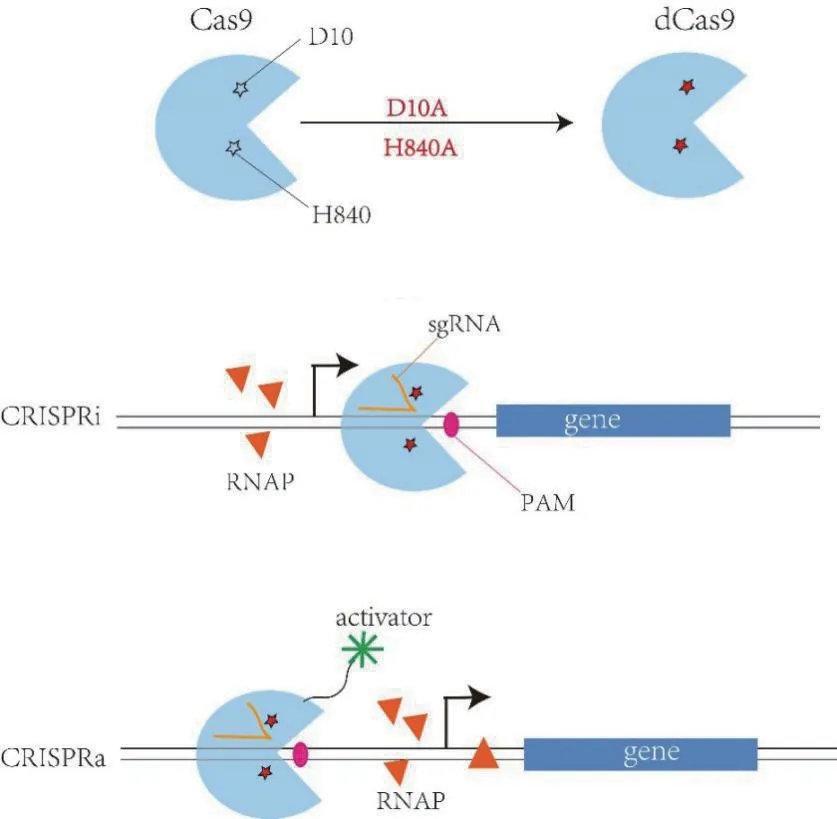
圖5 CRISPRi 和CRISPRa 調控機理
3 總結與展望
枯草芽孢桿菌的動態調控工具可以有效的平衡代謝產物的合成和細胞的自身生長,從而維持代謝網絡的穩定,避免了細胞受損、中間代謝物積累以及產量低等問題。枯草芽孢桿菌中的動態調控可以通過誘導物的添加、QS 系統的響應影響基因的轉錄,也可以利用sRNAs、Riboswitch 和CRISPR 調控基因的翻譯水平。
然而目前枯草芽孢桿菌的動態調控工具仍然缺乏,且天然的sRNAs、QS 系統、Riboswitch 代謝因子響應范圍較窄、調控元件數量不多、調控機理不清晰,而基于對細胞代謝全局調控需求的增加,開發更多的調控工具去維持枯草芽孢桿菌的動態平衡是有必要的。一方面可以進一步鑒定枯草芽孢桿菌自身代謝物響應的轉錄因子、Riboswitch、sRNAs 等有關遺傳調控元件,挖掘更多的枯草芽孢桿菌自身調控機制,明確產物合成的磷酸戊糖徑途、糖酵解途徑、碳通量流向等代謝網絡信息,從而賦予枯草芽孢桿菌更好的動態調控能力;另一方面基于不斷發展的系統生物學和合成生物學技術,可以定向設計目標啟動子、分析特定的核糖體結合位點、改造sRNAs 的功能結構等組合控制基因表達。加之高通量技術的應用,更多潛在的調控元件將會被更加高效地篩選出來,大量遺傳調控元件被開發,大大加快了微生物細胞工廠的構建。隨著生物技術的發展,枯草芽孢桿菌底盤細胞的潛力逐漸被呈現出來,其底盤細胞是通過基因組最小化、碳分解代謝物阻遏去除、細胞膜工程和蛋白質分泌途徑工程獲得的,將動態調控工具與人工底盤細胞結合應用可以更加針對性的對目標途徑進行動態調控及機制解析。