核黃素工業菌株高通量篩選方法的建立和應用
付首穎 夏苗苗 張祎凝 劉川,3 涂然 張大偉,3
(1. 天津科技大學,天津 300457;2. 中國科學院天津工業生物技術研究所,天津 300308;3. 中國科學院大學,北京 100049)
核黃素又名維生素B2,是一種異咯嗪衍生物[1]。這種黃色晶體最早從乳清當中分離,因其分子結構中含有核糖醇基而被命名為核黃素[1-2]。核黃素屬于B 族維生素家族,其在哺乳動物生長發育過程中起著重要的作用[3]。因而核黃素在飼料行業、食品醫藥行業中都著有廣泛的應用[4]。微生物發酵法是現在最主要的核黃素生產方法[5]。高產菌株的獲取從初期的誘變篩選和簡單代謝工程改造[6-9],發展到結合系統生物學與基因組、轉錄組、代謝組學等方法進行全面解析[10-11]。歷經近70 年的發展,工業菌株的產量與轉化率均不斷提高,逐步替代了傳統的 化學合成法和化學半合成法,成為了微生物發酵法替代化學合成法生產復雜有機分子的典型范例[12]。
雖然理性改造的技術手段不斷豐富,但是以誘變-篩選為首的非理性改造在突破代謝瓶頸與尋找新的突變位點等方面仍具有不可替代的作用[13-17]。此外,隨著流式細胞儀[18-19]、液滴微流控[20-21]、自動化育種篩選等高通量設備的應用,篩選的效率也大幅提升。和其他大多數代謝產物不同,核黃素作為一種天然的黃綠色熒光物質,具有和綠色熒光蛋白類似的發射光[22-23],這種得天獨厚的條件為以熒光篩選高產菌株提供了方便。然而利用高通量篩選技術進行核黃素高產菌株篩選的工作直到最近才有所報道。Chen 等[24]利用液滴微流控對一株產核黃素的乳酸菌的隨機突變庫進行篩選,菌株的核黃素產量從1.51 mg/L 提升到2.81 mg/L。Wagner 等[25]在對解脂耶氏酵母進行誘變-篩選研究中則發現使用流式細胞篩選得到的高產菌其胞內核黃素產量較高,而使用液滴微流控篩選到的菌株其胞外核黃素產量較高。然而兩篇文獻中所用出發菌株的核黃素產量都比較低,對于產量較高的工業菌株尚未建立合適的高通量篩選方法。因此本文評價了流式細胞分選,液滴微流控分選,96 孔板篩選等方法在核黃素工業菌株篩選中的適用性,建立了利用96 孔板靜置培養-熒光檢測篩選核黃素工業菌株的方法,并應用該方法提高了工業菌株核黃素的產量。
1 材料與方法
1.1 材料
1.1.1 菌株 R1,P1 均為實驗室保藏的核黃素生產菌株;S1 為實驗室保藏的核黃素生產工業菌株;1#、2#和3#為本研究所得菌株。
1.1.2 培養基 LB 培養基:蛋白胨10 g/L、酵母抽提物5 g/L、氯化鈉10 g/L;
YP 發酵培養基:玉米漿干粉(0.5%)、蔗糖(1%)、硫酸鎂(0.5%)、酵母抽提物(0.5%)、磷酸氫二鉀(0.3%)、磷酸二氫鉀(0.2%),滅菌前用NaOH 調節pH 至7.2。
1.2 方法
1.2.1 核黃素不同濃度標品熒光強度的測定 配置10 mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70 mg/L、80 mg/L 的核黃素標準品水溶液,分別取100 μL 于Costar 黑色底透酶標板中,測定激發光473 nm,發射光520 nm 下的熒光值,繪制核黃素不同濃度標品與熒光強度的關系曲線。
1.2.2 流式細胞分析 挑取活化36h的R1、P1 新鮮的單菌落,分別接種至LB 固體試管斜面培養基,37℃靜置培養36 h。分別用接種環刮取斜面上的所有菌苔于1.5 mL 發酵液中,混勻,取500 μL 菌液接種至含有100 mL 發酵培養基的500 mL 三角瓶中,37℃、200 r/min振蕩培養。分別將發酵液13 000 r/min,離心1 min,棄上清,用1 mL 1×PBS 稀釋重懸,使重懸后細胞的OD600=1,然后取50 μL 重懸后菌液到990 μL 1×PBS 中,混勻后去進行流式分析,檢測R1、P1 的細胞內熒光強度。
1.2.3 液滴微流控分選 挑取活化36h的R1、P1新鮮單菌落,分別接種于含有40 mL LB 培養液的250 mL 三角瓶中,37℃、200 r/min 振蕩培養12 h。分別將種子液4 000 r/min 離心8 min,棄上清。然后用40 mL 發酵培養基重懸菌體沉淀,得到種子懸液。將種子懸液接種至發酵培養基中,使接種后發酵液的OD600=0.1。然后用液滴微流控進行液滴包埋。包埋后液滴置于37℃靜置培養。篩選液滴微流控激發波長473 nm,發射波長520 nm 下,熒光信號最高的1%個液滴,每管收集2 000 個液滴左右。將收集到的液滴涂布LB 固體培養基平板,37℃倒置培 養36 h。
1.2.4 96 深孔板靜置和振蕩培養 挑取突變庫單菌落接種于含有500 μL LB 液體培養基的96 孔板中,37℃、800 r/min、80%濕度、培養18 h。轉接27 μL種子液于含有473 μL 發酵培養基的96 深孔板中,同一來源的種子液分別接入靜置和振蕩培養的96 孔板中。靜置培養的孔板放置于37℃培養箱中,振蕩培養的孔板置于孔板搖床中,37℃、800 r/min、80%濕度培養。
1.2.5 發酵液中核黃素濃度的分光光度檢測和熒光檢測 核黃素濃度的分光光度檢測法如下:取適量體積的發酵液,用0.01 mol/L NaOH 堿溶20 min 后,10 000 r/min,離心10 min,取上清測定444 nm 下的吸光度。根據公式:產量(mg/L)=(稀釋倍數×吸光度)/0.0321計算核黃素產量。
核黃素濃度的熒光檢測法如下:取100 μL 發酵液,測定其在激發光473 nm,發射光520 nm 下的熒光強度。
1.2.6 菌種保藏方法 取樣后在孔板中加入終濃度20%的甘油,混勻。將孔板凍存于-20℃,以備進行下一輪篩選。
1.2.7 96 孔板靜置培養復篩 取3 μL 孔板初篩得到的高熒光菌株凍存液,點于LB 固體平板上,37℃培養24h后,挑取單菌落于含有500 μL LB 液體培養基的96 孔板中,37℃、800 r/min、80%濕度、培養18 h。轉接27 μL 種子液于含有473 μL 發酵培養基的96 深孔板中。放置于37℃培養箱靜置培養24h后,進行熒光檢測。
1.2.8 搖瓶發酵驗證 取3 μL 經96 孔板靜置復篩驗證后,熒光最高的4 株菌及S1 的初篩凍存液,點于LB 固體平板上,37℃靜置培養36 h。分別用接種環刮取斜面上的所有菌苔于1.5 mL 發酵液中,混勻,取500 μL 菌液接種至含有100 mL 發酵培養基的500 mL 三角瓶中,37℃、200 r/min 振蕩培養,用分光光度法測定12 h、24h和36h的核黃素產量。
2 結果
2.1 流式細胞分選與液滴微流控分選在核黃素高產菌株選育的應用
使用1.2.5 中熒光檢測法,測試液滴微流控和流式細胞儀檢測核黃素的可行性,在0-80 mg/L 的濃度范圍內,核黃素水溶液的熒光強度與核黃素濃度呈正相關(圖1-A),表明通過熒光信號可以對核黃素濃度進行定量。同時測定參數滿足流式細胞儀和液滴微流控細胞分選儀的檢測要求,故可用于核黃素含量的檢測。
對來源于同一工業菌株的R1 與P1 進行了搖瓶發酵,使用分光光度法測定核黃素產量。發酵36 h后,P1 的產量明顯低于R1(圖1-B)。為評價流式細胞儀和液滴微流控對不同核黃素產量菌株的區分能力,收集R1 與P1 的發酵液細胞,對其進行流式分析發現,36h時,R1 和P1 的平均熒光強度分別為82.08 a.u.和106.01 a.u.(圖1-C),表明流式細胞儀無法衡量菌株產量的高低。此外,將12h發酵液的上清包埋到微液滴中進行檢測,R1 上清PMT 值為1 400 mV,P1 上清PMT 值為1 200 mV(圖1-D)。故液滴微流控技術可對胞外核黃素產量的高低進行區分,與實際測得產量結果呈正相關。
為探究液滴微流控篩選高產菌株的可能性,按
1.2.3 所述方法將R1 和P1 使用液滴微流控系統進行包埋。在培養18 h、24h和36h時使用熒光顯微鏡對液滴進行觀察。如圖2 中所示,在上述3 個時間點,R1 與P1 的液滴熒光均有差異,其中液滴培養24 h時差異最為顯著。使用液滴微流控分選儀收集了每個時間點熒光值前1%的2 000 個液滴,將其涂布在LB 平板上,R1 與P1 在不同培養時間點均只長出1-2個單菌落,極低的細胞成活率阻礙了液滴微流控對高產菌株的篩選。同時進一步優化種子液培養時間、液滴分選電壓以及發酵培養基的糖濃度均未能提高細胞的成活率。因此,液滴微流控雖然能區分出不同產量的核黃素工程菌株,但不適用于目標菌株的分選。后續研究中我們建立了通量相對較低的96 孔板篩選方法,用于高產菌株的篩選。
2.2 96孔板篩選核黃素高產菌株方法的建立
為了建立最優的96 孔板篩選方法,將熒光檢測/分光光度檢測,振蕩培養/靜置培養兩組條件進行了組合分析。組合后的篩選操作流程如圖3 所示。
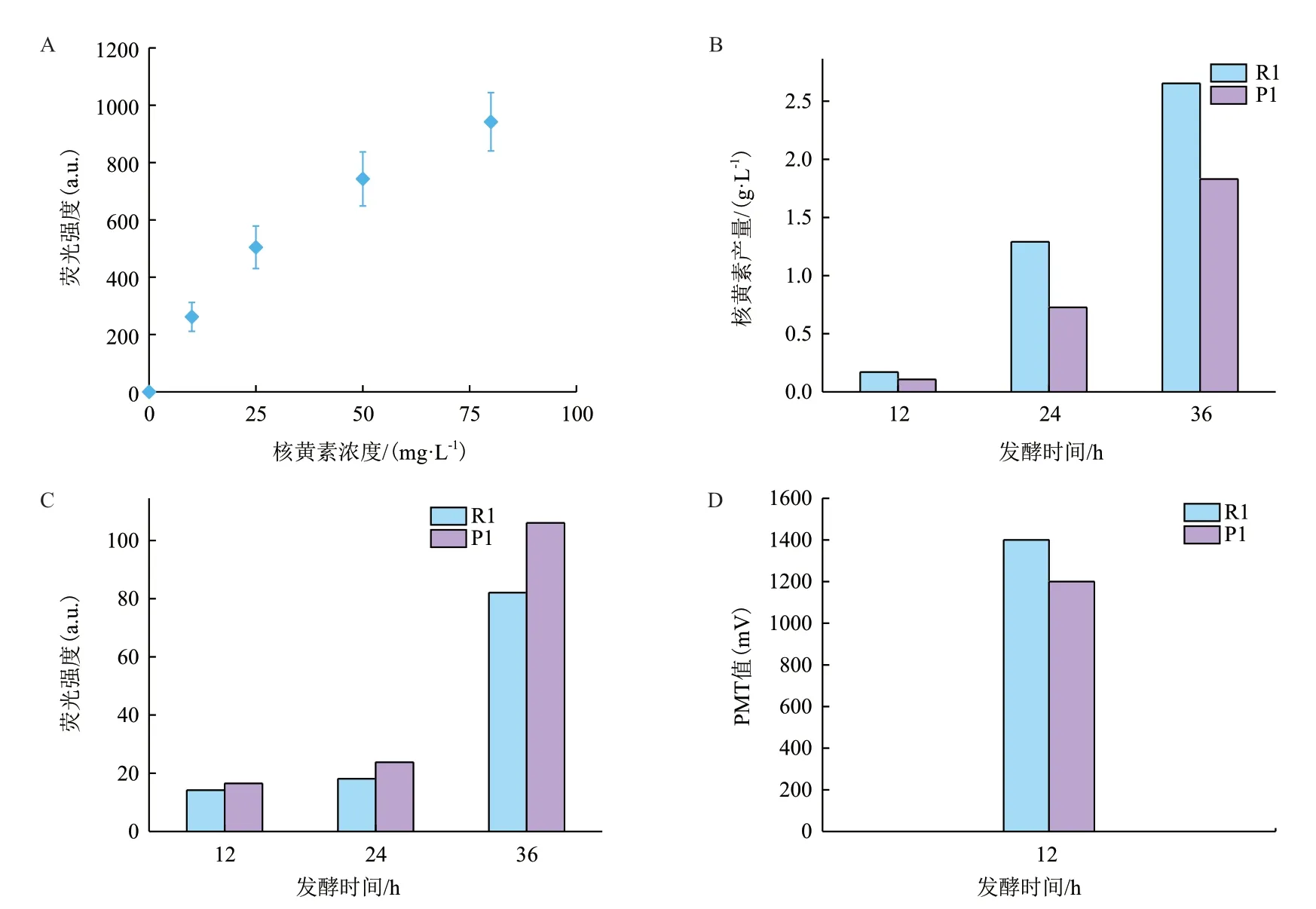
圖1 熒光與核黃素濃度的關系及流式細胞分析與液滴微流控分析結果
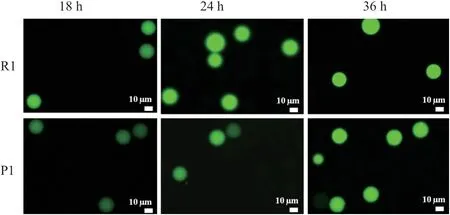
圖2 R1 和P1 液滴核黃素熒光信號圖

圖3 96 孔板篩選示意圖
96 孔板振蕩培養條件下,18 h-36h時分光光度法測定的R1 的核黃素產量均高于P1(圖4-A);24h后的熒光強度不能正確反應產量高低趨勢(圖4-B),熒光檢測不能對菌株產量進行有效區分。96孔板靜置培養條件下,18 h-36h時,分光光度法測定的R1 和P1 的核黃素產量差異不顯著(圖4-C);18 h、24 h、36h時R1 的平均熒光強度均高于P1(圖4-D),熒光檢測法則可明顯區分菌株產量高低。因此,96 孔板振蕩培養-分光光度法和96 孔板靜置培養-熒光法均可實現核黃素不同產量菌株的區分。如圖3 所示,靜置-熒光法檢測流程更加簡便,故是一種更優的篩選方法。
2.3 96孔板靜置培養-熒光檢測法篩選核黃素高產菌株
使用96 孔板靜置培養-熒光檢測法對工業菌株S1 突變體庫進行篩選。首先對S1 的突變體庫在LB 平板上進行初篩。在之前的實驗中發現,單菌落過小的個體發酵后產量明顯低于平均水平。因此,依據菌落直徑大于0.5 mm 的原則,在約3 500 個菌落中挑選了約1 300 個菌落進行初篩,初篩結果如圖5-A 所示。將初篩選得到的菌株按熒光強度排序,選取熒光強度前12%的菌株進行復篩。復篩結果與初篩的趨勢相似,從復篩得到的菌株中選取熒光相對較高的3 株菌(1#、2#、3#)進行搖瓶發酵,發現1#、2#、3#相對出發菌S1 核黃素產量均有提高,36h時產量分別為2.3 g/L、2.4 g/L、2.53 g/L(圖5-B),較出發菌分別提高了4.5%、9%和15%,說明96 孔板靜置培養-熒光檢測法可以用于高產核黃素工業枯草芽孢桿菌的篩選。
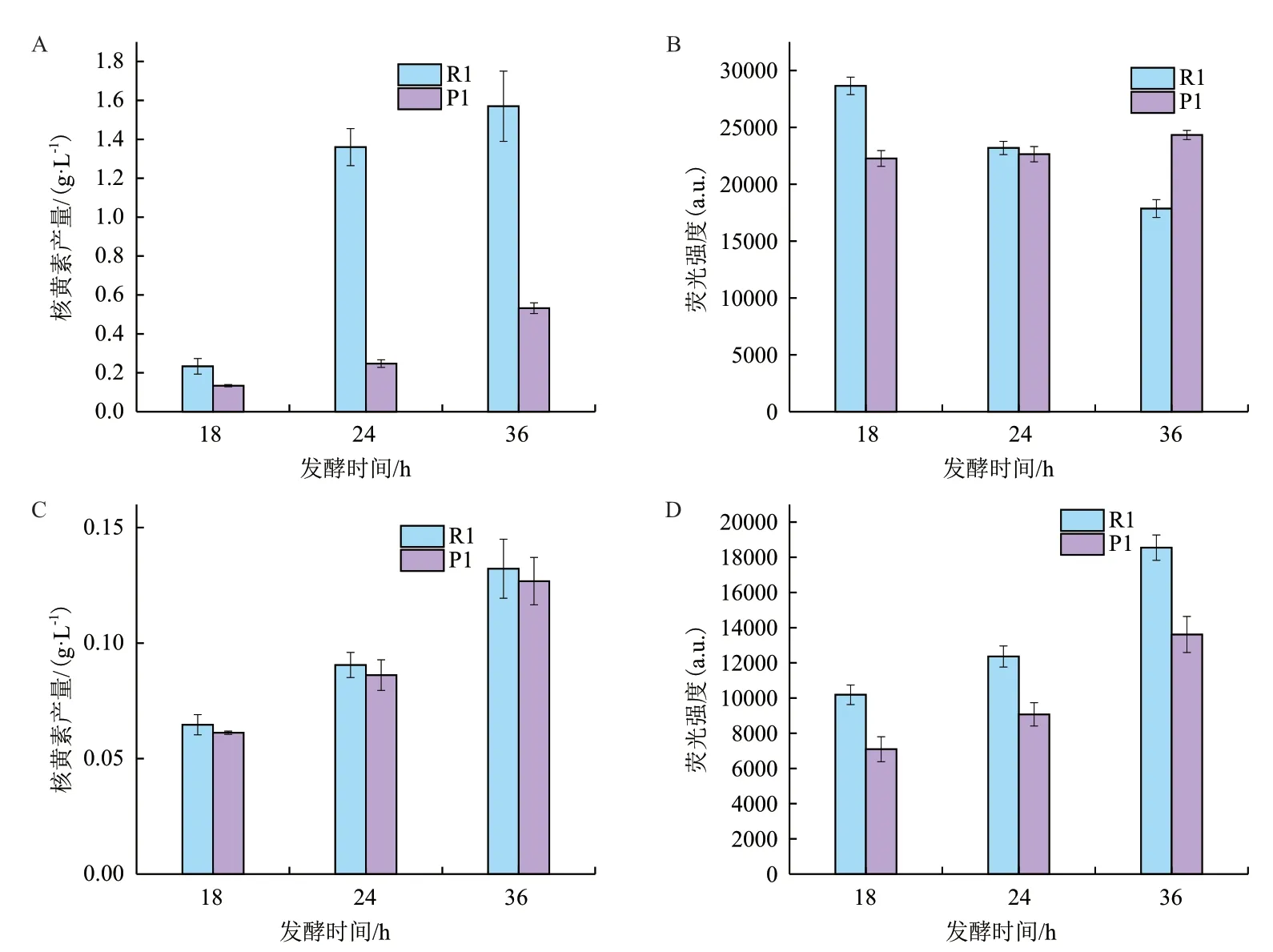
圖4 96 孔板振蕩和靜置培養
3 討論
核黃素作為經典的生物發酵產品,已有許多關于菌株非理性改造與理性改造的研究[26-27],然而與篩選方法相關的研究卻比較少,這可能是由于直接通過觀察單菌落的顏色即可粗略評價產量高低[28]。近年來隨著流式細胞分選,液滴微流控分選等方法的發展,國外已經有一些關于核黃素菌株高通量篩選方法的研究[24-25]。然而這些研究的出發菌株的核黃素產量并不高,因而有必要開發針對高產菌株的篩選方法。在本研究中,我們首先評價了超高通量的流式細胞篩選和液滴微流控篩選兩種方法在核黃素高產工業菌株篩選中的應用。我們發現,正如文獻中推測的,核黃素由于具有胞外分泌的特性,因而其高產菌株的胞內核黃素含量并不一定高[25]。這就造成了使用流式細胞檢測不能正確評價總產量的高低。而液滴微流控相當于一個微反應器,細胞生產的核黃素全部封閉在液滴中。因而可以將液滴的熒光高低等同于核黃素產量的高低。遺憾的是,在該研究中,我們并沒有使用液滴微流控成功分選到足夠數量的細胞。由于一些未知原因,經過分選的細胞成活率非常低。我們推測這可能與分選時的脈沖電壓,培養基的組分以及核黃素生產菌本身的自溶現象有關。對于液滴微流控分選成活率低的問題,我們測試了實驗室保藏的其他核黃素生產菌株,其中一些菌株的成活率可以滿足分選的需要。雖然這些菌株的核黃素產量低于S1、R1 等高產菌株,但可以利用其作為底盤菌株篩選對產量有提升作用的核黃素代謝途徑酶的突變體,利用代謝工程可以將突變體整合到高產菌株中以提高核黃素產量。研究并解決相關問題,將成為高通量篩選核黃素高產工業菌株方法的突破,將更有推廣應用的價值。而流式細胞分選的研究也并非沒有實際意義。由于現在核黃素外排的分子機制還不清楚,因此檢測胞內核黃素的變化可以了解其外排的情況,篩選胞內核黃素含量變化的菌株,也可以幫助尋找相關轉運蛋白。
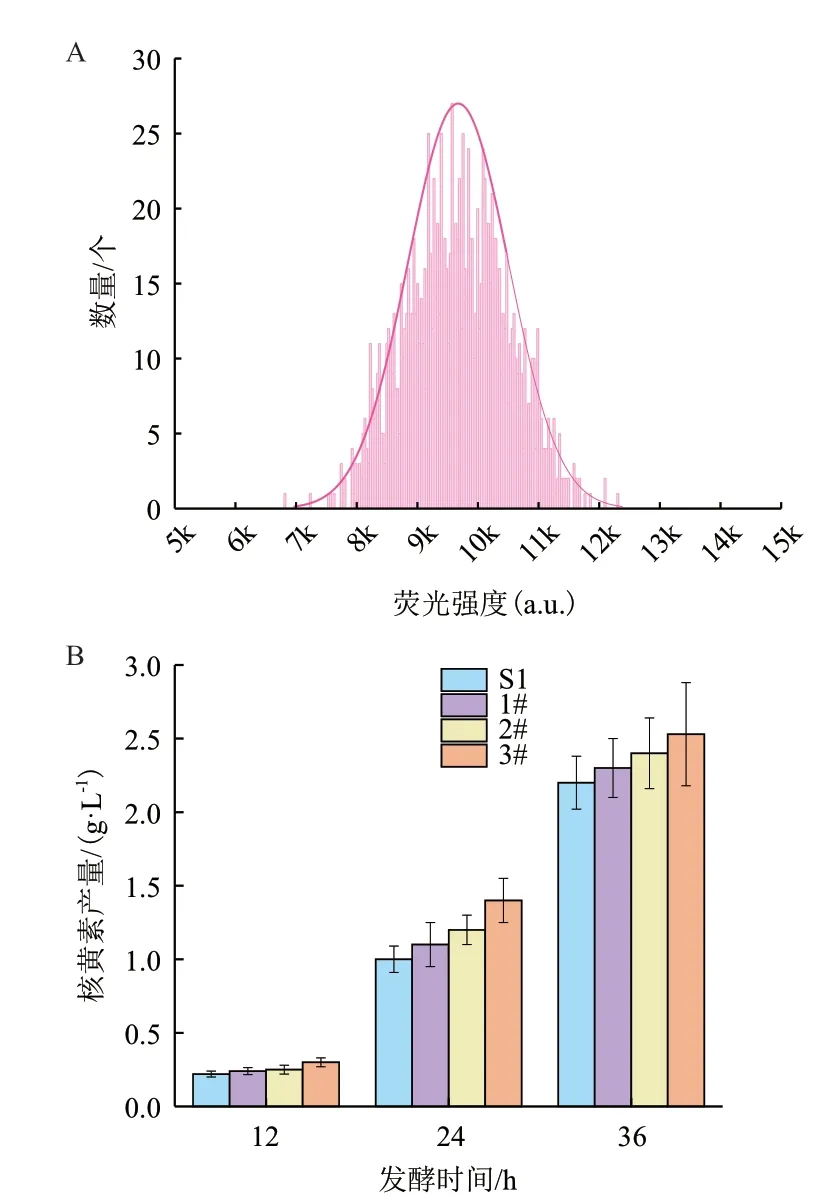
圖5 96 孔板靜置初篩、復篩及搖瓶驗證
本文通過對孔板培養方式與核黃素檢測方法的比較,建立了孔板靜置培養-熒光檢測篩選方法。發酵培養基中含有對檢測造成干擾的不溶顆粒、細胞以及色素物質,并且部分核黃素會以顆粒形式存在于發酵液中,因此使用分光光度法對發酵液進行檢測前需用稀堿溶解,然后離心取上清進行檢測。不但流程繁瑣,而且需要孔板離心機,操作相對復雜。使用熒光進行檢測時,由于核黃素的熒光具有特異性,培養基中的其他成分不會對其進行干擾,因此可以直接進行測定,步驟簡單、快速。并且靜置培養可以作為液滴培養的預試驗方法,為后期液滴微流控方法的建立提供參考。從S1 出發,通過該方法進行一輪的篩選,突變體中產量最高的菌株產量達到2.53 g/L。實驗室中保藏的菌株R1,為從S1 出發,通過大量平板篩選,搖瓶驗證,在3 年中篩選得到的產量最高的菌株。使用S1 作為出發菌株進行孔板篩選,同時對比了平板篩選和孔板篩選的效率。然而與流式細胞篩選和液滴微流控篩選相比較,其通量有差距,但在現有的流式分選與液滴微流控分選不適用于目標菌株的條件下,可通過多輪的篩選實現產量的進一步提高。
4 結論
本研究考察了不同的篩選技術,如流式細胞分選、液滴微流控、96 孔板靜置及振蕩培養,在核黃素菌株篩選方面的效果。流式細胞儀不能實現高低產菌的區分;液滴微流控可以對高低產菌株進行區分,但現有方法不適用于菌株分選。因此我們建立了96 孔板篩選方法,靜置培養-熒光檢測法可以實現高產菌株與低產菌株的區分,且該方法簡便、快速、具有較好的穩定性和準確性。利用靜置培養-熒光檢測法從工業菌突變體庫中篩選到了核黃素產量提高的菌株,證明了該方法具有實際應用意義。