黃芪和天花粉對小鼠惡性黑色素瘤B16細胞增殖和遷移及E-cadherin、N-cadherin蛋白表達的影響
張秋艷,黃松麗,張琳婧,梁羽茜,趙丕文,魏勝利,胡秀華
論著·實驗研究
黃芪和天花粉對小鼠惡性黑色素瘤B16細胞增殖和遷移及E-cadherin、N-cadherin蛋白表達的影響
張秋艷,黃松麗,張琳婧,梁羽茜,趙丕文,魏勝利,胡秀華
北京中醫藥大學,北京 100029
觀察黃芪、天花粉及其配伍對小鼠惡性黑色素瘤B16細胞增殖和遷移的影響,探討其作用機制。MTT法檢測B16細胞增殖,根據結果計算細胞生長抑制率為0%時對應的各藥物濃度(IC0)、為25%時對應的各藥物濃度(IC25)、為50%時對應的各藥物濃度(IC50)。設空白組、配伍組(黃芪注射液IC0+天花粉水煎劑IC0、黃芪注射液IC0+天花粉水煎劑IC25、黃芪注射液IC0+天花粉水煎劑IC50、黃芪注射液IC25+天花粉水煎劑IC0、黃芪注射液IC25+天花粉水煎劑IC25)。細胞劃痕實驗檢測B16細胞遷移,Western blot檢測B16細胞遷移相關蛋白E-cadherin、N-cadherin表達。MTT檢測結果表明,不同劑量黃芪和天花粉均可抑制B16細胞增殖,具有濃度依賴性;細胞劃痕實驗結果顯示,黃芪和天花粉均影響B16細胞劃痕愈合,抑制細胞遷移,具有濃度依賴性;兩藥不同比例配伍的細胞增殖抑制率明顯高于單味中藥,差異有統計學意義(<0.05);Western blot檢測結果顯示,黃芪和天花粉均增加E-cadherin蛋白的表達,降低N-cadherin蛋白的表達。黃芪、天花粉及其配伍均可抑制小鼠惡性黑色素瘤B16細胞增殖及遷移,且兩藥配伍效果優于單味中藥,黃芪和天花粉抑制細胞遷移的機制與E-cadherin和N-cadherin蛋白的表達相關。
黃芪;天花粉;B16細胞;細胞增殖;細胞遷移;配伍
惡性黑色素瘤起源于黑色素細胞的異常增生,是一種發病率高、惡性程度高、發展速度快、死亡率高的惡性腫瘤,浸潤和遷移能力強,早期即可向其他部位發生轉移,手術后極易復發。因此,如何有效防治黑色素瘤侵襲和轉移,促進其細胞凋亡,是目前臨床治療惡性黑色素瘤關注的重點。黃芪和天花粉首載于《神農本草經》,黃芪有補氣升陽、托毒生肌等功效,其主要成分黃芪多糖能減輕中波紫外線照射對皮膚角質形成細胞的損傷[1]。天花粉有清熱瀉火、生津止渴、消腫排膿功效,應用于多種外科疾病的治療。臨床及實驗研究顯示,黃芪和天花粉均有抗炎、抗病毒、抗腫瘤活性,用于多種癌癥的治療[2-8]。此外,中醫古籍也有黃芪和天花粉聯合應用的案例記載,其中對皮膚癰和癌癥的應用為中醫治療惡性黑色素瘤提供良好的治療經驗[9]。張錫純《醫學衷中參西錄》的消渴名方玉液湯以黃芪為君藥益氣固腎,天花粉為臣藥滋陰生津;陳實功《外科正宗》載內托千金散治療腦疽發背諸毒惡瘡已成不消者,方中黃芪扶正、天花粉解毒。本研究采用MTT法、細胞劃痕實驗檢測黃芪、天花粉及其配伍對小鼠惡性黑色素瘤B16細胞增殖和遷移的影響,采用Western blot檢測黃芪和天花粉及其配伍對細胞遷移相關蛋白E-cadherin、N-cadherin表達的影響,探討其作用機制,為臨床治療惡性黑色素瘤提供依據。
1 實驗材料
1.1 細胞株
小鼠惡性黑色素瘤B16細胞,購自中國協和醫科大學細胞中心。
1.2 藥物及制備
天花粉購自北京同仁堂藥業有限公司,批號20180208;黃芪注射液購自黑龍江珍寶島藥業股份,批號20180604。稱取天花粉100 g,常規中藥煎煮法煎煮,待藥液煎至約100 mL時將煎液倒入150 mL燒杯,去離子水浸泡,濃縮至50 mL;移至超凈工作臺,將濃縮藥液移至離心管,1000 r/min離心20 min,取上清液,4 ℃密閉保存。取1 mL上清液與2 mL培養基混合注入培養瓶中,置于37 ℃、5%CO2培養箱內靜置培養,進行檢菌。24 h后觀察培養基,確定藥液無菌后,將藥液4 ℃密閉保存,濃度為2 g/mL。黃芪注射液濃度為2 g/mL,用0.22 μm除菌過濾器過濾,4 ℃密閉保存。
1.3 主要試劑與儀器
胎牛血清,浙江天杭生物科技有限公司,貨號11011-8611;DMEM高糖培養基,德國Hyclone公司,貨號SH300243.01b;0.25%胰蛋白酶,德國Hyclone公司,貨號sh30042.01b;PBS,Gibco,貨號20012027;MTT,美國Sigma公司,貨號M8180;DMSO,Sigma公司,貨號d2650;96孔細胞培養板,美國Corning公司,貨號3599;6孔細胞培養板,美國Corning公司,貨號3516;細胞培養瓶,美國Corning公司,貨號430639;RIPA裂解液,北京普利萊基因技術有限公司,貨號c1053;30%丙烯酰胺,北京普利萊基因技術有限公司,貨號b1000-500;5×Loading Buffer,北京索萊寶生物科技有限公司,貨號P1040;吐溫-20,北京索萊寶生物科技有限公司,貨號T8220;BCA蛋白定量試劑盒,北京康為世紀生物科技有限公司,貨號CW10045;TEMED,美國Sigma公司,貨號110-18-9;Tris,美國BioRuler公司,貨號77-86-1;SDS,美國BioRuler公司,貨號151-21-3;甘氨酸,美國BioRuler公司,貨號56-40-6;無水甲醇,國藥集團;脫脂奶粉,美國BioRuler公司,貨號151-21-3;蛋白彩色預染marker,Thermo Scientific公司,貨號26616;0.45 μm PVDF膜,美國密理博/默克;N-cadherin,PROTEINTECH GROUP,貨號66219-I-Ig;E-cadherin,PROTEINTECH GROUP,貨號20874-I-AP;抗鼠IgG,PROTEINTECH GROUP,貨號SA00001-1;抗兔IgG,PROTEINTECH GROUP,貨號SA00001-2;ECL超敏發光液,北京普利萊基因技術有限公司,貨號P1020-100。倒置顯微鏡,日本Olympus公司,micropublisher 5.0 RTV;CO2培養箱,日本松下公司;酶標儀,奧地利/Molecular Devices,SpectraMax i3x;凝膠成像儀,美國BIO-RAD公司,ChemiDoc MP。
2 實驗方法
2.1 MTT法檢測B16細胞增殖
取對數生長期B16細胞,以3×104個/mL濃度接種于96孔細胞培養板中,置于37 ℃、5%CO2培養箱內培養24 h后換液。實驗設置空白組(只加含胎牛血清培養基)、黃芪注射液組(終濃度分別為50、100、200、300、400 mg/mL)、天花粉水煎劑組(濃度分別為160、320、640、1280、2560 μg/mL),每組設5個平行孔。繼續培養48 h后,吸出每孔中藥液,PBS清洗1次,隨后避光條件下,每孔加入濃度為5 mg/ mL的MTT溶液10 μL和90 μL無血清培養基并混合均勻,錫紙包裹靜置,培養箱中繼續培養4 h后棄上清,然后每孔加入150 μL DMSO,搖床震蕩10 min,于酶標儀波長490 nm處測定吸光度(OD值),計算細胞抑制率。細胞抑制率(%)=(1-實驗組OD值÷空白組OD值)×100%。
實驗重復3次,分別對黃芪注射液、天花粉水煎劑濃度與B16細胞的抑制率進行線性擬合,進行統計學分析,根據結果計算出細胞生長抑制率為0%時對應的各藥物濃度(IC0)、細胞生長抑制率為25%時對應的各藥物濃度(IC25)及細胞生長抑制率為50%時對應的各藥物濃度(IC50)。
2.2 MTT法檢測不同比例黃芪和天花粉配伍干預B16細胞增殖
取對數生長期B16細胞,以3×104個/mL濃度接種于96孔細胞培養板中,置于37 ℃、5%CO2培養箱內培養24 h后換液。實驗設置空白組(只加含胎牛血清培養基)、黃芪天花粉配伍組(黃芪注射液IC0+天花粉水煎劑IC0、黃芪注射液IC0+天花粉水煎劑IC25、黃芪注射液IC0+天花粉水煎劑IC50、黃芪注射液IC25+天花粉水煎劑IC0、黃芪注射液IC25+天花粉水煎劑IC25),每組設5個平行孔。細胞培養、吸光度測定和細胞抑制率計算同“2.1”項下方法。
2.3 細胞劃痕實驗檢測黃芪和天花粉干預B16細胞遷移
將對數生長期B16細胞接種于96孔板,細胞濃度為3×104個/mL,培養24 h后,用無菌10 μL槍頭在每個孔底部劃出“一”字劃痕,PBS清洗2遍,拍照記錄。實驗設置空白組(只加含胎牛血清培養基)、黃芪注射液組(終濃度為50、100、300 mg/mL)、天花粉水煎劑組(終濃度為160、640、2560 μg/mL),每組設5個平行孔。繼續培養48、72 h后鏡下觀察劃痕愈合度,拍照記錄,并分析細胞遷移情況。
2.4 細胞劃痕實驗檢測不同比例黃芪和天花粉配伍干預B16細胞遷移
將對數生長期B16細胞接種于96孔板,細胞濃度為3×104個/mL,培養24 h后,用無菌10 μL槍頭在每個孔底部劃出“一”字劃痕,PBS清洗2次,拍照記錄。實驗設置空白組(只加含胎牛血清培養基)、黃芪注射液組(黃芪注射液IC0、IC25)、天花粉水煎劑組(天花粉水煎劑IC0、IC25、IC50)、黃芪天花粉配伍組(黃芪注射液IC0+天花粉水煎劑IC0、黃芪注射液IC0+天花粉水煎劑IC25、黃芪注射液IC0+天花粉水煎劑IC50、黃芪注射液IC25+天花粉水煎劑IC0、黃芪注射液IC25+天花粉水煎劑IC25),每組設5個平行孔。繼續培養72 h后鏡下觀察劃痕愈合度,拍照記錄,并分析細胞遷移情況。
2.5 Western blot檢測黃芪和天花粉干預B16細胞遷移相關蛋白表達
將對數期生長細胞以5×103個/mL密度接種于6孔板,培養24 h,實驗設空白組(加含胎牛血清培養基)、黃芪注射液組(黃芪注射液19、158、295 mg/mL)、天花粉水煎劑組(天花粉水煎劑81、762、1595 μg/mL)。48 h后提取蛋白,用BCA試劑盒測定蛋白濃度。SDS-PAGE凝膠電泳分離蛋白組分后,將蛋白轉印于PVDF膜上,經5%脫脂奶粉封閉1 h后,分別加入不同一抗4 ℃孵育過夜,再加入HRP標記的二抗室溫孵育1 h,最后用凝膠成像系統掃描成片。用Image J軟件分析目的條帶,每組重復3次。
2.6 Western blot檢測黃芪和天花粉配伍干預B16細胞遷移相關蛋白表達
將對數期生長細胞以5×103個/mL密度接種于6孔板中,培養24 h后,實驗設空白組(只加含胎牛血清培養基)、黃芪天花粉配伍組(黃芪注射液IC0+天花粉水煎劑IC0、黃芪注射液IC0+天花粉水煎劑IC25、黃芪注射液IC0+天花粉水煎劑IC50、黃芪注射液IC25+天花粉水煎劑IC0、黃芪注射液IC25+天花粉水煎劑IC25、黃芪注射液IC25+天花粉水煎劑IC50)。48 h后提取蛋白,用BCA試劑盒測定蛋白濃度。SDS-PAGE凝膠電泳分離蛋白組分后,將蛋白轉印于PVDF膜上,經5%脫脂奶粉封閉1 h后,分別加入不同一抗,4 ℃孵育過夜,再加入HRP標記的二抗室溫孵育1 h,最后用凝膠成像系統掃描成片。用Image J軟件分析目的條帶,每組重復3次。
3 統計學方法
4 結果
4.1 不同濃度黃芪和天花粉對小鼠惡性黑色素瘤B16細胞增殖的影響
藥物處理48 h后,MTT檢測結果顯示,不同濃度黃芪注射液、天花粉水煎劑對B16細胞的抑制率不同。黃芪注射液抑制率分別為6.43%、17.36%、26.55%、39.99%、79.90%,與空白組比較,各給藥組差異均有統計學意義(<0.05);天花粉水煎劑抑制率分別為9.17%、20.86%、30.83%、40.67%、81.10%,與空白組比較,各給藥組差異均有統計學意義(<0.05)。結果見表1。
表1 黃芪和天花粉作用48 h對B16細胞增殖的影響(n=3)
組別濃度OD值(±s)抑制率/% 空白組 1.705±0.017 黃芪注射液組 50 mg/mL1.604±0.013* 6.43 100 mg/mL1.409±0.024*17.36 200 mg/mL1.252±0.037*26.55 300 mg/mL1.023±0.108*39.99 400 mg/mL0.343±0.056*79.90 天花粉水煎劑組 160 μg/mL1.549±0.003* 9.17 320 μg/mL1.349±0.003*20.86 640 μg/mL1.179±0.009*30.83 1280 μg/mL1.012±0.096*40.67 2560 μg/mL0.322±0.043*81.10
注:與空白組比較,*<0.05
根據結果計算,黃芪注射液對B16細胞IC0、IC25、IC50劑量濃度分別為19、158、295 mg/mL;天花粉水煎劑對B16細胞IC0、IC25、IC50劑量濃度分別為81、762、1595 μg/mL。上述結果表明,黃芪和天花粉均能明顯抑制B16細胞的增殖,且這種抑制作用隨濃度增加而升高,且有濃度依賴性。
4.2 不同比例黃芪和天花粉配伍對小鼠惡性黑色素瘤B16細胞增殖的影響
藥物處理48 h后,MTT檢測結果顯示,黃芪天花粉配伍組(黃芪注射液IC0+天花粉水煎劑IC0、黃芪注射液IC0+天花粉水煎劑IC25、黃芪注射液IC0+天花粉水煎劑IC50、黃芪注射液IC25+天花粉水煎劑IC0、黃芪注射液IC25+天花粉水煎劑IC25)抑制率分別為18.65%、30.39%、51.84%、27.96%、43.27%,與空白組比較差異有統計學意義(<0.05)。結果見表2。
表2 不同比例黃芪和天花粉配伍作用48 h對B16細胞增殖的影響(n=3)
組別 OD值(±s)抑制率/% 空白組1.705±0.017 黃芪注射液IC0+天花粉水煎劑IC0組1.387±0.077*18.65 黃芪注射液IC0+天花粉水煎劑IC25組1.187±0.012*30.39 黃芪注射液IC0+天花粉水煎劑IC50組0.821±0.008*51.84 黃芪注射液IC25+天花粉水煎劑IC0組1.228±0.141*27.96 黃芪注射液IC25+天花粉水煎劑IC25組0.967±0.046*43.27
注:與空白組比較,*<0.05
4.3 不同濃度黃芪和天花粉對小鼠惡性黑色素瘤B16細胞遷移的影響
培養48 h后,空白組B16細胞劃痕距離減少,有細胞遷移運動;培養72 h后,空白組B16細胞劃痕基本愈合。與空白組比較,除黃芪注射液50 mg/mL組外,其他各組劃痕愈合程度均較空白組差異有統計學意義(<0.05);且隨著天花粉水煎劑和黃芪注射液濃度的增加,劃痕愈合程度越差,細胞遷移能力越弱,具有劑量依賴性。同時我們發現不同濃度天花粉水煎劑和黃芪注射液48 h后劃痕愈合程度和72 h后劃痕愈合程度未見明顯差異,無時間依賴性。結果見圖1。

圖1 黃芪和天花粉對小鼠惡性黑色素瘤B16細胞遷移的影響
4.4 不同比例黃芪和天花粉配伍對B16細胞遷移的影響
培養72 h后,空白組B16細胞劃痕愈合明顯。除天花粉水煎劑IC0、黃芪注射液IC0+天花粉水煎劑IC0組外,其余各組較空白組差異均有統計學意義(<0.05)。黃芪注射液IC0+天花粉水煎劑IC0組與黃芪注射液IC0組、天花粉水煎劑IC0組比較無明顯差異,細胞形態正常。黃芪注射液IC0+天花粉水煎劑IC25組、黃芪注射液IC25+天花粉水煎劑IC0組、黃芪注射液IC25+天花粉水煎劑IC25組與黃芪注射液IC25、天花粉水煎劑IC25組比較,劃痕愈合程度差,細胞遷移能力弱,可見部分細胞死亡,有細胞碎片形成。天花粉IC50組與黃芪注射液IC0+天花粉水煎劑IC50組比較,對細胞遷移抑制程度無明顯差異,但天花粉IC50組細胞大量死亡,配伍后死亡細胞量減少。由此可知,黃芪、天花粉及其配伍均能抑制B16細胞遷移,黃芪和天花粉不同配伍比例對劃痕愈合能力的影響均優于相應劑量單味中藥,差異均有統計學意義(<0.05)。結果見圖2。
4.5 黃芪和天花粉對B16細胞遷移相關蛋白表達的影響
與空白組比較,762、1595 μg/mL天花粉水煎劑組及黃芪注射液各劑量組E-cadherin蛋白表達高于空白組,差異有統計學意義(<0.05);762、1595 μg/mL天花粉水煎劑組及158、295 mg/mL黃芪注射液組N-cadherin蛋白表達低于空白組,差異有統計學意義(<0.05)。結果見圖3~圖6。
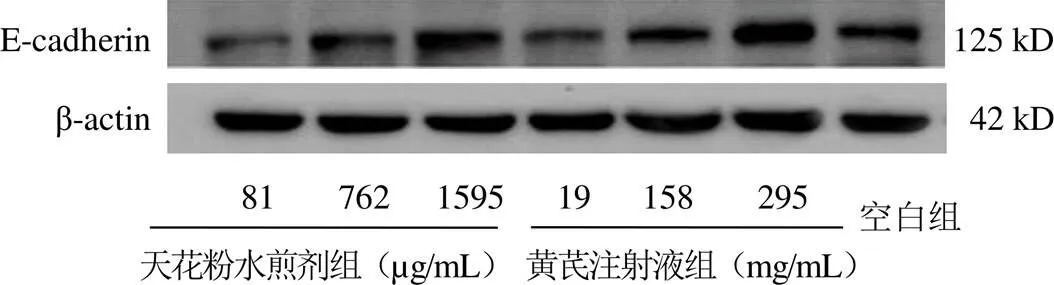
圖3 黃芪和天花粉干預各組B16細胞E-cadherin蛋白免疫印跡圖
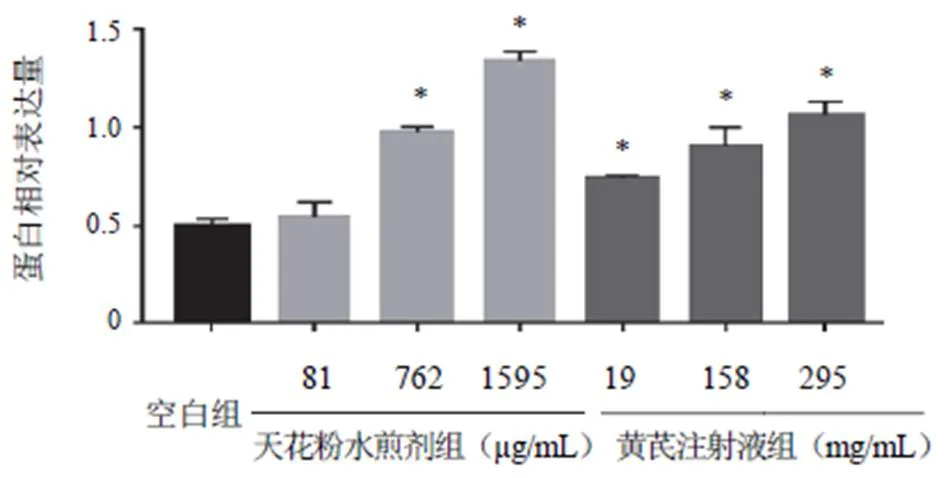
注:與空白組比較,*P<0.05

圖5 黃芪和天花粉干預各組B16細胞N-cadherin蛋白免疫印跡圖

注:與空白組比較,*P<0.05
4.6 黃芪和天花粉配伍對B16細胞遷移相關蛋白表達的影響
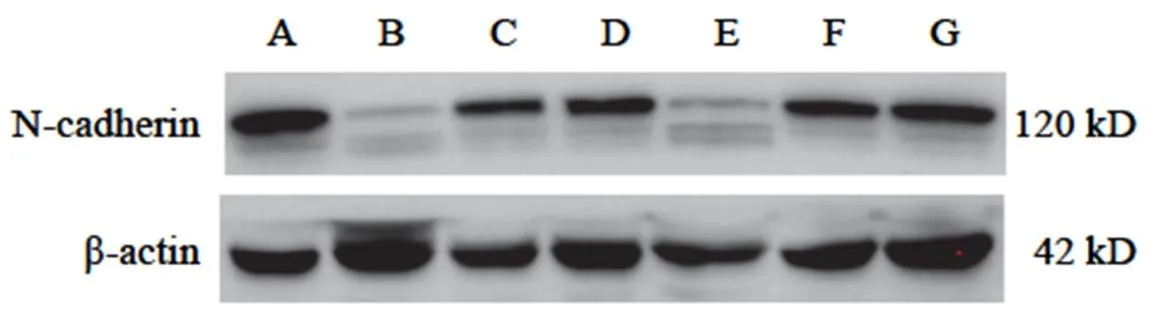
與空白組比較,黃芪注射液IC0+天花粉水煎液IC25組、黃芪注射液IC0+天花粉水煎液IC50組、黃芪注射液IC25+天花粉水煎液IC0組、黃芪注射液IC25+天花粉水煎液IC25組、黃芪注射液IC25+天花粉水煎液IC50組均能降低N-cadherin蛋白表達(<0.05);黃芪注射液IC0+天花粉水煎液IC50組、黃芪注射液IC25+天花粉水煎液IC25組、黃芪注射液IC25+天花粉水煎液IC50組均能升高E-cadherin蛋白表達(<0.05)。其中黃芪注射液IC0+天花粉水煎液IC50組效果最好,對細胞傷害較小,又能明顯降低N-cadherin、升高E-cadherin蛋白表達,抑制細胞遷移,與前期劃痕實驗結果相符。結果見圖7~圖10。
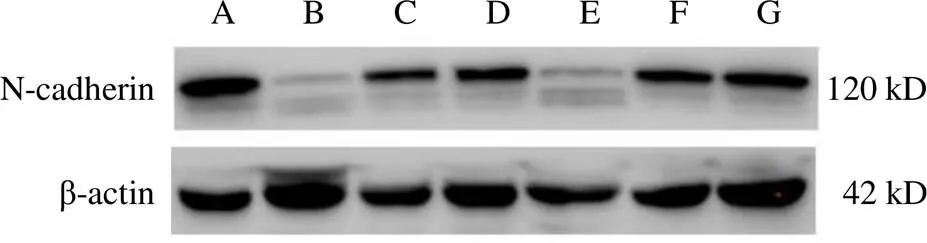
注:A.空白組;B.黃芪注射液IC25+天花粉水煎液IC50組;C.黃芪注射液IC25+天花粉水煎液IC25組;D.黃芪注射液IC25+天花粉水煎液IC0組;E.黃芪注射液IC0+天花粉水煎液IC50組;F.黃芪注射液IC0+天花粉水煎液IC25組;G.黃芪注射液IC0+天花粉水煎液IC0組(下同)
注:與空白組比較,*P<0.05
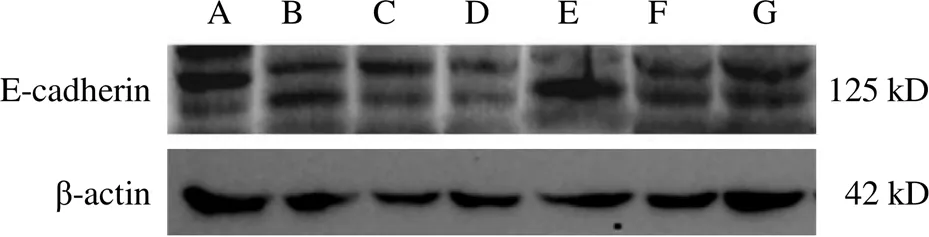
圖9 黃芪和天花粉配伍各組B16細胞E-cadherin蛋白免疫印跡圖
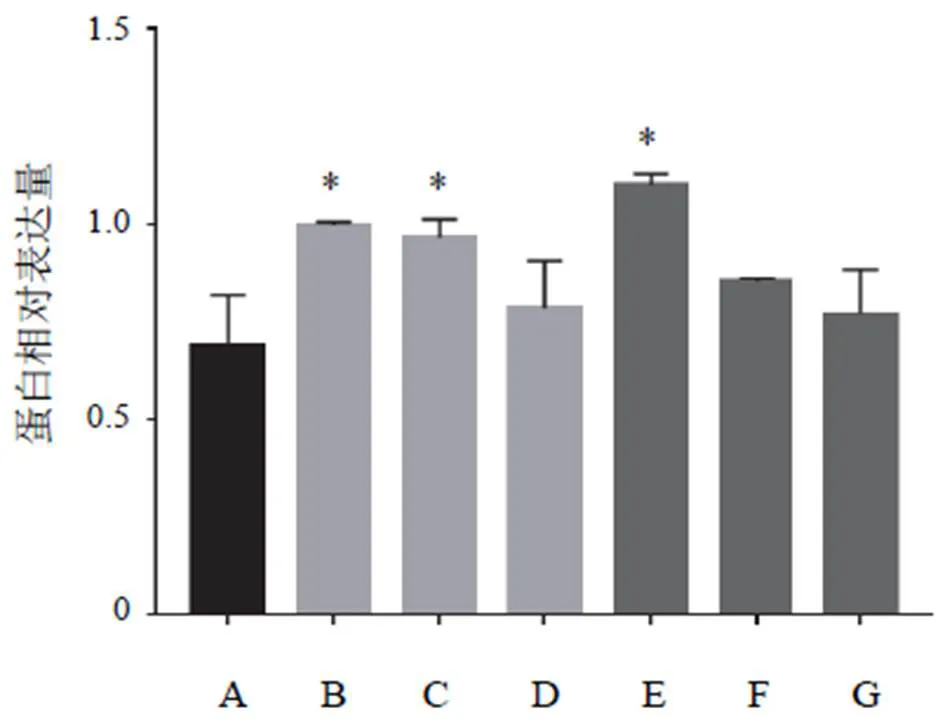
注:與空白組比較,*P<0.05
5 討論
目前惡性黑色素瘤主要治療方法是通過手術完全切除病灶,部分拒絕手術或晚期不能手術治療患者多采用放療、化療方法,但療效甚微,對機體損傷大,患者耐受度低,預后較差。尋求新的治療方法改善患者預后是目前臨床治療惡性黑色素瘤迫切需要解決的問題。中醫認為,惡性黑色素瘤病因病機包括氣虛外感、氣滯血瘀等諸多因素,形成機理以虛損為前提,陽氣束結或外邪搏于血氣而致氣滯血瘀成烏黑腫塊,瘀久化熱,潰爛流膿[10],治療應扶正祛邪。相比于手術、放化療等對機體損傷較大的治療方法,中藥在治療惡性黑色素瘤方面歷史悠久,從中尋找治療惡性黑色素瘤的藥物具有廣闊的應用前景。黃芪、天花粉均有抗腫瘤功效,中醫臨床常將其單獨或組成各種方劑用于各類中、晚期癌癥患者的治療。單味藥應用易產生耐藥性,且高劑量藥物雖對細胞抑制作用強,但可能在殺死腫瘤細胞的同時損傷正常細胞。配伍是中藥治療的主要應用方法,多種藥物間配伍不僅能提高療效、減少不良反應,也不易產生耐藥性,具有不可忽視的優勢。本實驗發現黃芪和天花粉配伍不僅能抑制細胞的增殖和遷移運動,還能降低高劑量藥物對細胞的損傷,配伍后對細胞增殖的抑制作用與相應劑量的單藥相比效果更好。
進展迅速是惡性黑色素瘤的主要特性之一,腫瘤細胞不斷增殖及遷移運動,促進腫瘤生長,推進病程發展。細胞增殖需4個階段完成一次增殖周期,每個階段都存在細胞周期調控點,通過減緩或暫時中止細胞周期進程而提供細胞足夠時間糾正細胞周期中的錯誤,只有通過調控點,細胞才能進入下一階段完成增殖。若細胞周期調控點失去調控作用,可造成細胞生長、分裂失去控制,導致癌癥發生,中藥抗腫瘤機制主要為阻滯細胞周期和誘導細胞凋亡,黃芪和天花粉能通過阻滯細胞周期,從而抑制腫瘤細胞增殖,達到抗腫瘤作用[11-13]。本研究中MTT結果表明,黃芪和天花粉單藥及配伍均能抑制惡性黑色素瘤B16細胞增殖,且兩藥配伍后抑制B16細胞增殖效果較好。
轉移性強是惡性黑色素瘤另一特性,抑制腫瘤細胞遷移能抑制其進一步擴散,減緩腫瘤進程。相關研究表明,黑色素瘤細胞生長過程中,E-cadherin通常被N-cadherin替換,而N-cadherin可促成腫瘤細胞轉移。轉錄因子snail可活化N-cadherin的表達,抑制E-cadherin的表達,從而促進轉移的發生[14]。本研究中細胞劃痕實驗及Western blot結果顯示,黃芪和天花粉單藥及配伍均能抑制惡性黑色素瘤B16細胞遷移,且隨藥物濃度的升高抑制作用增強,具有濃度依賴性。黃芪和天花粉單藥均可增強E-cadherin蛋白表達,降低N-cadherin蛋白表達,兩藥配伍后效果更好,與劃痕實驗結果相符,說明兩藥起到協同作用,間接解釋了劃痕實驗中兩藥配伍后B16細胞愈合能力較單味藥差,兩藥配伍對細胞遷移的抑制更有效,這與文獻報道中腫瘤遷移的機制一致[14]。
綜上,黃芪和天花粉能通過抑制小鼠惡性黑色素瘤B16細胞的增殖及遷移運動,抑制腫瘤的生長及轉移,從而發揮抗腫瘤作用,其抑制細胞遷移機制與E-cadherin、N-cadherin蛋白表達相關。此外,不同配伍比例對細胞增殖和遷移作用不同,部分配伍能在增加對細胞增殖抑制作用的同時減少對細胞的損傷,這種抑制增殖的作用是否通過阻滯細胞周期進行仍需進一步研究證實,后期將繼續研究兩藥配伍后對細胞增殖和遷移的影響,進一步探討其作用機制,為臨床治療惡性黑色素瘤提供依據。
[1] 李楊,安方玉,明海霞,等.黃芪多糖對中波紫外線輻射皮膚角質形成細胞損傷的影響[J].中國中醫藥信息雜志,2016,23(5):44-46.
[2] 富琦,張青.郁仁存應用黃芪配伍治療惡性腫瘤臨床經驗總結[J].中國中醫藥信息雜志,2015,22(12):104-105.
[3] 陸婷婷,柯玲玲.黃芪多糖靶向腫瘤微環境的抗腫瘤作用機制[J].江西中醫藥大學學報,2019,31(1):107-111.
[4] 張喬,張琦,李靜.黃芪甲苷抗腫瘤作用研究進展[J].中醫藥信息, 2019,36(1):129-132.
[5] 宋京美,吳嘉瑞,姜迪.基于數據挖掘的國家級名老中醫治療腫瘤用藥規律研究[J].中國中醫藥信息雜志,2015,22(6):50-53.
[6] 劉翔.天花粉對人乳腺癌MCF-7細胞凋亡及相關基因表達的影響[J].中國臨床藥理學雜志,2018,34(7):841-844.
[7] 鄧心燕,楊玉,胡仁豪,等.天花粉蛋白抑制胃癌細胞生長及其分子機制研究[J].中國中西醫結合雜志,2018,38(8):958-962.
[8] 周海祥,卜平,董小耘,等.天花粉蛋白抗腫瘤作用及機制的研究進展[J].醫學綜述,2017,23(16):3197-3201.
[9] 張琳婧,梁羽茜,王媛媛,等.黃芪和天花粉配伍治療黑色素瘤的文獻挖掘[J].中醫藥學報,2019,47(1):43-47.
[10] 茅婧怡,周潔,張明,等.惡性黑色素瘤的中醫藥治療及研究進展[J].世界臨床藥物,2017,38(6):428-434.
[11] 劉小敏,盧琳琳,黃艷芳,等.黃芪水提物抑制PI3K/Akt通路預防肺癌發生的作用及機制研究[J].中草藥,2019,50(7):1621-1628.
[12] 胡俊媛,劉巧,楊穎,等.黃芪注射液影響人惡性黑色素瘤細胞增殖和遷移的實驗研究[J].遼寧中醫雜志,2015,42(4):819-823.
[13] 楊穎,劉巧,胡俊媛,等.中藥天花粉對人惡性黑色素瘤細胞形態、增殖、周期和遷移的影響[J].中醫藥學報,2015,43(2):30-34.
[14] ALADOWICZ E, FERRO L, VITALI G C, et al. Molecular networks in melanoma invasion and metastasis[J]. Future Oncol,2013,9(5):713-726.
Effects of Astragali Radix and Trichosanthis Radix on Cell Proliferation and Migration of Mouse Malignant Melanoma B16 Cells and Expressions of E-cadherin and N-cadherin
ZHANG Qiuyan, HUANG Songli, ZHANG Linjing, LIANG Yuxi, ZHAO Piwen, WEI Shengli, HU Xiuhua
To investigate the effects and mechanisms of Astragali Radix, Trichosanthis Radix and their compatibility on the proliferation and migration of mouse malignant melanoma B16 cells; To discuss its possible mechanism.MTT method was used to detect the proliferation of B16 cells. Based on the results, the drug concentration corresponding to the cell growth inhibition rate of 0% (IC0), the drug concentration corresponding to 25% (IC25), and the drug concentration corresponding to 50% (IC50) were calculated. Blank group and the compatible group (Astragalus IC0+ Trichosanthin IC0, Astragalus IC0+ Trichosanthin IC25, Astragalus IC0+ Trichosanthin IC50, Astragalus IC25+ Trichosanthin IC0, Astragalus IC25+ Trichosanthin IC25) were set. Cell scratch test was used to detect B16 cell migration; Western blot was used to detect the expressions of B16 cell migration related proteins E-cadherin and N-cadherin.MTT results showed that Astragali Radix and Trichosanthis Radixwith different concentrations could inhibit the proliferation of B16 cells in a dose-dependent manner. Results of cell scratch test showed that both Astragali Radix and Trichosanthis Radix would affect the scratch healing of B16 cells, inhibit cell migration, and were concentration-dependent. After the compatibility of Astragali Radix and Trichosanthis Radix, the inhibition rate of cell proliferation was significantly higher than that of the single Chinese materia medica, with statistical significance (<0.05). Western blot results showed that both Astragali Radix and Trichosanthis Radix increased the expression of E-cadherin protein and decreased the expression of N-cadherin protein.Both Astragali Radix and Trichosanthis Radix can inhibit cell proliferation and migration of malignant melanoma B16. The compatibility of Astragali Radix and Trichosanthis Radix have better efficacy than single Chinese materia medica. Its mechanism of inhibiting cell migration may be related to the protein expressions of E-cadherin and N-cadherin.
Astragali Radix; Trichosanthis Radix; B16 cells; cell proliferation; cell migration; compatibility

R285.5
A
1005-5304(2020)05-0028-07
10.3969/j.issn.1005-5304.201910097
國家自然科學基金(81673764);北京中醫藥大學校級自主課題(2017-JYB-XS-032);子洲黃芪規范化種植新技術開發研究(2020071720274)
胡秀華,E-mail:xiuhuahu@126.com
(2019-10-09)
(2019-11-01;編輯:華強)

