宮頸環形電切除術和冷刀錐切術對宮頸上皮內瘤變伴高危型人乳頭瘤病毒感染的療效觀察
程美萍 吳翊群 冷 英
(1.泰州市第三人民醫院,江蘇泰州 225321;2.泰州市人民醫院,江蘇泰州 225300)
女性生殖系統疾病中,宮頸癌屬于常見惡性腫瘤,發病率達到2%~3%,且呈年輕化趨勢[1]。最新中國癌癥統計數據顯示,中國宮頸癌的發病率仍在逐年增加。宮頸上皮內瘤變(CIN)屬于宮頸癌癌前病變,與宮頸癌的發病密切相關,早期發現早期治療CIN,對于降低宮頸癌的發病率有著至關重要的意義。雖然CIN一般無特殊癥狀,但隨著醫學技術的發展,CIN早期檢出率不斷提高。在誘發宮頸癌或CIN的病毒中,高危型人類乳頭瘤病毒(HR-HPV)感染屬于常見誘發因素,且CIN合并HR-HPV感染的患者中,宮頸癌發病率高出正常人群7倍以上[2]。所以,為了預防宮頸癌的發生,對CIN伴HR-HPV感染需及時進行有效的治療,以去除病灶、清除HPV,阻斷該病的進展轉化。目前針對宮頸上皮內瘤變的治療措施有冷凍、激光及子宮頸錐切術,對于年齡較大、無生育要求、合并其他有手術指征的婦科良性疾病的高級別上皮內瘤變也可以行全子宮切除術[3]。其中子宮頸錐切術又有子宮頸環形電切術(LEEP)和冷刀錐切術(CKC)之分,二者并存多年,臨床上對二者的療效差異有著不同的觀點。本研究對86例CIN伴HR-HPV感染患者采用子宮頸環形電切除術與冷刀錐切術治療的效果進行比對,結果如下。
1 資料與方法
1.1 一般資料
選取泰州市第三人民醫院2016年6月至2019年6月收治的86例患者作為研究對象,采用隨機數字表法分為觀察組(n=44)與對照組(n=42)。觀察組年齡21~ 56 歲,平均年齡(34.2±2.7)歲,其中CIN II級26例、CIN III級18例;對照組年齡22~57歲,平均年齡(34.6±2.5)歲,其中CIN II級24例、CIN III級18例。兩組患者一般資料相比,差異無統計學意義(P>0.05),具有可比性。所有入選患者均經宮頸細胞學篩查、陰道鏡檢查、組織病理學檢查等確診為CIN伴HR-HPV感染,均已婚,有性生活史;排除陰道分泌物檢查III~IV度者、急性生殖道感染者、宮頸萎縮者、宮頸治療史者、妊娠及哺乳期患者、盆腔放射史者等。本研究經泰州市第三人民醫院醫學倫理委員會審查通過。
1.2 方法
所有患者均選擇在月經結束后3~7 d內進行手術。術前3 d禁止性生活并進行白帶化驗,排除陰道炎癥。觀察組進行宮頸環形電切除術治療,對照組進行冷刀錐切術治療。手術前排空膀胱,宮頸環形電切除術無需麻醉,冷刀錐切術采用腰硬聯合麻醉或全身麻醉,取膀胱截石位。給予常規消毒鋪巾,對子宮頸采用窺陰器進行暴露后再次消毒,在整個宮頸及穹窿部涂抹碘酊液,明確病變范圍。冷刀錐切術:用鼠齒鉗牽拉宮頸,將垂體后葉素稀釋液注射到宮頸間質內,在碘未著色區域外0.5 cm處做環形切口,然后垂直進刀環切,以宮頸管為軸線,呈30 °角向內逐漸切入宮頸深部,對宮頸病變組織進行切除,錐高2~3 cm;采用電凝方法對創面進行止血,然后采用可吸收線進行縫合,對宮頸口形態進行再造,檢查宮頸是否暢通,無異常后用一卷碘伏紗布進行填塞壓迫止血,留置導尿管,術畢。宮頸環形電切除術:根據病變大小,對電切環型號進行選擇,從9點處開始做環形病變組織切除,以順時針方向進行切除,深度15 mm,如果患者病灶范圍比較大,分次進行病灶切除,采用球形電極電凝對創面進行止血,術畢。術后兩組均給予常規抗生素預防感染。
1.3 觀察指標
對兩組手術時間、術中出血量進行對比。
術后對兩組病灶殘留率(各組切緣陽性患者例數/各組總例數×100%)進行對比;術后3個月,對兩組愈合率(各組創面已愈合例數/各組總例數×100%)進行對比;術后6個月,對兩組復發率(各組復查細胞學檢查陽性例數/各組總例數×100%)及HPV轉陰率(各組HPV轉陰患者例數/各組總例數×100%)進行對比。
1.4 統計學分析
2 結果
2.1 兩組患者手術相關指標比較
在手術時間、術中出血量方面對比,觀察組均少于對照組,差異有統計學意義(P<0.05),見表1。
2.2 兩組患者治療效果比較
在病灶殘留率、愈合率、復發率及HPV感染轉陰率方面對比,兩組差異均無統計學意義(P>0.05),見表2。
表1 兩組患者手術指標比較(±s)

表1 兩組患者手術指標比較(±s)
組別 手術時間(min) 術中出血量(mL)觀察組(n=44) 15.27±5.44 12.04±6.28對照組(n=42) 24.93±7.91 27.84±9.46 t 4.527 7.436 P<0.05 <0.05
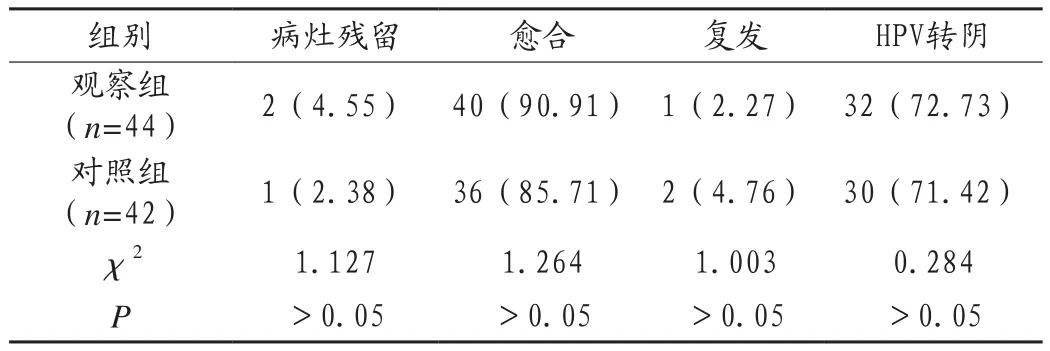
表2 兩組患者治療效果比較[例(%)]
3 討論
宮頸上皮內瘤變屬于宮頸癌的癌前病變,根據病變程度可分為CIN I、CIN II、CIN III,有研究顯示,我國宮頸癌癌前病變發生率方面,CIN I、CIN II、CIN III發病率分別為3.1%、1.5%及1.2%,很多時候CIN I、CIN II可不經過CIN III而直接發展為浸潤癌[4]。CIN發展為宮頸浸潤癌的病因目前未完全明確,但諸多研究顯示,機體免疫力低下、吸煙、過早性生活、多個性伴侶、口服避孕藥及HR-HPV感染等為CIN發展為宮頸浸潤癌的高危因素[5-6]。其中HRHPV的持續感染被普遍認為是宮頸發生病變的必要條件[7-8]。HR-HPV的及時清除可有效預防宮頸癌的發生。隨著醫學及科技的發展,CIN及HR-HPV的早期檢出率有了大幅提升,及早進行干預治療,為宮頸癌的消滅提供了可能。因此,創傷小、安全性高的治療方法受到廣泛關注。
如前所述,CIN有多種治療手段,其中冷凍、激光等消融治療病灶清除不徹底,不宜用于高級別上皮內瘤變、陰道鏡檢查不充分或者頸管搔刮陽性者。而全子宮切除術,創傷大,患者再無月經及生育能力,為大多患者所不能接受,故而目前針對宮頸上皮內瘤變應用最廣泛的治療措施是宮頸錐切。其既是避免CIN發展為浸潤癌的主要術式,也是排除宮頸浸潤癌的一種診斷措施。根據手術術式的差異,目前臨床中主要包含宮頸環形電切除術(LEEP)及冷刀錐切術(CKC)等術式。其中宮頸環形電切除術因在臨床中應用具有操作簡單、手術時間短、創傷小、安全性高等優勢,應用范圍比較廣[9];但有研究顯示,部分患者采用宮頸環形電切除術治療后,會出現所切組織切緣陽性情況,可存在CIN病灶殘留[10]。但是本次研究顯示,在CIN伴HR-HPV感染患者的治療中,分別采用宮頸環形電切除術與冷刀錐切術,二者在病灶殘留率、愈合率、復發率及HPV感染轉陰率方面差異均無統計學意義(P>0.05),表明在CIN伴HR-HPV感染患者的治療中,兩種術式均能達到較好的病灶清除及HPV轉陰作用,宮頸上皮內瘤變錐切術后復發的高風險因素常有高危型HPV持續感染,細胞學異常和宮頸組織切緣陽性[11],而上述兩種術式病灶清除及HPV轉陰率均無明顯差異,愈合率、復發率近似,均有較好的療效。然而在手術時間、術中出血量上對比,觀察組均低于對照組(P<0.05),表明宮頸環形電切除術對CIN伴HR-HPV感染患者進行治療,相比冷刀錐切術,創傷較小,手術時間較短。
綜上所述,在對CIN伴HR-HPV感染患者的治療中,宮頸環形電切除術與冷刀錐切術均能達到較好的治療效果,但宮頸環形電切除術切除宮頸過程中可同時電凝止血,出血量少,手術時間短,患者所受痛苦少,而且LEEP刀有多種不同的刀頭和切割手法,有利于更完全的切除病變組織,以減少病灶殘留,且對宮頸形態破壞小,可多次重復手術,更有利于患者術后恢復,值得推廣應用。

