基于適配體/金納米粒子的“開-關(guān)”型熒光探針快速測定水胺硫磷
鄒小波 蔣彩萍 李志華 孫悅 石吉勇 李艷肖 黃曉瑋 張迪 胡雪桃 翟曉東 魏曉鷗
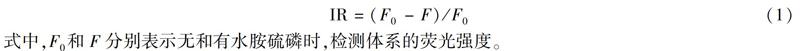

摘?要?基于適配體和金納米粒子(Gold nanoparticles,AuNPs)合成“開-關(guān)”型熒光探針,用于快速、靈敏、高選擇性測定水胺硫磷。5'端連接熒光素(6-Carboxyfluorescein,F(xiàn)AM)的發(fā)卡型水胺硫磷適配體互補(bǔ)鏈(Complementary strand,cDNA)通過修飾于3'端的巰基連接到AuNPs表面,F(xiàn)AM(熒光信號分子)與AuNPs(熒光猝滅劑)間發(fā)生熒光共振能量轉(zhuǎn)移效應(yīng) (Fluorescence resonance energy transfer,F(xiàn)RET),導(dǎo)致熒光猝滅。加入水胺硫磷適配體(Isocarbophos-binding aptamer,ICP-Aptamer)與cDNA雜交,cDNA發(fā)卡構(gòu)型被打開,使熒光信號恢復(fù)。當(dāng)體系中存在水胺硫磷時,ICP-Aptamer與其特異性結(jié)合,導(dǎo)致與cDNA解離,cDNA發(fā)卡型結(jié)構(gòu)重新恢復(fù),使熒光信號猝滅。采用透射電鏡、紫外-可見光譜、Zeta電位表征納米粒子特性,優(yōu)化了實(shí)驗(yàn)參數(shù),包括pH值、ICP-Aptamer濃度、溫育時間和溫育溫度。在優(yōu)化的實(shí)驗(yàn)條件下,在0.02~10 μmol/L線性范圍內(nèi),水胺硫磷濃度與熒光抑制率呈良好的線性關(guān)系,檢出限為17.8 nmol/L(3σ)。將此熒光探針應(yīng)于大米、菠菜樣品中水胺硫磷的測定,回收率均為92.9%~107.0%,相對標(biāo)準(zhǔn)偏差小于4.2%,表明此熒光探針在農(nóng)藥的檢測和食品安全的監(jiān)測中具有潛在的應(yīng)用價值。
關(guān)鍵詞?熒光探針;“開-關(guān)”型;適配體;金納米粒子;水胺硫磷
1?引 言
有機(jī)磷農(nóng)藥作為應(yīng)用最廣泛的一類化學(xué)農(nóng)藥,常被用作殺菌劑、除草劑和殺蟲劑[1]。然而,由于有機(jī)磷農(nóng)藥的半衰期長,不當(dāng)?shù)氖褂眉疤幚砭鶗?dǎo)致其在農(nóng)作物、環(huán)境和水資源中殘留,甚至?xí)ㄟ^食物鏈富集于人畜體內(nèi),危害人體健康,導(dǎo)致不孕、呼吸系統(tǒng)疾病、神經(jīng)系統(tǒng)疾病等[2]。水胺硫磷是一種被普遍應(yīng)用的乙酰膽堿酯酶抑制劑有機(jī)磷農(nóng)藥,具有廣譜的高殺蟲毒性,主要用于防治鱗翅目、同翅目和螨類害蟲。由于其高毒性,水胺硫磷雖仍廣泛施用于棉花和水稻作物中,但現(xiàn)已被我國禁用于果蔬和茶葉中[3]。然而,在一些地區(qū),水胺硫磷仍被發(fā)現(xiàn)大量殘留于果蔬、大米等多種農(nóng)作物中。因此,建立快速、靈敏、簡便、高效的檢測方法對于保障食品安全具有重要意義。
目前,對水胺硫磷的檢測主要采用儀器分析技術(shù)[4],例如高效液相色譜法(High performance liquid chromatography,HPLC[5])、氣相色譜-質(zhì)譜聯(lián)用法(Gas chromatography-mass spectroscopy,GC-MS[6])等,以及免疫學(xué)檢測技術(shù)例如酶聯(lián)免疫吸附法[7]、免疫親和柱法[8]等。 這些分析方法分離能力高、靈敏度高、定量精確,但樣品前處理過程復(fù)雜、成本高、費(fèi)時長,需專業(yè)人員操作處理。與熒光光譜法[9]、拉曼光譜法[10]以及電化學(xué)信號[11]相結(jié)合的納米探針,因其具有響應(yīng)速度快、成本低、特異性好等特點(diǎn)而備受關(guān)注。納米生物探針結(jié)合了納米材料與生物活性物質(zhì),采用酶[12]、抗體[13]等生物分子作為識別元件,特異性識別待檢測物質(zhì);同時,基于納米材料(如金納米粒子[13]、碳量子點(diǎn)[14~15]、石墨烯[16~17]、聚苯胺[18]、磁性納米粒子[19~20]等)轉(zhuǎn)換或增強(qiáng)其傳感信號。
酶、抗體等生物活性分子制備困難,對環(huán)境因素敏感,對檢測的準(zhǔn)確性有較大影響。功能性核酸(如適配體)因具有易于制備、低免疫原性、高化學(xué)穩(wěn)定性等優(yōu)點(diǎn),已經(jīng)成為研究的熱點(diǎn)[21]。Taghdisi等[22]制備了基于金納米粒子(Gold nanoparticles,AuNPs)、發(fā)卡型結(jié)構(gòu)的適配體互補(bǔ)鏈以及硫堇的電化學(xué)適配體探針,當(dāng)目標(biāo)物Pb2+存在時,適配體互補(bǔ)鏈形成發(fā)卡結(jié)構(gòu),硫堇-AuNPs絡(luò)合物無法與其復(fù)合,導(dǎo)致體系產(chǎn)生微弱的電化學(xué)信號;當(dāng)不存在目標(biāo)物Pb2+時,硫堇-AuNPs絡(luò)合物與適配體互補(bǔ)鏈共軛復(fù)合,體系產(chǎn)生強(qiáng)電化學(xué)信號。Emrani等[23]構(gòu)建了以發(fā)卡型結(jié)構(gòu)的適配體體系為識別元件的熒光探針,用于檢測可卡因,檢出限低至0.07 ng/mL。
本研究以6-羧基熒光素(6-Carboxyfluorescein,F(xiàn)AM)為熒光信號分子,AuNPs為熒光猝滅劑,水胺硫磷適配體(Isocarbophos-binding aptamer,ICP-Aptamer)為識別元件,發(fā)卡型水胺硫磷適配體互補(bǔ)鏈(Complementary strand,cDNA)為結(jié)構(gòu)型“信號開關(guān)”,制備了可特異性識別水胺硫磷的“開-關(guān)”型熒光探針。此熒光探針通過發(fā)卡型cDNA的構(gòu)型變化,以及FAM-AuNPs供受體間的熒光共振能量轉(zhuǎn)移效應(yīng)(Fluorescence resonance energy transfer,F(xiàn)RET),將水胺硫磷的含量信息轉(zhuǎn)變?yōu)橄鄳?yīng)的熒光信號,實(shí)現(xiàn)水胺硫磷的定量檢測,并將此“開-關(guān)”型熒光探針用于大米和菠菜中水胺硫磷的定量檢測。
2?實(shí)驗(yàn)方法
2.1?儀器、試劑與材料
VIS-7220N可見分光光度儀(北京瑞利分析儀器有限公司);F-98熒光分光光度計(jì)(上海棱光技術(shù)有限公司);QuantaMasterTM 40熒光光譜儀(美國PTI公司);JEM-2100透射電子顯微鏡(TEM,日本電子株式會社);Nano ZS90納米粒度儀及Zeta電位儀(英國馬爾文公司);TGL-15B高速離心機(jī)(上海安亭科學(xué)儀器廠)。
HAuCl4·4H2O、檸檬酸三鈉、十二烷基硫酸鈉、三(2-羧乙基)膦鹽酸鹽(Tris (2-carboxyethyl) phosphine hydrochloride,TCEP)、二水合雙(對-磺酰苯基)苯基膦化二鉀鹽(Bis (p-sulfonatophenyl) phenylphosphine dihydrate dipotassium salt,BSPP)、三(羥甲基)氨基甲烷(Tris-HCl)等試劑均購自鎮(zhèn)江華東器化玻有限公司。ICP-Aptamer (序列5'-AAGCTTGCTTTATAGCCTGCAGCGATTCTTGATCGGAAAAGGCTGAGAGCTACGC-3')、5'和3'端分別修飾有FAM、巰基的cDNA(序列5'-FAM-CTGCACAAGAATCGCTGCAG-C3-SH-3')[24]由生工生物工程(上海)股份有限公司合成。水胺硫磷、毒死蜱、敵敵畏、樂果、馬拉硫磷、甲基對硫磷、辛硫磷、三唑磷、敵百蟲、啶蟲脒、吡蟲啉等農(nóng)藥標(biāo)準(zhǔn)品均購于北京世紀(jì)奧科生物技術(shù)有限公司。所用試劑均為分析純,實(shí)驗(yàn)用水為采用Easypure 超純水系統(tǒng)純化的超純水。
大米、菠菜樣品購自鎮(zhèn)江市超市。
2.2?“開-關(guān)”型熒光探針的制備
2.2.1?AuNPs的制備?參考Frens-Turkevich方法[25]并稍作改進(jìn),通過檸檬酸鹽還原HAuCl4·4H2O的方法制備13 nm AuNPs。將10 mL 1 mmol/L HAuCl4·4H2O溶液加入帶有回流冷凝器的圓底燒瓶中,置于恒溫電磁攪拌器,水浴加熱至劇烈沸騰,迅速加入1 mL 60 mmol/L 檸檬酸三鈉,溶液顏色由淡黃色變?yōu)闊o色。在100℃條件下劇烈攪拌15 min,至溶液變?yōu)榫萍t色。停止加熱,冷卻至室溫。加入3 mg BSPP,并繼續(xù)攪拌15 min,防止顆粒聚集。將得到的AuNPs過0.22 μm濾膜,于4℃保存,備用。
2.2.2?熒光探針的制備?將合成的AuNPs以10000 r/min離心15 min,棄去上清液,將沉淀物重懸于4.5 mL 10 mmol/L磷酸鹽緩沖溶液(PBS,pH 8.0,含0.01% 十二烷基硫酸鈉(SDS))。將10 μL 500 mmol/L醋酸緩沖溶液(pH 5.2)、20 μL 10 mmol/L TCEP(現(xiàn)配現(xiàn)用)和100 μL 100 μmol/L cDNA混合均勻,在室溫下孵育1 h,然后與上述AuNPs溶液混合,室溫下避光孵育過夜。
向上述反應(yīng)溶液中加入50 μL 10 mmol/L PBS (pH 8.0,0.01% SDS,100 mmol/L NaCl),在室溫下孵育30 min,使cDNA與AuNPs復(fù)合。5000 r/min離心10 min,去除多余的cDNA。
將cDNA-AuNPs復(fù)合物重懸于10 mmol/L PBS(pH 8.0)中,使cDNA-AuNPs復(fù)合物終濃度為500 nmol/L。 在500 μL上述復(fù)合溶液中[26,27],加入10 μL 40 μmol/L ICP-Aptamer和10 μL 10 mmol/L PBS(pH 8.0,50 mmol/L NaCl,10 mmol/L KCl,10 mol/L MgCl2,50 mmol/L Tris),60℃溫育10 min,冷卻至室溫,即達(dá)到熒光探針溶液的動態(tài)平衡。
2.3?水胺硫磷的檢測
將不同濃度的水胺硫磷標(biāo)準(zhǔn)溶液(0.02、0.04、0.06、0.08、0.1、0.2、0.4、0.6、0.8、1.0、2.0、4.0、6.0、8.0和10.0 μmol/L)分別與上述熒光探針溶液混合,靜置10 min,測定熒光光譜,激發(fā)波長為495 nm。 按公式(1)計(jì)算熒光抑制率(Inhibition ratio,IR),重復(fù)實(shí)驗(yàn)3次,取平均值。
2.4?大米和菠菜樣品中水胺硫磷的檢測
在10 g大米樣品中加入5 mL去離子水和20 mL乙腈,勻漿10 min后,再超聲處理30 min,使其混合均勻。過濾,65℃旋轉(zhuǎn)蒸發(fā),進(jìn)行濃縮。用PBS(pH 8.0)將濃縮液稀釋100倍,過0.22 μm濾膜,備用。菠菜樣品的預(yù)處理方法與大米樣品一致。按照2.3節(jié)方法對樣品中水胺硫磷進(jìn)行檢測,并進(jìn)行加標(biāo)回收實(shí)驗(yàn)。
3?結(jié)果與分析
3.1?檢測原理
基于發(fā)卡型cDNA的構(gòu)型變化以及FAM-AuNPs供受體間的FRET效應(yīng)的“開-關(guān)”型熒光探針檢測水胺硫磷的原理如圖1所示。其中,ICP-Aptamer為識別元件,F(xiàn)AM為熒光信號分子,AuNPs為熒光猝滅劑,cDNA為結(jié)構(gòu)型“信號開關(guān)”。
3'端的巰基將發(fā)卡型cDNA通過AuS鍵連接到AuNPs上。由于發(fā)卡型cDNA5'端熒光信號分子FAM靠近猝滅劑AuNPs的表面,F(xiàn)AM與AuNPs之間的FRET效應(yīng)成功猝滅了FAM的熒光信號。隨著ICP-Aptamer的加入,ICP-Aptamer與cDNA互補(bǔ)雜交,cDNA發(fā)卡型結(jié)構(gòu)被打開,F(xiàn)AM遠(yuǎn)離AuNPs表面,不再發(fā)生FRET,因此,伴隨顯著的熒光“開啟”,在495 nm激發(fā)波長下的FAM熒光信號恢復(fù)。當(dāng)檢測體系中加入靶標(biāo)水胺硫磷后,ICP-aptamer與水胺硫磷之間的特異性親和力使得ICP-aptamer優(yōu)先與水胺硫磷結(jié)合,從而造成ICP-aptamer與互補(bǔ)的cDNA發(fā)生解鏈,cDNA發(fā)卡型結(jié)構(gòu)重新恢復(fù),F(xiàn)AM與AuNPs之間的FRET效應(yīng)使熒光信號猝滅,熒光“關(guān)閉”。
3.2?AuNPs和熒光探針的表征
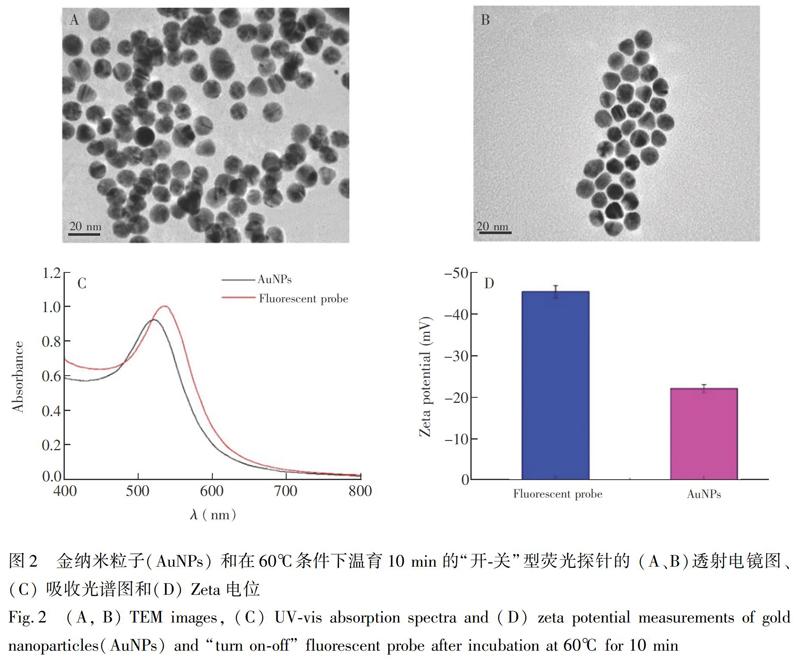
如圖2A和2B的電鏡圖所示,所制備的AuNPs呈現(xiàn)良好的單分散狀態(tài)。隨著發(fā)卡型cDNA組裝到AuNPs表面,復(fù)合粒子的水動力半徑由12.8 nm增加到19.8 nm。由于ICP-Aptamer體系的相對剛性結(jié)構(gòu)對體系的保護(hù)以及體系達(dá)到的動態(tài)平衡,復(fù)合粒子趨于規(guī)則且穩(wěn)定的條帶狀分布。由圖2C可知,隨著AuNPs和cDNA的復(fù)合,復(fù)合粒子的共振吸收峰相比AuNPs發(fā)生紅移(由521 nm紅移至534 nm),峰強(qiáng)變強(qiáng),進(jìn)一步表明發(fā)卡型cDNA成功修飾到了AuNPs表面[28]。通過測定Zeta電位值可進(jìn)一步探明AuNPs和cDNA復(fù)合過程中體系的穩(wěn)定性和復(fù)合粒子的表面狀況[29]。所制備的AuNPs表面帶負(fù)電(22.07 mV),當(dāng)發(fā)卡型cDNA通過巰基連接到AuNPs上時,Zeta電位為45.48 mV,體系狀態(tài)逐漸趨于平衡和穩(wěn)定,復(fù)合粒子粒徑變大。
3.3?熒光共振能量轉(zhuǎn)移體系
“開-關(guān)”型熒光探針通過cDNA-AuNPs供受體間的熒光共振能量轉(zhuǎn)移(FRET)效應(yīng)[30,31],實(shí)現(xiàn)檢測體系熒光信號的“開啟”和“關(guān)閉”。在此檢測體系中,F(xiàn)AM作為熒光供體,AuNPs作為受體。如圖3A所示,F(xiàn)AM的熒光發(fā)射峰和AuNPs的紫外吸收峰分別為518和521 nm,兩峰幾乎完全重疊;當(dāng)cDNA通過3'端的巰基連接到AuNPs上時,cDNA由于自身堿基互補(bǔ)配對形成發(fā)夾型結(jié)構(gòu),5'端連接的FAM靠近AuNPs,AuNPs猝滅FAM熒光。通過公式(2)估算FRET猝滅效率(Q):
式中,F(xiàn)0' 表示FAM的熒光強(qiáng)度,F(xiàn)'為FAM-AuNPs復(fù)合粒子的熒光強(qiáng)度,B是背景熒光強(qiáng)度。
加入AuNPs后,Q>83%,表明 AuNPs 對 FAM熒光有較好的猝滅作用。熒光壽命可作為評判一個FRET體系的關(guān)鍵因素,通過圖3B可從熒光壽命衰減動力學(xué)角度分析cDNA-AuNPs 的FRET體系。加入AuNPs后,F(xiàn)AM的熒光壽命由4.11 ns下降為3.37 ns,且熒光被有效猝滅,表明FAM-AuNPs供受體間為動態(tài)猝滅[32]。
3.4?實(shí)驗(yàn)條件的優(yōu)化
pH值、ICP-Aptamer濃度、溫育時間和溫育溫度等因素均會影響熒光探針檢測靈敏性和準(zhǔn)確性。除pH值、ICP-Aptamer濃度、溫育時間、溫育溫度以外,固定其它實(shí)驗(yàn)條件,向反應(yīng)溶液加入適量 5 μmol/L水胺硫磷溶液,混合均勻。在同一體系中,通過比較熒光抑制率衡量熒光探針性能。在pH 5.0~11.0范圍內(nèi),測定不同pH值下檢測體系在水胺硫磷加入后的的熒光抑制率,結(jié)果如圖4A所示,當(dāng)體系pH值為8.0時,其熒光抑制率最大;當(dāng)pH值過高或過低時,由強(qiáng)酸堿或高離子強(qiáng)度引起的屏蔽效應(yīng)、AuNPs的團(tuán)聚現(xiàn)象等均會抑制FRET猝滅效率。由圖4B可知,加入10 μL ICP-Aptamer時,體系的熒光抑制率達(dá)到最大,這可能是因?yàn)镮CP-Aptamer與DNA的雜交趨于飽和,繼續(xù)增加ICP-Aptamer含量,體系熒光抑制率基本不變。當(dāng)溫育時間和溫育溫度分別為10 min(圖4C)和60℃(圖4D)時,體系熒光抑制率達(dá)到最大值。
3.5?“開-關(guān)”型熒光探針對水胺硫磷的靈敏檢測
在優(yōu)化的實(shí)驗(yàn)條件下,將“開-關(guān)”型熒光探針用于水胺硫磷的檢測。如圖5所示,在0.02~10 μmol/L的濃度范圍內(nèi),隨著水胺硫磷濃度的增大,檢測體系在518 nm處熒光值逐漸降低,熒光抑制率與水胺硫磷濃度呈良好的線性關(guān)系,回歸方程為y=0.015x + 0.769 (R2=0.998),檢出限(LOD)為17.8 nmol/L (3σ),低于大多數(shù)文獻(xiàn)報(bào)道的方法 (表1)。
3.6?“開-關(guān)”型熒光探針對水胺硫磷的選擇性
在相同的實(shí)驗(yàn)條件下,測定“開-關(guān)”型熒光探針對水胺硫磷、毒死蜱、敵敵畏、樂果、馬拉硫磷、甲基對硫磷、辛硫磷、三唑磷、敵百蟲、啶蟲脒、吡蟲啉等農(nóng)藥的熒光信號,水胺硫磷的濃度為5 μmol/L,其它農(nóng)藥的濃度為50 μmol/L。 如圖6所示,對水胺硫磷,檢測體系的熒光強(qiáng)度發(fā)生顯著變化,熒光抑制率為84%,檢測其它農(nóng)藥時,檢測體系熒光強(qiáng)度均無明顯變化,熒光抑制率較低。結(jié)果表明,“開-關(guān)”型熒光探針對水胺硫磷有較好的選擇性與特異性,這主要?dú)w因于ICP-Aptamer特有的核苷酸序列,以及特異性結(jié)合靶標(biāo)前后特有的二級、三級結(jié)構(gòu),即ICP-Aptamer對水胺硫磷所具有的特異性識別的莖、環(huán)結(jié)構(gòu)以及在特異性識別過程中結(jié)構(gòu)的旋轉(zhuǎn)與折疊等[24]。
3.7?大米、菠菜樣品中水胺硫磷的檢測
采用“開-關(guān)”型熒光探針檢測大米、菠菜樣品中的水胺硫磷,評估其在檢測實(shí)際樣品中水胺硫磷的可行性。同時,采用氣相色譜法(GC)測定水胺硫磷含量。大米、菠菜樣品中未檢出水胺硫磷,5個添加水平下的加標(biāo)回收實(shí)驗(yàn)結(jié)果如表2所示,回收率為92.9%~107.0%,相對標(biāo)準(zhǔn)偏差(RSD)小于4.2%,檢測結(jié)果與GC方法一致。結(jié)果表明,本研究建立的基于適配體/金納米粒子的“開-關(guān)”型熒光探針用于水胺硫磷含量的測定,具有較好精確度和準(zhǔn)確度。
4?結(jié) 論
基于水胺硫磷的適配體和金納米粒子,制備了“開-關(guān)”型熒光探針,在0.02~10 μmol/L的濃度范圍內(nèi),水胺硫磷濃度與熒光抑制率呈良好的線性關(guān)系。將此探針用于大米和菠菜樣品中水胺硫磷的檢測,其結(jié)果與氣相色譜法具有較好的一致性。此熒光探針具有檢出限低、操作簡單、靈敏度高、準(zhǔn)確度高、重現(xiàn)性好的特點(diǎn),在農(nóng)藥等痕量物質(zhì)的分析測定中具有良好的應(yīng)用前景。
References
1?Pundir C S,Malik A,Preety. Biosens. Bioelectron.,2019,140: 111348
2?Qiu L H,Lv P,Zhao C L,F(xiàn)eng X Y,F(xiàn)ang G Z,Liu J F,Wang S. Sens. Actuators B,2019,286: 386-393
3?Jia M,Wang Y,Teng M M,Wang D Z,Yan J,Miao J Y,Zhou Z Q,Zhu W T. Ecotox. Environ. Safe.,2018,163: 1-6
4?GB 24753-2009,Isocarbophos Technical. National Standards of the People's Republic of China水胺硫磷原藥. 中華人民共和國國家標(biāo)準(zhǔn). GB 24753-2009
5?Timofeeva I,Shishov A,Kanashina D,Dzema D,Bulatov A. Talanta,2017,167: 761-767
6?Taha S M,Gadalla S A. Talanta,2017,174: 767-779
7?Zhang C,Cui H Y,Han Y F,Yu F F,Shi X M. Food Chem.,2018,240: 893-897
8?Senyuva H Z,Gilbert J. J. Chromatogr. B,2010,878 (2): 115-132
9?Pan J F,Li Q,Zhou D H,Chen J H. Talanta,2018,189: 370-376
10?Sun Y,Li Z H,Huang X W,Zhang D,Zou X B,Shi J Y,Zhai X D,Jiang C P,Wei X O,Liu T T. Biosens. Bioelectron.,2019,145,111672
11?Fu J Y,An X S,Yao Y,Guo Y M,Sun X. Sens. Actuators B,2019,287: 503-509
12?Jia L P,Zhou Y X,Wu K P,F(xiàn)eng Q L,Wang C M,He P. Bioelectrochemistry,2020,131: 107392
13?Pérez-Fernández B,Mercader J V,Abad-Fuentes A,Checa-Orrego B I,Costa-Garcia A,de la Escosura-Muiz A,Costa-García A. Talanta,2019,209: 120465
14?Hu X T,Shi J Y,Shi Y Q,Zou X B,Tahir H E,Holmes M,Zhang W,Huang X W,Li Z H,Xu Y W. Meat Sci.,2019,147: 127-134
15?ZOU Xiao-Bo,SHI Yong-Qiang,ZHENG Yue,SHI Ji-Yong,HU Xue-Tao,JIANG Cai-Ping,HUANG Xiao-Wei,XU Yi-Wei. Chiness J. Anal. Chem.,2018,46(6): 960-968
鄒小波,史永強(qiáng),鄭 悅,石吉勇,胡雪桃,蔣彩萍,黃曉瑋,徐藝偉. 分析化學(xué),2018,46(6): 960-968
16?Zhang W,Xu Y W,Zou X B. Food Chem.,2018,261: 1-7
17?Li Z H,Zhou X C,Wang K,Zou X B,Shi J Y,Huang X Y,Holmes M. Innov. Food Sci. Emerg.,2015,31: 196-203
18?Li Z H,Zhou X C,Shi J Y,Zou X B,Huang X Y,Tahir H E. Food Chem.,2019,276: 291-297
19?Xu X C,Niu X H,Wu S W,Zou X B,Pan J M. Sens. Actuators B,2018,268: 430-437
20?ZHANG Jing-Jing,KANG Tian-Fang,LU Li-Ping,CHENG Shui-Yuan. Anal. Chem.,2016,44 (5): 760-766
張晶晶,康天放,魯理平,程水源. 分析化學(xué),2016,44 (5): 760-766
21?ZOU Xue-Mei,ZHOU Jia-Wei,SONG Shang-Hong,CHEN Guan-Hua. Anal. Chem.,2019,47 (4): 488-499
鄒雪梅,周佳偉,宋尚紅,陳冠華. 分析化學(xué),2019,47 (4): 488-499
22?Taghdisi S M,Danesh N M,Lavaee P,Ramezani M,Abnous K. Sens. Actuators B,2016,234: 462-469
23?Emrani A S,Danesh N M,Ramezani M,Taghdisi S M,Abnous K. Biosens. Bioelectron.,2016,79: 288-293
24?Zhang C Z,Wang L,Tu Z,Sun X,He Q H,Lei Z J,Xu C X,Liu Y,Zhang X,Yang J Y,Liu X J,Xu Y. Biosens. Bioelectron.,2014,55: 216-219
25?Turkevich J,Stevenson P C,Hillier J. Discuss. Faraday Soc.,1951,11: 55-75
26?Tang T T,Deng J J,Zhang M,Shi G Y,Zhou T S. Talanta,2016,146,55-61
27?Yao G B,Pei H,Li J,Zhao Y,Zhu D,Zhang Y N,Lin Y F,Huang Q,F(xiàn)an C H. NPG Asia Mater.,2015,7 (1): e159
28?Haiss W,Thanh N T K,Aveyard J,F(xiàn)ernig D G. Anal. Chem.,2007,79 (11): 4215-4221
29?Asati A,Santra S,Kaittanis C,Perez J M. ACS Nano,2010,4 (9): 5321-5331
30?Liu B Y,Zeng F,Wu S Z,Wang J S,Tang F C. Microchim. Acta,2013,180 (9): 845-853
31?Hu X T,Shi J Y,Shi Y Q,Zou X B,Arslan M,Zhang W,Huang X W,Li Z H,Xu Y Y. Food Chem.,2019,272: 58-65
32?Wang L,Li H,Yang Y,Zhang D,Wu M,Pan B,Xing B S. Water Res.,2017,122: 337-344
33?WANG Li,YE Hua,SANG Hong-Qing,WANG Dan-Dan. Chinese J.Anal. Chem.,2016,44 (5): 799-803
王 麗,葉 華,桑宏慶,王丹丹. ?分析化學(xué),2016,44 (5): 799-803
34?Yan X N,Deng J,Xu J S,Li H,Wang L L,Chen D,Xie J. Sens. Actuators B,2012,171-172: 1087-1094
35?Shi Q W,Teng Y J,Zhang Y C,Liu W H. Chinese Chem. Lett.,2018,29 (9): 1379-1382
36?Pang S,Labuza T P,He L L. Analyst,2014,139: 1895-1901
37?Bai W H,Zhu C,Liu J C,Yan M M,Yang S M,Chen A L. Environ. Toxicol.Chem.,2015,34 (10): 2244-2249

