亞低溫聯合阿替普酶對急性腦梗死患者腦血流和神經功能恢復的影響
魏 俊,楊 珉,王 威
0 引 言
腦梗死發病率、復發率均較高,其中動脈粥樣硬化是其發病基礎[1]。既往機制研究提示腦梗死發病時,體內可在短時間內出現大量炎性因子和氧自由基,致使神經元炎癥反應及過氧化損傷,其中活性氧簇被公認為是腦梗死的基本發病機制[2]。靜脈溶栓是挽救腦梗死的重要方法,能夠有效恢復患者的血液循環,阿替普酶(alteplase,rt-PA)屬于重要的靜脈溶栓藥物,主要通過激活纖溶酶原發揮溶解血栓的作用[3]。此外,為提高腦梗死的治療效果本研究嘗試將亞低溫療法與阿替普酶聯合用藥,亞低溫已在顱腦損傷及腦血管的治療中廣泛應用,具有調節器官局部血液循環的重要作用[4]。故而,本研究探討亞低溫聯合阿替普酶治療急性腦梗死(acute cerebral infarction,ACI)患者對腦血流和神經功能恢復的影響,現報道如下。
1 資料與方法
1.1 臨床資料回顧性分析2017年3月至2018年3月我院神經外科收治的97例ACI患者的臨床資料。納入標準[5]:①ACI患者的診斷標準參考2016年版《急性缺血性腦卒中治療指南》中的標準;②起病至溶栓時間間隔<4.5 h;③入院后經頭部CT、MRI檢查確診為大腦中動脈供血區或頸內動脈系統急性梗死;④治療前獲得患者家屬的知情同意;⑤患者入院時的美國國立研究院卒中量表(NIHSS)評分范圍4~20分。排除標準:①短暫性腦缺血發作;②出血性腦卒中;③顱內腫瘤、腦血管畸形;④既往具有顱腦外傷病史;⑤精神疾病、認知功能障礙;⑥合并凝血功能障礙、活動性出血性疾病患者。根據治療方法不同分為亞低溫組48例、對照組49例。亞低溫組患者年齡52~83歲,平均(64.5±9.4)歲,男27例、女21例;起病至溶栓治療時間間隔(2.8±1.0)h;入院時患者的NIHSS評分(14.2±3.7)分;合并疾病:高血壓28例、糖尿病19例、冠心病7例、血脂異常23例。對照組患者年齡47~81歲,平均(63.8±10.2)歲,男30例、女19例;起病至溶栓治療時間間隔(2.7±1.2)h;入院時患者的NIHSS評分(13.9±3.0)分;合并疾病:高血壓24例、糖尿病14例、冠心病4例、血脂異常27例。2組患者的年齡、性別、溶栓時間窗、NIHSS評分、合并疾病比較,差異均無統計學意義(P>0.05)。
1.2 治療方法所有患者均接受降顱內壓、吸氧、抗凝藥物及抗血小板的常規治療后,患者均采用阿替普酶靜脈溶栓治療:阿替普酶(北京諾華制藥生產,批準文號20161012)10%劑量于1 min內靜脈注射,90%劑量使用靜脈泵在60 min內泵入完畢。亞低溫組同時給予頭部局部亞低溫治療;雙控顱腦降溫儀(型號:SDL-V;北京北方醫用設備有限公司生產)行腦部亞低溫治療,導冷枕置入頭盔,患者頭部伸入頭盔中并保證低溫治療儀與頭盔處于同一平面,腦溫度33~35 ℃、冰帽-2~4 ℃,模式為自動調溫模式,治療時間48~72 h,持續監測患者心電、血壓、脈搏及呼吸等生命體征;復溫:每1~2天恢復1 ℃,恢復速度每小時<0.1 ℃;2組患者均持續45 d治療。
1.3 觀察指標對比2組患者治療前后的NIHSS評分;多普勒超聲檢測儀(美國BD公司生產)監測大腦中動脈(MCA)的收縮期峰值血流速度(Vp)、舒張末期血流速度(Vd)、平均血流速度(Vm)水平,檢測血清神經元特異性烯醇化酶(NSE)、血漿內皮素(ET)。酶聯免疫雙抗夾心法法(ELISA)檢測血清超敏C反應蛋白(hs-CRP)、白細胞介素-1β(IL-1β)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽過氧化物酶(GSH-Px)水平,相關試劑盒均購于北京中杉生物有限公司,實驗操作嚴格按照試劑盒說明書進行:①將特異性抗體與固相載體連接,形成固相抗體;②加受檢標本;③加酶標抗體;④加底物:夾心式復合物中的酶催化底物成為有色產物。根據顏色反應的程度進行該抗原的定量檢測。比較2組治療后腦出血、鼻出血、心動過緩等不良反應發生率。
2 結 果
2.1 NIHSS評分比較入院時,2組的NIHSS評分差異無統計學意義(P>0.05);在治療7 d、14 d、28 d后,2組患者的NIHSS評分與入院時比較均降低(P<0.05),且亞低溫組的NIHSS評分低于對照組(P<0.05)。見表1。
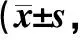
組別nNIHSS評分入院時治療7 d治療14 d治療28 d對照組4913.9±3.011.5±2.5?8.3±2.2?5.7±2.0?亞低溫組4814.2±3.710.1±2.0?#6.4±1.8?#3.9±1.2?# F組間=7.299,P=0.000;F時間=34.383,P=0.000;F交互=14.475,P=0.000與入院時比較,?P<0.05;與對照組比較,#P<0.05
2.2 MCA血流參數比較治療前,2組的MCA的Vp、Vd、Vm測定值差異無統計學意義(P>0.05);在治療12 h后,2組患者的MCA的Vp、Vd、Vm測定值均顯著提高(P<0.05),亞低溫組的MCA的Vp、Vd、Vm測定值高于對照組(P<0.05)。見表2。
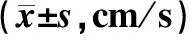
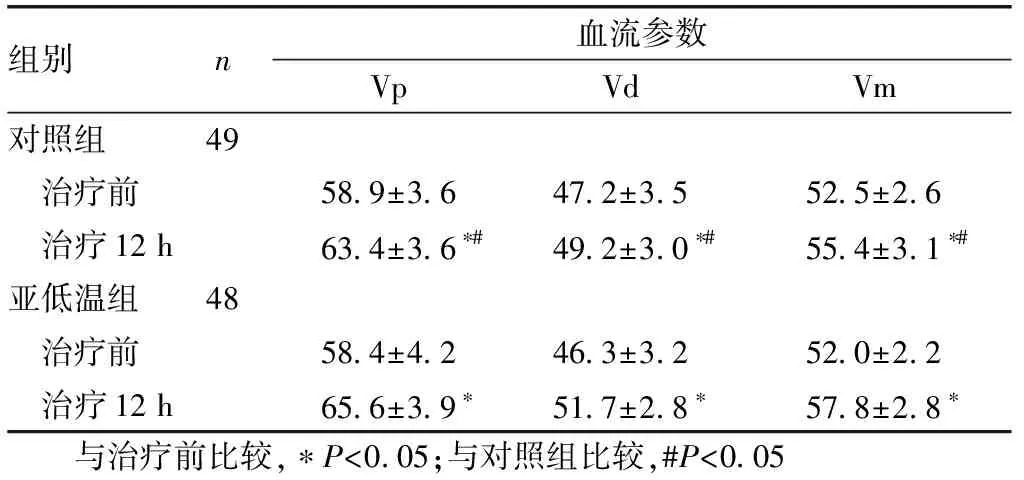
組別n血流參數VpVdVm對照組49 治療前58.9±3.647.2±3.552.5±2.6 治療12 h63.4±3.6?#49.2±3.0?#55.4±3.1?#亞低溫組48 治療前58.4±4.246.3±3.252.0±2.2 治療12 h65.6±3.9?51.7±2.8?57.8±2.8? 與治療前比較,?P<0.05;與對照組比較,#P<0.05
2.3 血清實驗室指標比較治療前,2組的hs-CRP、IL-1β、SOD、MDA、GSH-Px、NSE、ET測定值差異無統計學意義(P>0.05);在治療72 h后,2組患者的hs-CRP、IL-1β、MDA、ET均顯著降低較治療前(P<0.05),SOD、GSH-Px、NSE均顯著提高較治療前(P<0.05);亞低溫組的血清hs-CRP、IL-1β、MDA、ET低于對照組(P<0.05),亞低溫組的血清SOD、GSH-Px高于對照組(P<0.05),亞低溫組的ET低于對照組(P<0.05)。見表3。
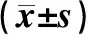
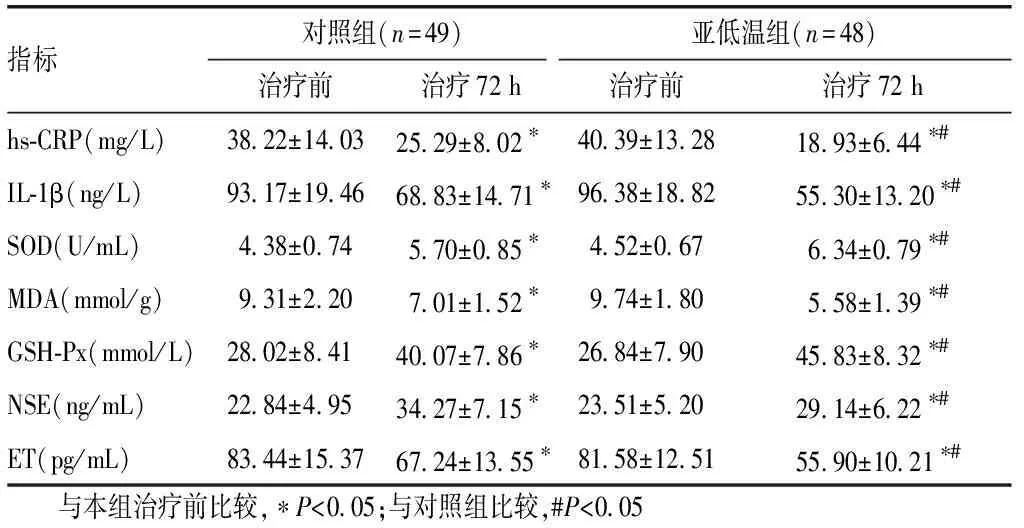
指標對照組(n=49)亞低溫組(n=48)治療前治療72 h治療前治療72 hhs-CRP(mg/L)38.22±14.0325.29±8.02?40.39±13.2818.93±6.44?#IL-1β(ng/L)93.17±19.4668.83±14.71?96.38±18.8255.30±13.20?#SOD(U/mL)4.38±0.745.70±0.85?4.52±0.676.34±0.79?#MDA(mmol/g)9.31±2.207.01±1.52?9.74±1.805.58±1.39?#GSH-Px(mmol/L)28.02±8.4140.07±7.86?26.84±7.9045.83±8.32?#NSE(ng/mL)22.84±4.9534.27±7.15?23.51±5.2029.14±6.22?#ET(pg/mL)83.44±15.3767.24±13.55?81.58±12.5155.90±10.21?# 與本組治療前比較,?P<0.05;與對照組比較,#P<0.05
2.4 不良反應比較亞低溫組出現不良反應4例(8.33%),其中腦出血1例、鼻出血3例。對照組出現不良反應8例(16.33%),其中腦出血2例、鼻出血5例、心動過緩1例。2組不良反應發生率比較差異無統計學意義(P>0.05)。
3 討 論
腦梗死又稱缺血性卒中,本由各種原因所致的局部腦組織區域血液供應障礙,導致腦組織缺血缺氧性病變壞死,進而產生臨床上對應的神經功能缺失表現[6-7]。研究[8-9]提示腦梗死的血腦屏障滲透性增加后,缺血時間發作的幾秒到幾分鐘內腦血管即可因血腦屏障被破壞而被再灌注導致側支循環開放及神經功能難以恢復,嚴重患者還可出現生命危險。
阿替普酶具有改善缺血腦組織血流運輸的作用,作為重組組織型纖溶酶激活劑而具有保護神經系統的作用,能夠選擇性地將促纖溶酶轉化為纖溶酶,降低神經元細胞壞死率,降低和避免鏈激酶出血并發癥的發病率,達到溶解血栓、降解纖維蛋白的目的[10-11]。因而阿替普酶已成為急性腦梗死治療的一線藥物。
為探究臨床治療急性腦梗死的更有效方法,本研究嘗試將亞低溫與阿替普酶聯合應用治療急性腦梗死。亞低溫主要通過物理學降低體溫方法,降低腦氧代謝水平,調節腦部血流,抑制氧自由基形成及神經元凋亡,縮小腦梗死面積,恢復腦細胞型號傳導,降低顱內壓并減輕腦水腫[12-13]。
2組患者的MCA血流參數結果顯示在治療12 h后,2組患者的MCA的Vp、Vd、Vm測定值均顯著提高,亞低溫組的MCA的Vp、Vd、Vm測定值高于對照組。該結果說明聯合治療能夠更有效地提升患者的腦血流速度,進而改善患者腦梗死癥狀。有研究證實NO是血管內皮細胞產生的重要信息傳遞分子,能夠參與機體多種病理活動,內皮型NO短缺可造成腦動脈閉塞,降低局部血流供應量,還可拮抗內皮素,加重腦缺血性損傷[14]。亞低溫腦部治療能夠抑制內皮素的釋放和生成,加速NO的分泌和生成,保證NO和內皮素的動態平衡,降低腦缺氧損傷程度。
腦梗死后由于血液傳輸不暢,常導致患者神經功能障礙,因而臨床常將神經功能作為評價腦梗死治療效果的重要指標。本研究2組患者的NIHSS評分比較顯示在治療7 d、14 d、28 d后,2組患者的NIHSS評分均顯著的降低較治療前,亞低溫組的NIHSS評分低于對照組。該結果說明亞低溫腦部治療聯合阿替普酶能夠改善大腦皮層功能,保護腦神經,促進神經干細胞生長及保護神經功能。
研究提示腦缺血溶栓后再灌注損傷可誘發嚴重的炎癥反應,生成大量自由基,釋放許多炎癥介質[15]。急性腦梗死后腦缺血區域可出現細胞氧化功能失衡,致使氧自由基大量生成而損傷腦組織及細胞,影響腦缺血組織的側支循環,進一步加劇腦組織的缺血情況。血清實驗室指標比較結果顯示在治療72 h后,2組患者的hs-CRP、IL-1β、MDA、ET均顯著降低較治療前,SOD、GSH-Px、NSE均顯著提高較治療前;亞低溫組的血清hs-CRP、IL-1β、MDA、ET低于對照組,亞低溫組的血清SOD、GSH-Px高于對照組,亞低溫組的ET低于對照組。上述結果說明局部亞低溫聯合阿替普酶治療ACI患者有利于盡快緩解患者的氧化應激及炎癥反應。亞低溫能夠通過調節腦血流情況,改善細胞能量代謝,降低氧自由基的生成量及腦氧代謝率,減少腦梗死的面積并降低顱內壓。
進一步對不良反應研究比較顯示亞低溫組和對照組的不良反應發生率差異無統計學意義。文獻[16]提示低溫對血壓、二氧化碳分壓、血氧分壓、血pH值均無影響,對于動物心、肺、腎也未見病理性損害,這也與本研究結果一致,提示低溫并不會增加對組織器官的損害。
綜上所述,局部亞低溫聯合阿替普酶治療ACI患者有利于盡快緩解患者的氧化應激及炎癥反應、改善大腦供血情況,促進神經功能恢復。

