基于MRI特征的腦膠質瘤異檸檬酸脫氫酶1表達預測研究
夏曉亮,夏云寶,陳利華,向定朝,耿承軍
0 引 言
起源于膠質細胞的膠質瘤是中樞神經系統最常見的惡性腫瘤,約占原發顱內腫瘤的65%,近年來,膠質瘤的發病率在全球范圍內急劇上升[1-3]。由于膠質瘤具有侵襲性生長、預后差、致死率高的特點,尋找早期診斷、預后評估的標志物成為目前研究的熱點。異檸檬酸脫氫酶(isocitrate dehydrogenase,IDH)是三羧酸循環的關鍵限速酶,在代謝、細胞分化及血管生成方面發揮著重要的作用。IDH基因突變通常發生于Ⅱ級、Ⅲ級和繼發性膠質母細胞瘤,在2016世界衛生組織分類中,將Ⅱ、Ⅲ及Ⅳ級膠質瘤分為IDH突變型及IDH野生型[4-6]。近年多項研究顯示,尤其是IDH1突變的膠質瘤意味著更好的預后及更長的生存期,使IDH1成為了預測膠質瘤預后的重要靶點,但目前對于IDH1突變檢測仍舊依賴于術后病理標本。MRI作為一種非侵入性檢查,在膠質瘤診斷、復發、及治療后評估中得到了廣泛的應用。由于其具有無創、多參數、多平面成像及組織分辨率高等諸多優點,在臨床中有很大的應用前景。本研究旨在利用MRI特征及臨床檢查數據建立術前檢測IDH1突變的預測模型,為膠質瘤患者的臨床治療提供更多的參考。
1 資料與方法
1.1 研究對象回顧性分析2014年5月至2017年9月在我院就診并術后病理診斷為膠質瘤的76例患者臨床資料。其中男41例,女35例,年齡17~76歲,平均年齡(47.4±17.4)歲。納入標準:①經術后病理證實為膠質瘤。②有術前完整MRI平掃及增強數據。③有完整的臨床及實驗室檢查資料。④術前未行化療、放療。排除標準:合并顱內感染等。
1.2 MRI掃描方案MRI掃描采用GE Signa HDxt 3.0T MR超導型掃描儀,8通道頭部專用線圈。掃描參數如下:①平掃軸位FSE T1WI:TR=195 ms,TE=7 ms,SL=5.0 mm,FOV=25 cm×25 cm,MATRIX=512×512;②平掃軸位FSE T2WI:TR=4500 ms,TE=92 ms,SL=5.0 mm,FOV=25 cm×25 cm,MATRIX=512×512;③軸位FLAIR:TR=8700 ms,TE=85 ms,SL=5.0 mm,FOV=25 cm×25 cm,MATRIX=512×512;④軸位DWI:TR=3000 ms,TE=79 ms,SL=5.0 mm,FOV=25 cm×25 cm,MATRIX=512×512;⑤增強對比劑采用釓噴酸葡胺(廣州康臣),劑量為0.2 mmol/kg,流速為2.5 mL/s,延遲30 s掃描,包括軸位、矢狀位及冠狀位,掃描參數同平掃T1WI。
1.3 圖像數據處理所有患者術前MRI圖像分析全部在醫院圖像存儲與傳輸系統(picture archiving and communication system,PACS)工作站完成,由2名工作8年和10年的神經系統放射科醫師分別行雙盲法獨立分析,統計的特征包括:腫瘤最大直徑、腫瘤部位、強化程度、邊界是否清楚、是否累及多個腦葉、是否累及深部白質、周圍水腫情況、腫瘤內出血、腫瘤內壞死囊變、表觀擴散系數(apparent diffusion coefficient,ADC)值(取最大層面腫瘤實性部分,隨機選取3個面積1 mm2感興趣區測值,并取平均值)。對于分類變量數據,如有爭議,由1名工作20年的神經系統放射科醫師作出最終結論,對于連續變量數據,取2名觀察者的平均值。本研究前所有觀察者對影像特征的分類均參考美國國家癌癥研究所腫瘤影像檔案庫(https://wiki.cancerimagingarchive.net/display/Public/VASARI+Research+Project)的影像特征描述準則,并參加為期2周的培訓。
1.4 臨床及實驗室檢查資料臨床資料包括患者年齡、性別、癲癇發作病史、頭痛病史、行為認知障礙、運動障礙、語言障礙,由神經外科醫師提供。實驗室檢查包括血清C反應蛋白(C-reactive protein,CRP)、血清胰島素樣生長因子-1(insulin-like growth factor-1,IGF-1)、紅細胞沉降率(erythrocyte sedimentation rate,ESR)。
1.5 術后標本病理及免疫組化檢測術后標本病理分級及分類參照2016世界衛生組織中樞神經系統分級分類標準[7]。免疫組化染色采用EnVision 法,標本常規甲醛固定及石蠟包埋后行3 μm薄層切片,一抗、二抗孵育后二氨基聯苯胺(DAB)顯色,蘇木精復染,中性樹脂封固。陰性對照以磷酸鹽緩沖液(PBS)代替一抗孵育。IDH1表達于細胞質,以細胞胞質內有棕黃色或棕褐色顆粒判為陽性細胞,光鏡下隨機觀察10個高倍視野,以陽性細胞超過5%定義為IDH1突變陽性。根據IDH1突變結果將所有病例中IDH1突變陽性的劃分為IDH突變組,反之則劃分為IDH野生型組。
1.6 統計學分析所有數據使用R軟件(version 3.4.4)進行統計學分析,比較2名觀察者對影像特征的一致性,分類變量采用kappa一致性檢驗,連續變量采用組內相關系數(intraclass correlation coefficient,ICC)一致性檢驗。IDH野生型組與IDH突變組間影像及臨床數據單變量分析,連續變量采用獨立樣本t檢驗,分類變量采用Chi-squared檢驗或Fisher’s精確檢驗,以P≤0.05為差異有統計學意義。對有統計學意義的指標行多變量logistic回歸及10折交叉驗證并建模,作列線圖,通過影像特征對應的分數相加得出總分,通過總分可以得出IDH1突變概率。并采用受試者工作曲線(receiver operating characteristic,ROC)、校準曲線及決策曲線對模型進行評價。
2 結 果
2.1 一致性檢驗2名觀察者對11項影像學特征的評估見圖1。ICC/kappa值為0.86~0.98,顯示了2名觀察者間較高的一致性。
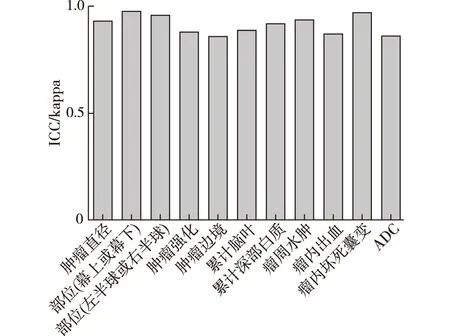
圖1 膠質瘤患者MRI影像特征一致性分析結果
2.2 影像特征及臨床資料單變量分析76例膠質瘤,術后病理及免疫組化顯示,其中血管中心型膠質瘤2例,毛細胞星形細胞瘤5例,彌漫性星形細胞瘤21例,少突膠質細胞瘤7例,混合性少突-膠質細胞瘤16例,膠質母細胞瘤25例。WHO Ⅰ級7例,Ⅱ級22例,Ⅲ級26例,Ⅳ級21例。2例典型IDH1突變型和野生型的MRI圖像、病理及免疫組化圖片見圖2、圖3。入組對象中34例表現為IDH1突變型,42例表現為IDH1野生型。IDH1突變型組年齡為(46.38±18.49)歲,IDH1野生型組年齡為(48.14±16.74)歲,差異無統計學意義(P>0.05)。2組之間影像及臨床單變量分析顯示6個影像特征(腫瘤強化、腫瘤邊界、腫瘤累及腦葉、腫瘤累及深部白質、瘤周水腫、瘤內壞死或囊變)差異有統計學意義(P<0.05),其余變量差異均無統計學意義(P>0.05),見表1、表2。
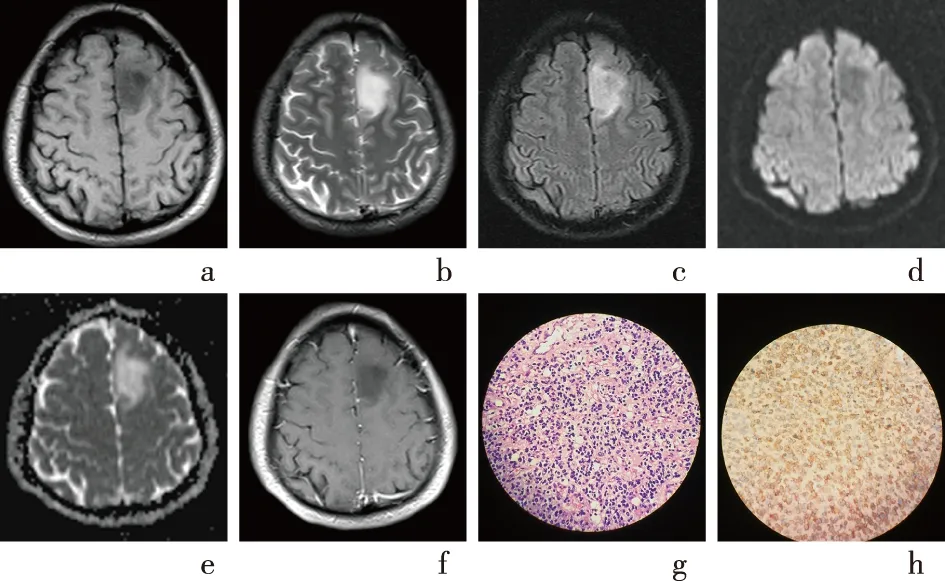
a-f:分別為T1WI、T2WI、FLAIR、DWI、ADC、增強T1WI圖像;g-h:分別為HE染色及IDH1免疫組化(×400)圖2 IDH1突變型腦膠質瘤MRI圖像及術后病理圖像

a-f:分別為T1WI、T2WI、Flair、DWI、ADC、增強T1WI圖像;g-h:分別為HE染色及IDH1免疫組化(×400)圖3 IDH1野生型腦膠質瘤MRI圖像及術后病理圖像
2.3 多因素logistic回歸分析并建模對單變量分析中有統計學意義的6個變量行多變量logistic回歸分析(逐步回歸)及10折交叉驗證并建模顯示,腫瘤邊界、腫瘤累及腦葉、腫瘤累及深部白質、瘤周水腫4個變量進入最終模型,見表3。對模型結果作列線圖,見圖4。采用ROC曲線對模型進行評價,曲線下面積(AUC)為0.92(95%CI:0.85~0.98),顯示了模型較好的預測能力。模型校準曲線也顯示了預測值和實測值之間較高的一致性。決策曲線顯示閾值在>2%及<90%之間時,本模型均優于全或無簡單模型,見圖5。
表1 IDH1突變型組與IDH1野生型組腦膠質瘤患者MRI特征單變量分析結果

變量IDH1突變型組(n=34)IDH1野生型組(n=42)腫瘤部位(幕上/幕下,n)29/534/8腫瘤部位(左半球/右半球,n)20/1423/19腫瘤強化(輕度/明顯,n)22/1213/29?腫瘤邊界(清楚/模糊,n)25/912/30?腫瘤累及腦葉(單個/多個,n)23/1111/31?腫瘤累及深部白質(是/否,n)8/2632/10?瘤周水腫(輕度/廣泛,n)25/98/34?瘤內出血(不明顯/明顯,n)25/931/11瘤內壞死或囊變(不明顯/明顯,n)24/1013/29?腫瘤直徑(x±s,cm)5.47±1.825.04±1.61腫瘤ADC(x±s)0.96±0.120.97±0.13 與IDH1突變型組比較,?P<0.05
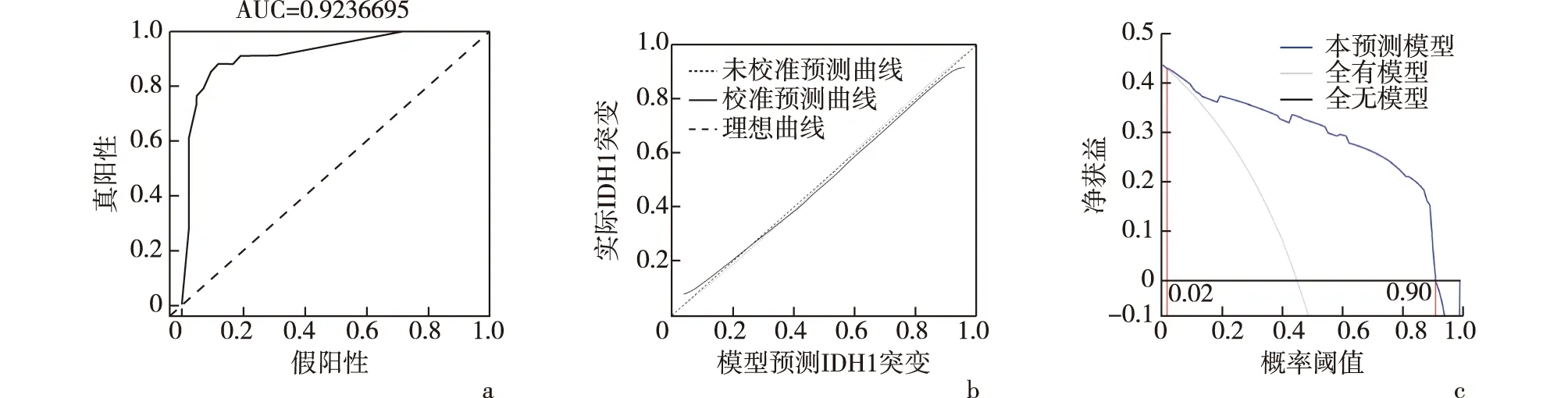
a:ROC曲線;b:校準曲線(虛線為理想模型,實線為本預測模型);c:決策曲線圖5 腦膠質瘤患者IDH1突變預測模型評價
表2 IDH1突變型組與IDH1野生型組腦膠質瘤患者臨床資料單變量分析結果(n)
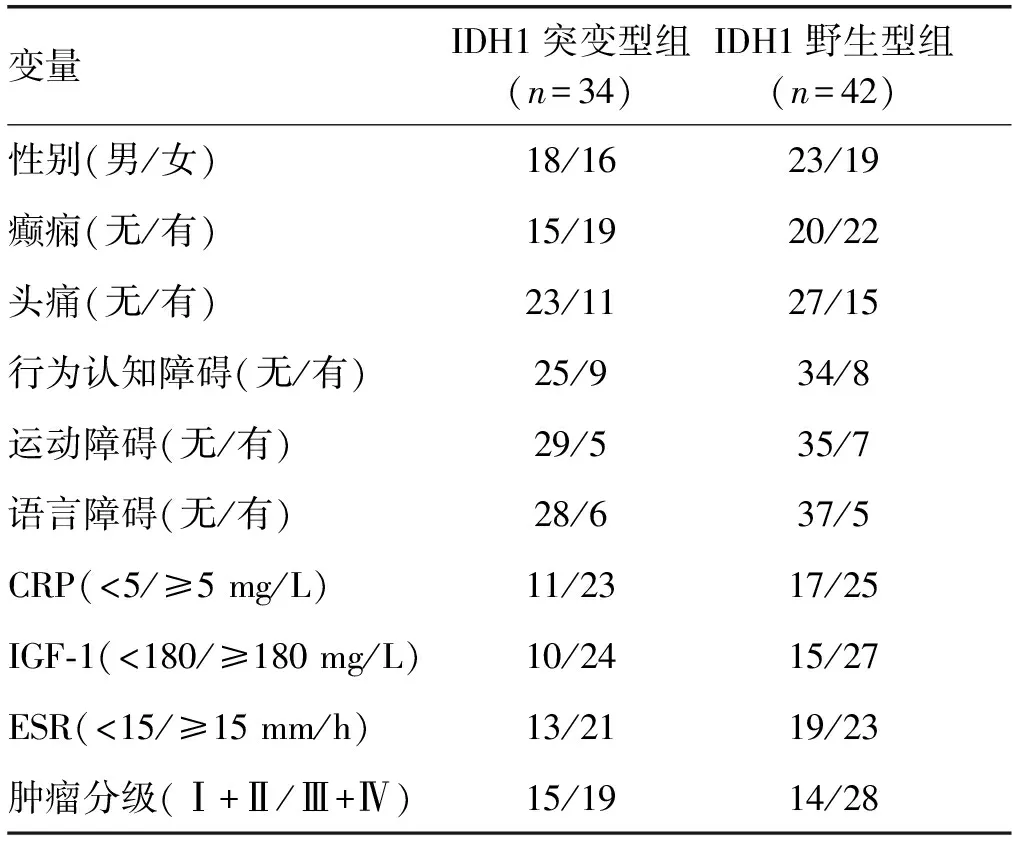
變量IDH1突變型組(n=34)IDH1野生型組(n=42)性別(男/女)18/1623/19癲癇(無/有)15/1920/22頭痛(無/有)23/1127/15行為認知障礙(無/有)25/934/8運動障礙(無/有)29/535/7語言障礙(無/有)28/637/5CRP(<5/≥5 mg/L)11/2317/25IGF-1(<180/≥180 mg/L)10/2415/27ESR(<15/≥15 mm/h)13/2119/23腫瘤分級(Ⅰ+Ⅱ/Ⅲ+Ⅳ)15/1914/28
表3 IDH1突變結果多變量逐步logistic回歸分析
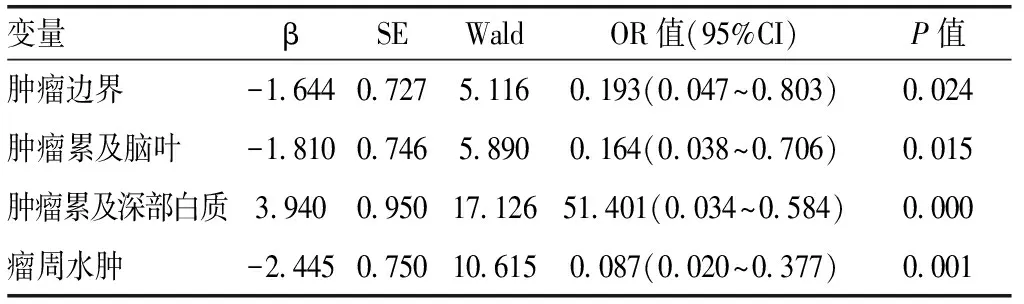
變量βSEWaldOR值(95%CI)P值腫瘤邊界-1.6440.7275.1160.193(0.047~0.803)0.024腫瘤累及腦葉-1.8100.7465.8900.164(0.038~0.706)0.015腫瘤累及深部白質3.9400.95017.12651.401(0.034~0.584)0.000瘤周水腫-2.4450.75010.6150.087(0.020~0.377)0.001

圖4 基于腦膠質瘤患者MRI圖像4個影像特征建立模型的列線圖
3 討 論
IDH是三羧酸循環中的關鍵限速酶,其可催化異檸檬酸形成α-酮戊二酸(α-Ketoglutarate,α-KG)、CO2和煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)[8]。2008年首次報道了在低級別膠質瘤及繼發性膠質母細胞瘤中的IDH突變,研究發現IDH突變為膠質瘤的相對特異性突變,可能是膠質瘤發生早期的重要腫瘤驅動因素[9-10]。IDH家族有三種同工酶:IDH1、IDH2及IDH3,IDH1主要位于胞質和過氧化物酶體內,IDH2和IDH3主要位于線粒體內,IDH3尚未見突變的報道,IDH1、IDH2突變較為常見且相互排斥,其中最為重要的是IDH1突變。
首先,IDH1突變產生大量的2-羥基戊二酸(2-hydroxyglutaric acid,2-HG),2-HG與α-KG結構類似,可競爭性抑制許多α-KG依耐性酶,可能導致腫瘤的發生,同時,2-HG本身就是一種腫瘤細胞代謝產物,可能對神經系統惡性腫瘤的發生有促進作用。其次,IDH1突變可抑制脯氨酰羥化酶(prolyhydroxylase,PHD)的活性,并提高缺氧誘導因子1α(hypoxia-inducible factor 1α,HIF1α)的表達,誘導下游效應如:血管生成、葡萄糖代謝和細胞增殖,從而可能促進腫瘤細胞生長、侵襲、血管生成及轉移。說明IDH1突變是導致膠質瘤發生的重要因素[11-13]。但同時多項臨床研究發現,IDH1突變與膠質瘤預后明顯相關,IDH1突變的膠質瘤患者預示著更好的預后及更長的生存期,其機制尚不明確,考慮可能為IDH1突變既可導致膠質瘤的發生,又可抑制腫瘤細胞分化[14]。Sabha等[15]研究發現,在一組未經放射治療的低級別彌漫性膠質瘤中,IDH1突變型組的生存時間明顯長于IDH1野生型組。楊燕武等[16]也報道,在WHOⅡ級、Ⅲ級、Ⅳ級膠質瘤患者中,IDH1突變型組的無進展生存期及中位生存時間均長于IDH1野生型組。另一項研究顯示,相對于IDH1野生型,IDH1突變型膠質瘤患者對化療更為敏感[17]。因此IDH1成為近年研究膠質瘤治療及預后的重要靶點。
MRI作為一種非侵入性檢查,在膠質瘤診斷和評估中發揮著越來越重要的作用,由于其成像特性可間接反映腫瘤內部的代謝及分子機制,近年有多項基于MRI成像特征預測IDH1突變的研究報道。在這些研究中發現IDH1突變與MRI特征有著一些特定的關系,如IDH1突變型膠質瘤一般位于額葉,且很少位于腦干、間腦等深部腦組織,IDH1突變型膠質瘤相對于IDH1野生型膠質瘤,一般強化較弱、邊界較清、腫瘤內囊變壞死較少、ADC值較高,呈相對良性的影像特征[18-22]。本研究收集了11項影像學特征及11項臨床變量,進行單變量分析時,所有的臨床因素均無統計學意義(P>0.05),有6項影像學特征有統計學意義(P<0.05),顯示 IDH1突變型膠質瘤相對于IDH1野生型膠質瘤強化更弱、邊界更清晰、一般累及單個腦葉、較少侵及深部白質、瘤周水腫較輕、瘤內囊變壞死較少見,證實IDH1突變型膠質瘤具有局部侵襲性較低的影像特征,這與之前的研究基本相符,但本研究顯示2組間ADC值無明顯統計學意義,這與之前的部分研究不符[23],考慮為樣本量較少且未行亞組分析的原因,在后續的研究中將行進一步分析。多變量logistic回歸分析,腫瘤邊界、腫瘤累及腦葉、腫瘤累及深部白質、瘤周水腫進入最終模型,為預測IDH1突變的獨立因素,采用ROC曲線、校準曲線、決策曲線對模型進行評價,證實了模型較高的預測能力。
本研究收集了膠質瘤患者部分臨床資料及MRI半定量特征,建立了IDH1突變預測模型及列線圖,并對模型進行了多維評價,這對臨床決策提供了重要參考,但仍有一些不足,本研究為單中心回顧性研究,且樣本量偏少,未對不同病理類型的膠質瘤行亞組分析,也缺少外部驗證結果,這在下一步工作中將行進一步論證。

