化學吸附儀溫度滯后分析及檢測條件優化
(開灤煤化工研發中心,唐山 063611)
1 引言
吸附是一種表面現象,是催化反應的基元步驟之一,通過它可以進行固體催化劑的結構性質和反應動力學相關研究。同物理吸附相比,化學吸附是單層吸附且具有選擇性,其吸附熱較高,表面分子與吸附質分子間真正化學成鍵。因此化學吸附經常用于研究催化劑活性位的性質和測定負載金屬的金屬表面積等。結合程序升溫技術,根據不同的預處理條件和氣體,可分為程序升溫脫附(TPD)、程序升溫氧化(TPO)、程序升溫還原(TPR)以及程序升溫表面反應(TPSR)等[1]。近幾年,通過現代譜學技術并與常規表征手段相結合,無論是研究化學吸附層的表面結構、吸附態,還是考察分子與表面作用的能量關系,都獲得了很多重要研究結果[2],使得化學吸附技術在固體表面和催化研究中占有異常重要的地位。
然而在使用化學吸附技術進行定性分析時,圖譜峰對應溫度的準確性具有十分重要的意義,因此理論上需要樣品床層到檢測器之間的距離盡可能的短[3],而化學吸附儀由于實際需要,在催化劑床層到檢測器之間一般會有冷阱、流量計及相關管線形成的死體積,導致溫度滯后和軸向擴散,最終影響結果的準確性。本實驗以氨氣程序升溫脫附實驗(即NH3-TPD)為例,采用折半查找法和載氣流量控制,從技術角度提高溫度準確性,又通過調整催化劑裝填量等條件優化圖譜結果。
2 化學吸附技術基本原理
以TPD為例,整個系統包括氣體凈化和切換、反應控溫以及分析檢測三大部分,如圖1所示。當堿性氣體分子接觸固體催化劑時,除發生氣固物理吸附外,還會發生化學吸附,吸附作用首先從催化劑的強酸位開始,逐步向弱酸位發展,吸附飽和后切換回載氣并吹除物理吸附部分,接著開始程序升溫脫附過程,隨著固體催化劑溫度升高,當吸附在催化劑活性中心的吸附質分子受熱至能克服所需越過的脫附活化能時,就產生脫附,由于不同活性中心與吸附質之間的結合能不同,脫附所需的能量也不同。因此,熱脫附實驗結果不但反映了吸附質與固體表面之間的結合能力(即催化劑的酸強度),也反映了脫附發生的溫度和表面覆蓋度下的動力學行為。根據Cvetanovic和Amenomiya提出的TPD動力學處理方法[4],實際脫附峰最高溫度(Tm)與脫附活化能(Ed)關系如下:
2InTm-Inβ=Ed/RTm+In(Ed/AR)
(1)
其中β為加熱速率,R為氣體摩爾常數,A為指前因子。可用作圖法近似求解催化劑的脫附活化能Ed。因此脫附峰溫度的準確性有著重要意義。
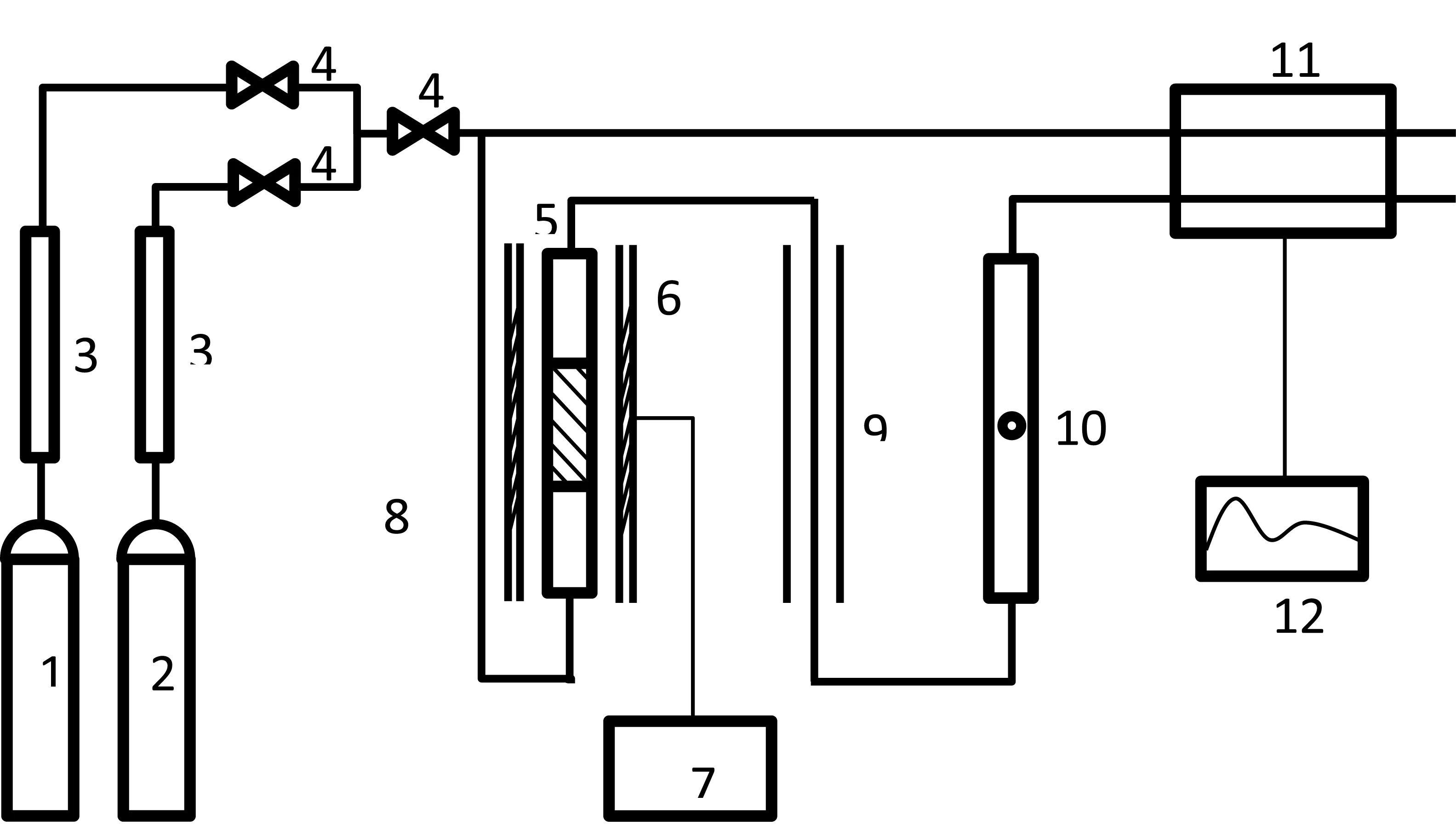
圖1 TPD實驗流程圖1.氦氣;2.氨氣(含量6.5%,氦氣為平衡氣);3.干燥器;4.截止閥;5.樣品管;6.加熱爐;7.程序升溫控制系統;8.固體樣品;9.冷阱;10.轉子流量計;11.熱導池;12.計算機
3 實驗部分
3.1 儀器與試劑
化學吸附儀:美國康塔ChemBET Pulsar TPR/TPD化學吸附儀,錸鎢熱導絲熱導池,升溫速率1~50℃/min,最高溫度1100℃,重現性0.5%,配備250μL定量環,可脈沖進樣。
實驗樣品為NKF-5(HZSM-5)沸石分子篩,由天津南開大學催化劑廠提供。相關參數:硅鋁比=25,相對結晶度≥95%,Na2O含量≤0.1%,比表面積≥340m2/g;載氣:北京順安奇特氣體有限公司高純氦氣,純度≥99.999%(體積分數);吸附氣:北京順安奇特氣體有限公司6.5%NH3(體積分數),氦氣平衡。
3.2 化學吸附儀條件
NH3-TPD條件為:稱取一定量樣品,置于U形石英管中,用高純氦氣作載氣吹掃系統,程序升溫到700℃,恒溫活化1h,除去分子篩吸附的雜質和水,再降溫到平衡溫度,切換6.5%NH3(NH3和He的混合氣,NH3占體積分數6.5%)吸附30min使NH3吸附達到飽和狀態,切換回氦氣除去分子篩表面物理吸附的氨氣,待TCD信號穩定后,以10℃/min的速率升溫至700℃,并記錄TCD信號得到NH3程序升溫脫附曲線。
4 結果與討論
4.1 脫附峰溫度滯后現象
由圖2可知,在同種樣品且樣品量都為0.08g,載氣流速為80mL/min條件下,不同平衡溫度(圖2中a、b設定平衡溫度分別為180℃和200℃,由于儀器程序設定溫度為加熱爐溫度,樣品實際平衡溫度為193℃和233℃,本文中如無特殊說明,都表示樣品實際平衡溫度)NH3-TPD圖譜相差較大,主要表現在弱酸峰的出峰溫度和酸強度上。而由文獻[5]可知ZSM-5分子篩存在弱酸和強酸兩個脫附峰,且弱酸酸量大于強酸酸量。因此根據化學吸附原理,可知在193℃(圖2中a)下弱酸吸附很少,而在平衡溫度233℃(圖2中b)下弱酸基本沒有吸附,這與樣品弱酸脫附峰出現在350℃左右相矛盾,因此可推斷由于死體積的原因導致脫附峰溫度滯后。
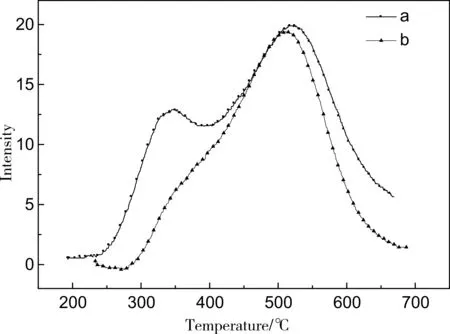
圖2 不同平衡溫度樣品NH3-TPD圖譜a.平衡溫度193℃;b.平衡溫度233℃
4.2 折半查找法確定最佳平衡溫度
由于不同平衡溫度直接影響弱酸對NH3的吸附,因此需首先采取折半查找法確定弱酸完全吸附的平衡溫度。折半查找法即搜索過程從數組的中間元素開始,如果中間元素正好是要查找的元素,則搜索過程結束;如果某一特定元素大于或者小于中間元素,則在數組大于或小于中間元素的那一半中查找,而且跟開始一樣從中間元素開始比較。這種搜索算法每一次比較都使搜索范圍縮小一半,所以查找效率較高[6]。由實驗可知,100℃以下物理吸附較多,因此確定折半查找法上下限分別為100℃和180℃(設定平衡溫度),結果如圖3所示。在同種樣品且樣品量都為0.04g,載氣流速為80mL/min條件下,平衡溫度在114℃和125℃時,弱酸吸附基本不變,因此可確定最佳平衡溫度為125℃。
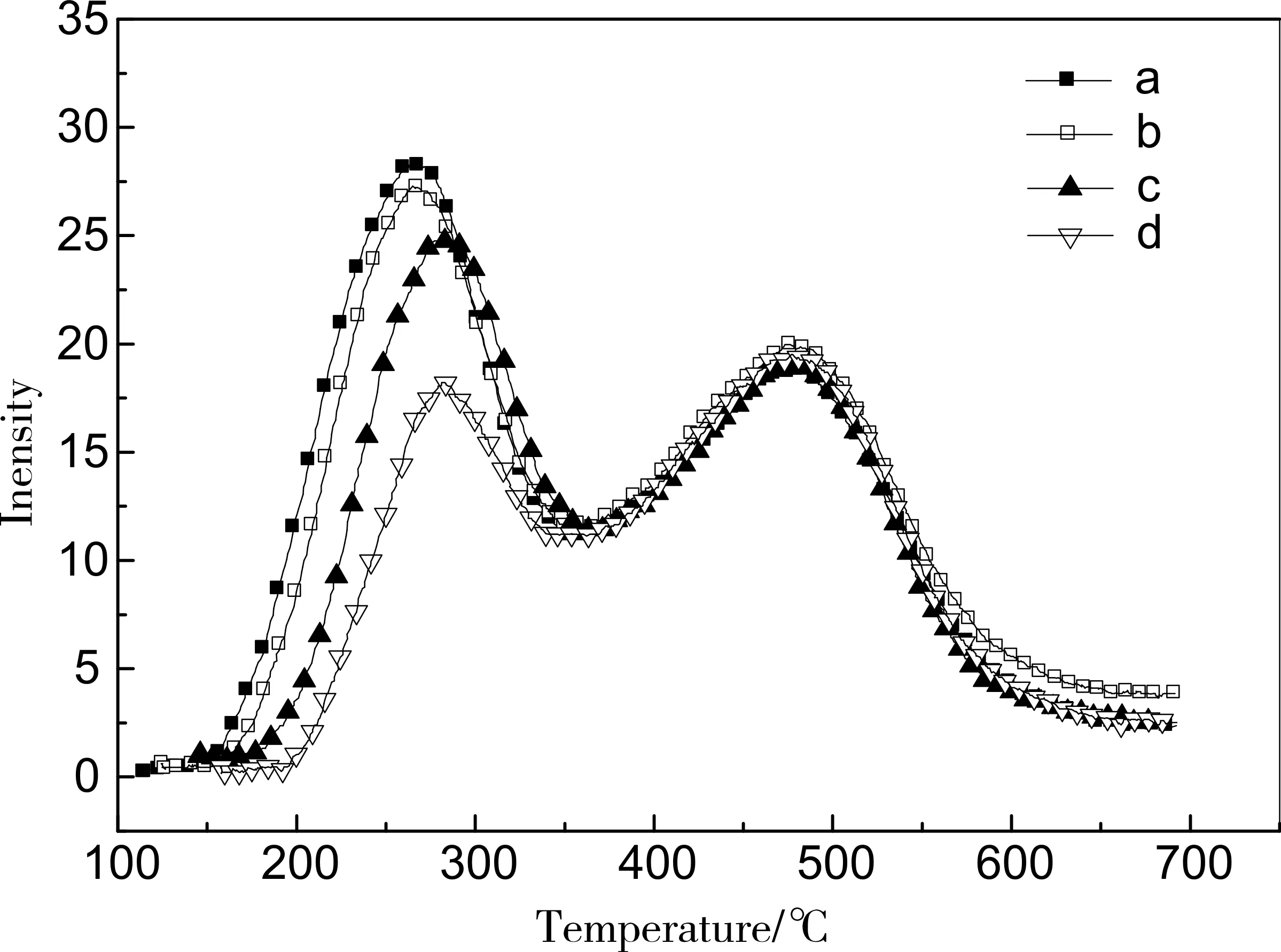
圖3 折半查找法結果a.平衡溫度114℃;b.平衡溫度125℃;c.平衡溫度145℃;d.平衡溫度158℃
4.3 脫附峰實際溫度確定
由于化學吸附儀死體積一定,在同種樣品且樣品量都為0.04g,實際平衡溫度為125℃時,控制載氣流速變化,可以通過計算可以從技術角度確定脫附峰實際溫度,計算方式如下:
V/ν=t
(2)
t=(TM-Tm)/νT
(3)
其中V表示死體積,mL,ν表示載氣流速,mL/min,t表示到脫附峰最高溫度的時間,min,TM表示圖譜行脫附峰最高溫度,℃,Tm表示實際脫附峰最高溫度,℃,νT表示升溫速率,10℃/min。由圖4可知,由于載氣流速的增加,脫附的NH3到達TCD檢測器的時間縮短,所以脫附峰溫度降低,同相由于載氣流速的增加當于經過檢測器的NH3濃度減低,多所以信號減弱。根據圖譜信號數據,隨著載氣流速的升高,弱酸最高脫附峰溫度分別為248℃、262℃和291℃,結合式2、3可求出弱酸脫附峰實際溫度平均值為183.5℃,絕對誤差在±10℃以內。
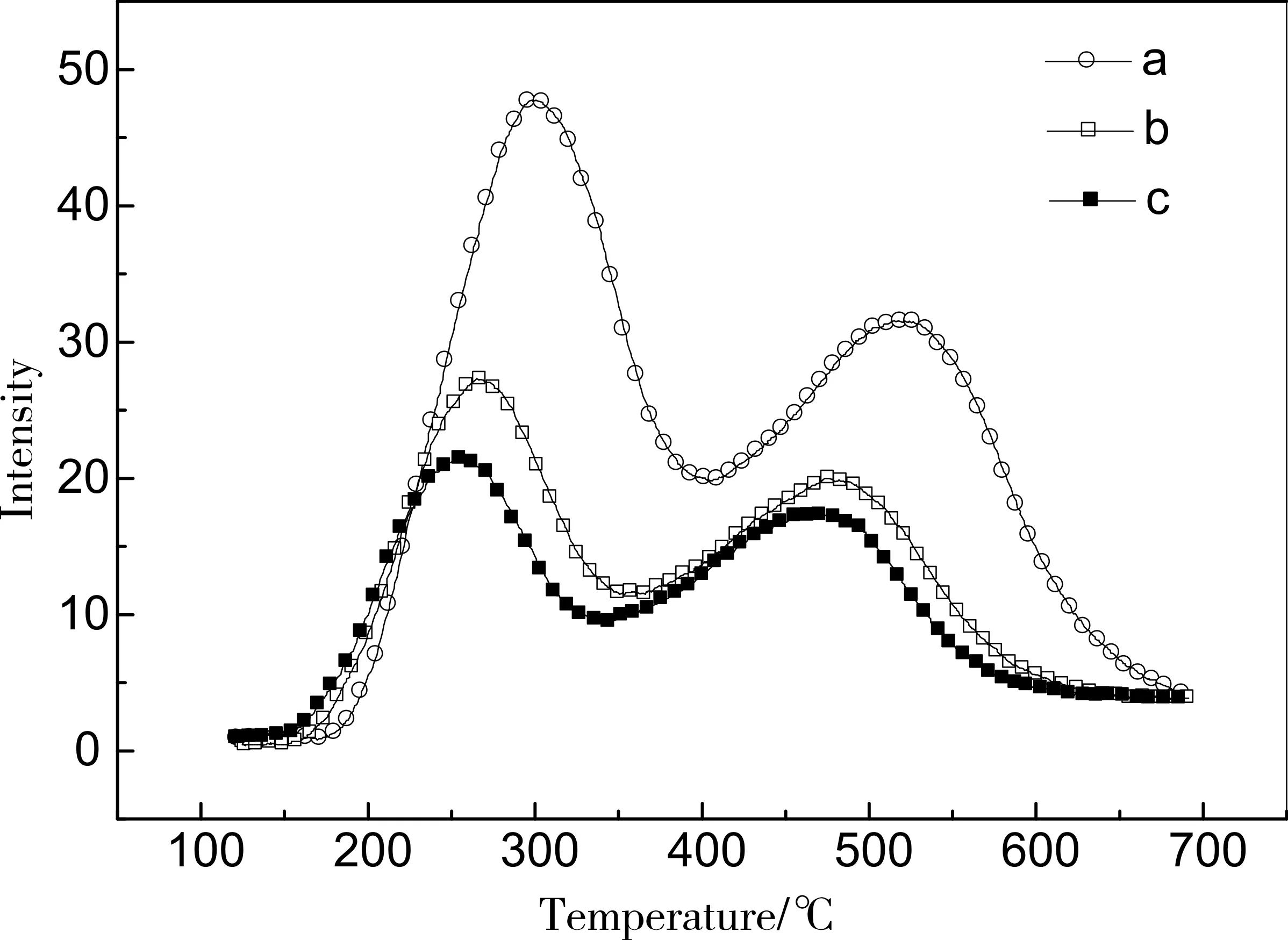
圖4 不同載氣流速NH3-TPD圖譜a.載氣流速60mL/min;b.載氣流速80mL/min;c.載氣流速100mL/min;
4.4 NH3-TPD檢測條件優化
考慮到軸向擴散和再吸附的影響,理論上應該盡可能了縮短樣品到檢測器的距離、減小樣品管及管線的內徑、提高載氣流速、降低樣品床層厚度。實際上前二者由于儀器的原因基本上不能改變,因此我們為保證圖譜的準確性,一般從載氣流速和樣品裝填量上考慮,由圖5可知,在同種樣品,載氣流速為80mL/min,平衡溫度為125℃條件下,樣品量分別為0.08g和0.04g時,增加樣品裝填量到0.08g時,床層厚度在10mm左右,信號變強,但峰形有一定寬化,而且氣阻大,而0.04g樣品床層厚度只有5mm左右,能有效降低再吸附影響。而由圖4可知,載氣流速降低,信號變強,但峰形寬化,溫度滯后嚴重,對比b和c,載氣流速80mL/min時,信號強度增加但峰形寬化和溫度滯后不明顯。因此綜合考慮圖譜信號、峰形以及對樣品和氣體的節約上,最終確定化學吸附優化檢測條件為:樣品裝填量為0.04g,載氣流速為80mL/min,平衡溫度為125℃。
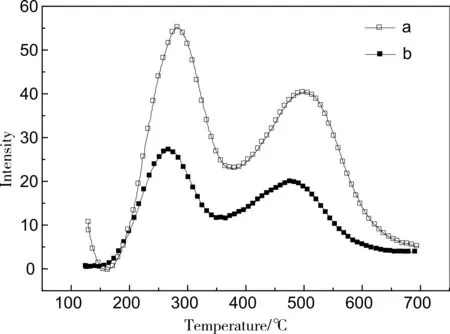
圖5 不同樣品裝填量NH3-TPD圖譜a.樣品裝填量0.08g;b.樣品裝填量0.04g
5 結論
根據上述實驗結果可知,化學吸附檢測過程中實際存在的溫度滯后問題,能通過折半查找法結合載氣流量控制有效解決,絕對誤差可降到±10℃以內,這對于化學吸附在吸附質與固體表面之間的結合能力和動力學行為方面的應用具有重要意義。同時本實驗通過對載氣流量、樣品裝填量的考察,確定NH3-TPD檢測的優化條件為:樣品裝填量為0.04g,載氣流速為80mL/min,平衡溫度為125℃。

