白腐菌木質素降解酶高產菌株的篩選
徐安民,李 力,馬 森
河南工業大學 糧油食品學院,河南 鄭州 450001
小麥麩皮含有蛋白質、礦物質、維生素等多種營養物質,還富含膳食纖維,適量的小麥麩皮添加到面制品中可提高面制品的營養價值,但同時由于其口感粗糙使得面制品食用品質降低。因為小麥麩皮中,纖維素形成細胞壁的骨架,半纖維素與纖維素由氫鍵締合,木質素通過醚和酯鍵與半纖維素相連接[1],所以對木質素的降解成為改性小麥麩皮的關鍵。利用微生物降解木質素是相對可行的途徑,白腐菌目前是最有效、最主要的木質素降解微生物。白腐菌屬于擔子菌綱,腐生在木材或死樹樁上,引起木質腐爛,故此得名[2]。它是整個碳素循環的中心,是已知的唯一能在純系培養中將木質素降解成 CO2和 H2O 的一類微生物[3]。白腐菌在長期的生物進化過程中形成了一套獨特的降解系統,木質素過氧化物酶(lignin peroxidase,LiP)、錳過氧化物酶(mangnase peroxidase,MnP)、漆酶(laccase,Lac)共同構成了白腐菌的木質素降解酶系[4-5]。
近年來,關于白腐菌降解木質纖維素的基礎研究有很多,但主要集中在對單一菌株的產酶特性進行研究。在篩選高效降解木質素降解菌時,有些研究的篩選指標比較單一,沒有較強的說服力[6],缺乏綜合性。為了能全面系統地進行高效降解木質素菌株的篩選工作,筆者結合愈創木酚平板變色法、產酶比較和定量測定木質素含量的方法,從9株白腐菌中篩選出1株高效降解麥麩纖維的菌株,為篩選開發高效降解木質素工業菌株提供思路和理論基礎。
1 材料與方法
1.1 試驗材料
1.1.1 菌種
CICC 14121(AP1)、CICC 50017(AP2):中國工業微生物菌種保藏管理中心;CGMCC 7004(AP3)、CGMCC 7002(AP4)、CGMCC E5.95(AP5)、CGMCC E5.94(AP6):中國普通微生物菌種保藏管理中心;BNCC 336040(AP7)、BNCC 336039(AP8)、BNCC 143171(AP9):北京北納創聯生物技術研究院。
1.1.2 小麥麩皮
小麥麩皮:中鶴現代農業開發集團有限公司。小麥麩皮的前處理參照陶顏娟[7]的方法。
1.1.3 培養基
斜面固體PDA培養基:馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂20 g/L,pH自然,1×105Pa滅菌30 min。
種子培養基:葡萄糖20 g/L,酵母膏2 g/L,KH2PO43 g/L,MgSO4·7H2O 1.5 g/L,VB10.5 g/L,pH自然,1×105Pa滅菌30 min。
愈創木酚-PDA固體培養基:馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂20 g/L,KH2PO43 g/L,MgSO4·7H2O 1.5 g/L,VB10.02 g/L,愈創木酚1 g/L,pH自然,1×105Pa滅菌30 min。
液體發酵基礎培養基:麥麩30 g/L,KH2PO43 g/L,MgSO4·7H2O 1.5 g/L,(NH4)2SO41.4 g,CaCl20.3 g,FeSO4·7H2O 5 mg/L,MnSO4·H2O 1.6 mg/L,VB10.02 g/L,pH自然,分裝至250 mL的三角瓶中,每瓶100 mL, 1×105Pa滅菌30 min。
1.2 主要儀器與設備
TH2-D型恒溫振蕩器:太倉市實驗設備廠;HWS 型恒溫恒濕箱:寧波東南儀器有限公司;FYB101-2型電熱鼓風干燥箱:上海梳理儀器有限公司;SHZ-D型循環水式真空泵:鞏義市予華儀器有限責任公司;PHS-3C型精密酸度計:上海大普儀器有限公司;LS-75LJ型立式壓力蒸汽滅菌鍋:江陰濱江醫療有限公司;752 N型紫外可見分光光度計:上海精密科學儀器有限公司。
1.3 試驗方法
1.3.1 菌種初篩
采用孫江慧[8]的方法,并略作改動。用0.1%愈創木酚加入PDA培養基中做成平板,從斜面試管培養基中挑取活化后的9株菌株,每一株菌株做2個平行,于26 ℃培養10 d。觀察分析平板中菌落圈和顯色圈直徑的大小和菌落顏色變化。
1.3.2 粗酶液制備
用培養6 d的菌株分別定量接種,吸取搖勻的種子液10 mL加入裝有100 mL液體發酵培養基的250 mL三角瓶中,每一株菌株接種2瓶,于26 ℃、160 r/min恒溫搖床中培養15 d。菌種液體培養從第4天開始取樣,每隔1 d取樣1次,發酵液用4層紗布過濾,濾液在3 000 r/min條件下離心15 min,上清液即為粗酶液。
1.3.3 酶活的測定
漆酶酶活的測定參照Glenn 等[9]的方法。
木質素過氧化物酶酶活的測定參照Cacchio等[10]的方法。錳過氧化物酶酶活的測定參照Glenn等[11]的方法。
1.3.4 麥麩木質素降解能力的測定
分別取不同菌株的種子液10 mL,接種至含麩皮的發酵培養基中,26 ℃搖床培養15 d后,將生物預處理后的小麥麩皮過濾洗凈, 60 ℃烘干至恒質量,粉碎混勻,備用。每個樣品做3個平行。麥麩中木質素含量測定方法參考王玉萬等[12]的檢測方法。
2 結果與分析
2.1 漆酶活性的平板檢驗
Ander等[13]認為能在以愈創木酚為指示劑的選擇培養基上產生顯色圈的微生物具有降解木質素的能力,產漆酶的菌株在該培養基上長出的菌絲能產生明顯的紅褐色。在愈創木酚選擇培養基平板上培養9株菌株10 d,每天對各平板的變色情況進行觀察記錄,其結果列于表1。根據菌株在平板上的生長和變色情況,可將9株菌株分為以下4種類型:(1)在平板上沒有顯色圈,有AP2;(2)在平板上有紅褐色的顯色圈,但顯色圈直徑與菌落圈直徑比值小于1,有AP5;(3)在平板上有紅褐色的顯色圈,顯色圈直徑與菌落圈直徑比值大于1,但菌株生長較稀疏,有AP1、AP4;(4)在平板上有紅褐色的顯色圈,顯色圈直徑與菌落圈直徑比值大于1,菌株生長較旺盛,有AP9、AP6、AP8、AP7、AP3。圖1為不同菌株在PDA顯色平板上第7天時的生長情況。
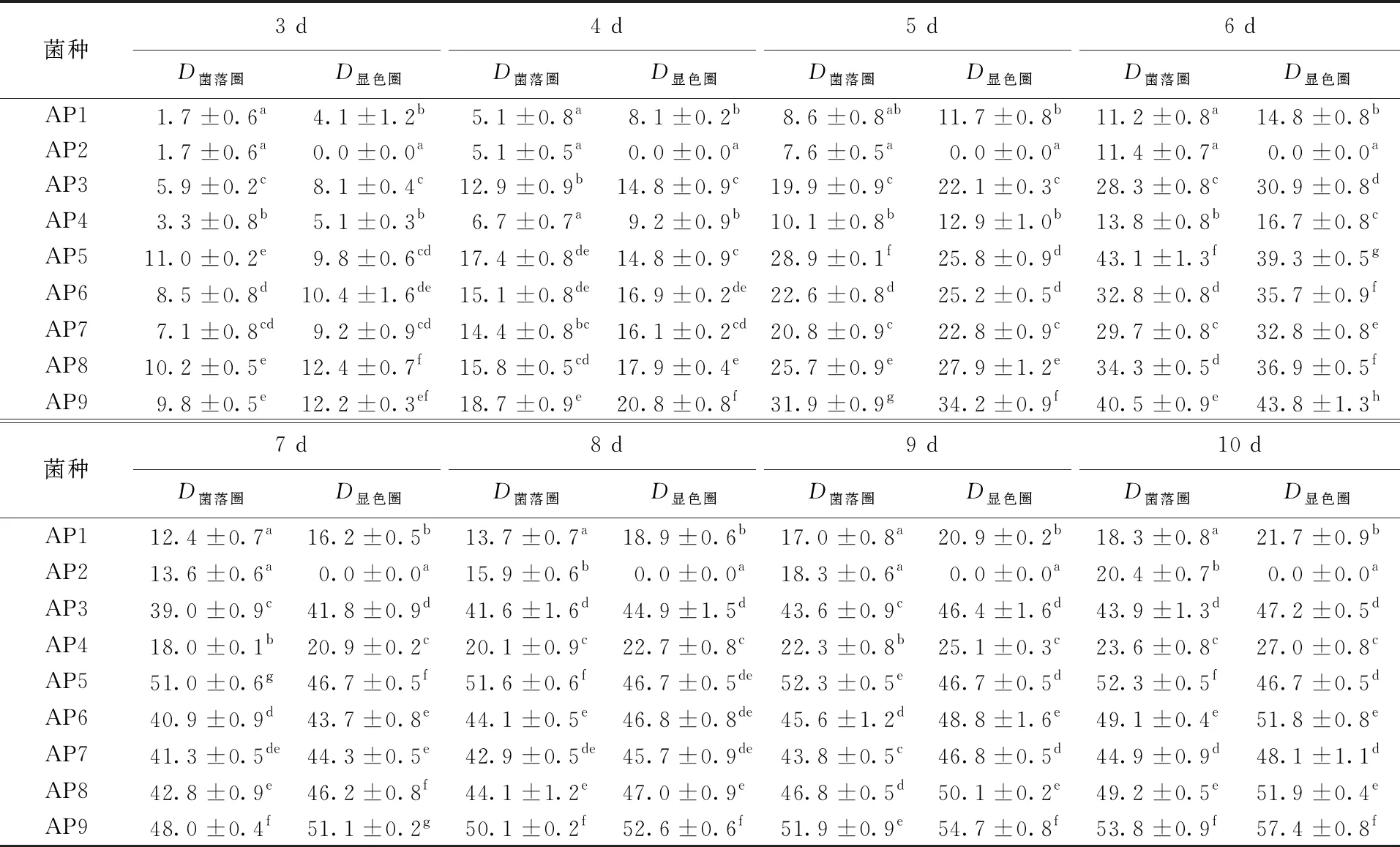
表1 不同菌株菌落圈、顯色圈直徑隨時間的變化
注:同列不同字母表示存在顯著差異(P<0.05)。
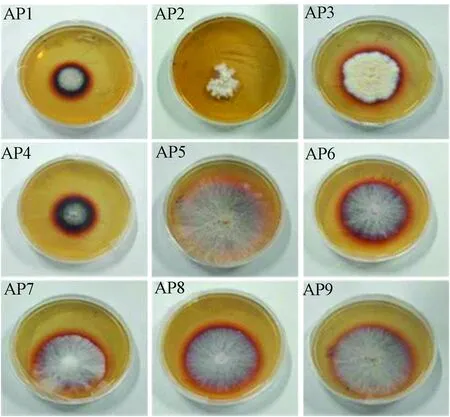
圖1 不同菌株在PDA顯色平板上第7天時的生長情況
Ander 等[13]認為對于白腐菌,顯色圈的形成有兩種:一種是顯色圈在菌落的外圈形成,此時D菌落圈/D顯色圈<1;另一種是顯色圈在菌落的內圈形成,此時D菌落圈/D顯色圈>1。Eriksson等[14]的研究表明,菌落圈與顯色圈直徑的比值可作為判斷該菌是否能選擇性降解木質素的依據,比值小于1則該菌能選擇性降解木質素,比值大于1的菌則首先降解纖維素。綜上所述,經過愈創木酚法定性篩選,從9株菌中共篩選出5株能產生顯色圈且生長旺盛的菌株用來做后續復篩試驗。
許多學者在研究木質素降解菌時僅選擇一種定性篩選培養基,這樣只能檢測出1種或2種木質素降解酶。事實上許多研究表明,白腐真菌對木質素的降解不是依靠1種酶作用,而是幾種酶共同作用的結果,主要通過木質素過氧化物酶、錳過氧化物酶和漆酶這3種酶來完成[15],而且,顯色圈大小與漆酶活性的高低有必然聯系但不是線性的正相關[16]。因此,本試驗對木質素降解菌進行第2次篩選時,選用液體產酶試驗以便綜合考慮菌株產木質素降解酶的能力,獲得降解木質素能力較強的白腐真菌。
2.2 木質素降解酶系酶活對比分析
2.2.1 產木質素過氧化物酶酶活的比較
用Excel對試驗數據進行基本計算,Orign軟件進行統計分析和作圖,LSD法檢驗差異顯著性,顯著水平設置為P=0.05。由圖2可知,5株白腐真菌的木質素過氧化物酶酶活曲線隨時間的變化都是先升高,直到達到酶活高峰,然后開始下降。AP8、AP3 這2株菌株產木質素過氧化物酶能力最強時間都是在第7天,木質素過氧化物酶酶活分別為112.28、119.42 U/mL。AP9在第9天酶活最高,木質素過氧化物酶酶活為95.71 U/mL。AP6和AP7則是在第11天時出現酶活高峰,最高酶活分別為87.84、90.16 U/mL。5株白腐菌最高木質素過氧化物酶酶活大小順序為AP3>AP8>AP9>AP7>AP6,5株菌株酶活最低時與酶活最高時所對應的酶活值差異顯著(P<0.05)。
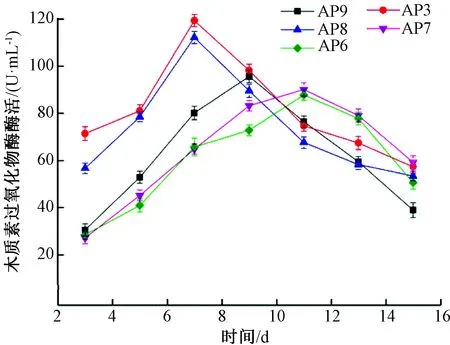
圖2 菌株產木質素過氧化物酶酶活隨時間的變化
2.2.2 產錳過氧化物酶酶活的比較
由圖3可以看出,AP9產錳過氧化物酶出現的最高峰在第9天,錳過氧化物酶酶活為97.95 U/mL。AP8和AP3產錳過氧化物酶的最佳時間都是在第7天,最高酶活分別為116.55、124.35 U/mL。而AP6和AP7則是在第11天產酶能力最高,最高酶活分別為85.17、92.62 U/mL。5株白腐菌錳過氧化物酶最高酶活大小順序為AP3>AP8>AP9>AP7>AP6,差異顯著(P<0.05)。
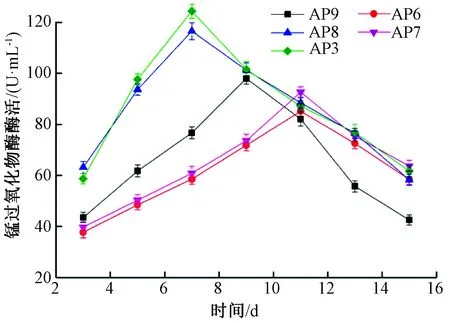
圖3 菌株產錳過氧化物酶酶活隨時間的變化
2.2.3 產漆酶酶活的比較
由圖4可以看出,AP9、AP6、AP7產漆酶的高峰期出現在第7天,而AP8、AP3產漆酶能力最強時間出現在第9天。5株菌株產漆酶能力大小差異顯著(P<0.05)。其中,AP3產漆酶能力最強,酶活為173.45 U/mL,AP6產漆酶能力最弱,酶活為141.75 U/mL。AP9和AP7產漆酶能力一般,最高酶活分別為151.67、156.95 U/mL。5株白腐菌最高漆酶酶活大小順序為AP3>AP8>AP7>AP9>AP6。
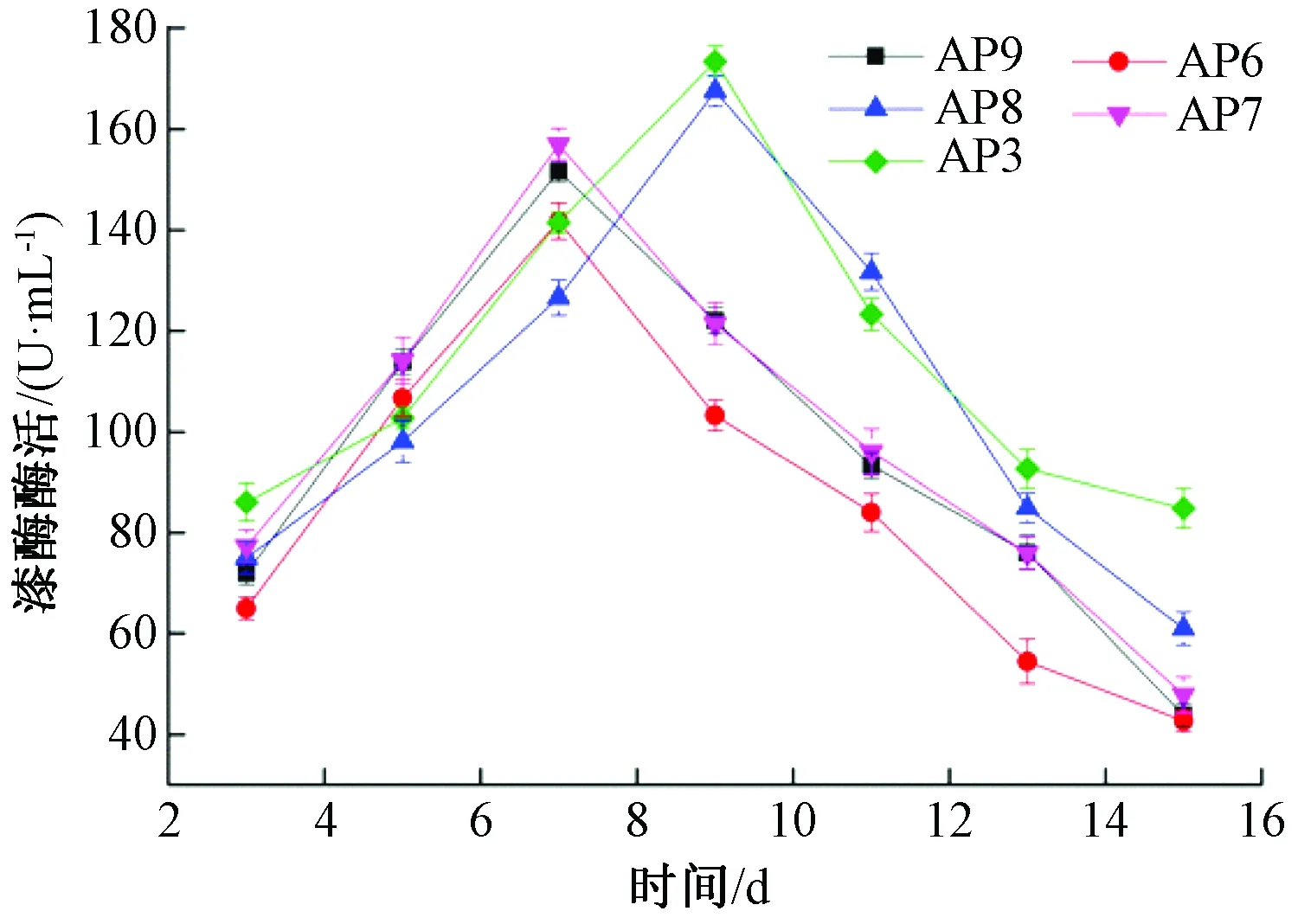
圖4 菌株產漆酶酶活隨時間的變化
白腐菌的生長狀況與它們分泌的木質素酶系的酶活高低有一定的關系,在菌株生長的初期,菌株不斷消耗培養基中的營養物質供自身生長需要,菌落逐漸增多,該階段主要是菌株生長時期,因而菌株分泌的3種酶都較少;之后3種酶酶活逐漸增大直到達到最高峰,這是因為菌株進入了次生代謝階段,菌株不斷分泌3種酶;高峰期后酶活開始下降,這可能是因為隨著培養時間的延長,培養基中營養物質不足,抑制了菌株的生長,而且培養基中菌株產生大量的代謝廢物也會使其生長受到抑制,出現菌體自溶現象[17]。
對5株菌株15 d內產酶量的變化進行分析比較,可以發現AP8和AP3木質素降解酶系的多種酶酶活均顯著高于其他3株菌株,且達到酶活高峰的時間要早于另外3株菌株。綜合考慮,將AP8和AP3作為復篩菌株。同時由圖2、圖3、圖4可以看出,5株菌株在液體培養基中產漆酶高,且產少量的木質素過氧化物酶和錳過氧化物酶。
2.3 麥麩木質素降解能力的比較
木質素的降解與酶活關系密切。由圖2、圖3、圖4可以看出,AP8和AP3產酶效果都較好,但從表2可以看出,AP3對麥麩木質素的降解率明顯高于AP8,這可能是因為2種菌株自身的適應能力和產酶能力不同,從而造成對木質素降解有差異[18]。AP3產酶量高且產酶速度快,對麥麩木質素降解效果最佳,因而,選取AP3作為最優菌株,對麥麩木質素進行降解。

表2 不同菌株對麥麩木質素的降解效果
3 結論
通過對木質素降解酶系多種酶酶活的比較,從9株白腐菌中篩選出1株高效降解麥麩纖維的菌株AP3。麥麩纖維經AP3液態發酵15 d后,木質素降解率達到了36.24%。此外,在菌株產酶比較分析中發現,AP3在產酶時能分泌較多的漆酶,產生較少的木質素過氧化酶和錳過氧化物酶。這可能是因為AP3在改性木質素時是以漆酶為主導的,漆酶在木質素降解過程中發揮重要作用。關于其特有的降解機制將在后期試驗中進行分析探討。
本試驗是研究木質素降解菌的初期階段,下一階段試驗是對AP3液體深層發酵麥麩的培養基成分及培養條件進行優化,從而提高漆酶的產酶量,達到對麥麩纖維良好的降解效果。
小麥麩皮是我國重要的農副產品,因此,研究木質素降解菌,從而高效改性小麥麩皮,對其開發利用具有重要意義。

