禽多殺性巴氏桿菌PlpE基因的PCR擴增檢測
劉永明


摘 ?要 ???多殺性巴氏桿菌是一種重要的人畜共患病的病原菌,有許多不同的血清型,可使多種動物感染發病,其中禽霍亂是其中之一,其主要特征為引起家禽發生腹瀉、呼吸困難、發熱等癥狀,此病嚴重危害畜禽養殖業的發展。據報道[1],禽多殺性巴氏桿菌PlpE基因可編碼一種具有較好的交叉免疫保護性的外膜脂蛋白抗原。本實驗先將目的細菌進行培養增殖,而后提取細菌總DNA并進行瓊脂糖凝膠電泳,最后運用核酸PCR擴增技術檢測擴增PlpE基因,以確定分離獲得細菌株是否具有PlpE基因,從而判定該菌致病性的大小,為禽巴氏桿菌病的快速診斷以及奠定初步的基礎。
關鍵字 ???多殺性巴氏桿菌,DNA提取,PlpE基因,PCR擴增
1. 引言
多年以來,禽霍亂一直是國內外養殖企業十分重視的畜禽傳染病,被列為重點防制的家禽疫病之一。由于該病的病程較短、死亡率較高,這給養殖畜禽業帶來了極大的危害,造成了巨大的威脅,特別是對養雞產業的影響較為嚴重,現已被人們關注和重視[5]。目前對于禽霍亂的主要防制是有弱毒活疫苗和滅活疫苗,弱毒活疫苗有較好的交叉性,交叉的效果較好,但是在接種后的應激反應較強。滅活疫苗有較好的安全性,但是交叉保護性較差,免疫持續時間不長[8]。禽巴氏桿菌病,又可以稱為禽霍亂,是由多殺性巴氏桿菌引起的一種敗血性的傳染病。禽霍亂的特征主要為發熱、腹瀉和呼吸困難,最急性病例可以迅速死亡[10]。禽霍亂是可以通過接觸就能夠傳染的一種疾病,它的發病率和死亡率都是比較高的,都是能夠危害多種畜禽類,急性敗血的過程就是禽霍亂的特征表現。出現慢性的疾病或者是局部性的疾病都是要在感染之后或者是急性發病之后才會發生的[11]。由于禽巴氏桿菌病發病速度比較急和死亡時間比較快,若是不能及時的診斷或是治療的話會引起畜禽的大部分死亡。據研究報道,該病原菌在世界各地區普遍分布,其類型有發散型或是流行型[6]。一種多殺性巴氏桿菌可以感染多種動物及無宿主特異性,也可以通過呼吸道進行生殖垂直傳播和水平傳播[4]。不同動物感染后發病的狀態和變化情況都不一樣。
禽巴氏桿菌病的病原菌為多殺性巴氏桿菌[7],該菌體屬于巴氏桿菌科巴氏桿菌屬,菌體呈兩極著色,單個存在,有時成雙排列,是一種革蘭氏陰性需氧兼性厭氧菌,是球桿狀或者是短桿狀的一種細菌,該細菌對營養有較高的要求,其兩側鈍圓,中央則是微微突起的,沒有芽孢的形成也沒有鞭毛,是不運動的一種菌。關于巴氏桿菌屬細菌的報道已經有了20多種,一般存在健康動物的咽部黏膜和口腔,是一種條件致病菌。
對致病性以及在宿主體中存活和繁殖有重要作用的是細菌毒力因子[13]。而且部分的毒力因子的免疫原性有比較強,所以對部分的毒力因子進行研究并成此病預防及治療提供了理論依據。目前確定多殺性巴氏桿菌毒力因子和免疫原主要是有莢膜、外膜蛋白、脂多糖和PMT毒素。莢膜具有細菌的致病性和粘附性,抗干燥,其中主要的成分是透明質酸。莢膜可以用做制備疫苗。其中,脂蛋白E不僅僅是巴氏桿菌的一種膜脂蛋白,其主要作用是具有粘附宿主細胞,經過研究的表明,脂蛋白E也還是一種保護性抗原的因子[12]。
多殺性巴氏桿菌的分型主要采用血清學方法檢測莢膜和菌體抗原[2],目前已經發現6個血清群(A、B、C、D、E、F)和16種菌體血清型。許多學者在研究禽霍亂亞單位疫苗是利用了化學的方法提取了禽巴氏桿菌莢膜多糖等物質,這種方法雖然比較好,但是成本較高,隨著分子生物學的發展利用在大腸桿菌中成功的表達了禽多殺性巴氏桿菌PlpE蛋白[9],這種蛋白是巴氏桿菌外膜蛋白的其中一種,其免疫學活性可能較強。本次實驗的目的是為了探討不同菌株中PlpE基因的存在情況,以期為探討PlpE基因在該菌致病作用、PlpE蛋白對疾病的免疫效果乃至為PlpE蛋白檢測提供一定的前期基礎。
2. 材料與試劑
2.1 菌株
禽巴氏桿菌菌株(由西北民族大學生命科學與工程學院預防獸醫學實驗室提供)
2.2 主要器皿、設備
玻璃棒、平皿、錐形瓶、燒杯、電子天平秤、電爐、100ml量筒、電熱恒溫水浴鍋、自動高壓鍋、水平電泳儀、電泳槽、凝膠成像系統、超凈工作臺、試管、離心機、梯度PCR儀、0.5mLPCR管、各種規格的吸頭、微波爐、立式高壓蒸汽滅菌器、WJ-3型-160 CO2細胞培養箱、落地式全溫振蕩器、高速冷凍離心機等
2.3 主要試劑和培養基
培養基:營養肉湯培養基: 100ml的蒸餾水,營養肉湯1.8g,馬血清5ml。
LB固體培養基:1%蛋白胨1g,0.5% 酵母0.5g,1%NaCl1g,1.6g瓊脂粉,NaOH溶液,馬血清5ml,加水到100ml。
試劑:TIANamp Bacteria DAN Kit細菌基因組DNA提取試劑盒、革蘭氏染色液試劑盒。
3. 方法
3.1禽巴氏桿菌的純化培養
3.1.1 培養基的制備
營養肉湯培養基:稱量2.2g,放在錐形瓶里,加入100ml的蒸餾水,調PH至7.0,在電爐上加熱攪拌溶解至透明,利用記號筆進行標記,在加塞子之后用牛皮紙將其瓶口包裹好。將制作好的液體培養基錐形瓶放在121℃的高壓蒸汽滅菌鍋中進行高壓15min,待高壓結束之后,要等到高壓鍋內的氣壓放氣完后才能打開,取出錐形瓶置于超凈工作臺上,冷卻至45℃左右,即可加入馬血清5ml,混勻,然后將混勻好的培養基分別倒入試管內(每支試管不超過1/4),在操作過程的中要一直保持無菌的狀態,以防止被其他細菌污染。
LB固體培養基:稱量1%胰蛋白胨1g,0.5%酵母0.5g,1%NaCl1g和1.6g的瓊脂粉放置在錐形瓶中,蒸餾水加80ml,攪拌溶解,然后再滴加NaOH,利用NaOH將酸堿度調成7.0,最后再加蒸餾水到100ml進行定容,利用電爐加熱溶解到透明狀,加上塞子之后用牛皮紙將瓶口包裝起來。將做好的培養基錐形瓶放置在121℃的高壓蒸汽滅菌鍋中進行高壓15min,高壓結束后,注意要等高壓鍋內的氣壓為0時才能打開,取出錐形瓶放在超凈工作臺上,冷卻至45℃左右,加入馬血清5ml,然后倒入在培養皿上,操作時保持無菌操作。
3.1.2細菌純化
⑴肉湯培養純化法
利用移液槍將已準備好的菌種挑出一小部分放置于肉湯中,在落地式全溫振蕩器內培養24h,取出搖晃時在若肉湯中出現渾濁則說明培養完成。
⑵連續劃線法
將準備好的菌種利用連續劃線法接種到已經做好的培養基上,放置于37℃的恒溫箱中培養24h,若培養基上長出菌落則說明培養完成。
3.2 細菌純化檢驗
3.2.1 革蘭氏染色[3]
(1)制片:用移液槍在營養肉湯內吸取10μl液體或在培養基內挑出一小部分菌加少量的生理鹽水,放在滅菌過的載玻片上攪拌混合。
(2)干燥:為了使水分快速蒸發,即可將玻片放在酒精燈上,距離火焰10cm處加熱干燥。
(3)初染:滴加草酸銨結晶紫,染色1min后水洗。
(4)媒染:將載玻片平放在桌面上滴加碘液后,約1min左右進行水洗。
(5)脫色:把載玻片上的水利用吸水紙吸凈,然后再滴上乙醇進行脫色,等到30秒之后水洗;或者是可以把乙醇滴滿整個玻片,靜置到30秒后水洗這樣可以不用浪費乙醇。
(6)復染:在進行完脫色之后用吸水紙將玻片上的水吸取干凈,若想快速蒸干水分可以在酒精燈上方微微加熱或者是自然干燥。在水分蒸干后在載玻片中間滴加上番紅染液進行復染,染色到1min左右再進行水洗。
(7)干燥:完成上一步后用吸水紙或者是紙巾吸掉載玻片上周圍的水,或者是放在自然條件下干燥,又或者是放在酒精燈的上方烘干。
(8)鏡檢:將載玻片放置于顯微鏡上,利用油鏡查看同時也要注意其細胞的形態和顏色。
3.2.2 生化實驗
將培養的LB培養基培養成液體,利用接種針接種到微生物管中,倒插在泡沫上,擱置在37℃恒溫的培養箱中培養24小時之后觀察并進行記載。
3.3 DNA的提取
將上述培養的細菌培養物做成菌懸液,按照試劑盒說明進行提取。其中具體步驟如下:
(1)菌懸液1.5ml,10000rpm離心1min棄清液。
(2)沉淀中加200μl GA。
(3)加20μlProteinaseK溶液。
(4)加220μl GB 70℃水浴鍋放10min離心除管內水珠。
(5)加220μl無水乙醇離心除管內水珠。
(6)得到沉淀或溶液加到吸附柱中,吸附柱放收集管中,12000rpm離心30秒廢液棄去。
(7)加500μl GD, 12000rpm離心30秒倒廢液。
(8)加600μl PW,12000rpm離心30秒倒廢液吸附柱放到收集管內。
(9)重復操作步驟8。
(10)12000rpm離心2min棄去廢液。
(11)加100μl TE室溫放2-5min, 12000rpm離心2min。
3.4 基因組DNA的瓊脂糖凝膠電泳檢測
3.4.1制膠
瓊脂糖稱取0.24g放到小錐形瓶里,加入30ml的 1×TAE,振蕩使瓊脂糖和電泳緩沖溶液充分溶解,再將小錐形瓶放入到微波爐里使其加熱溶解到透明狀態。把電泳槽放在平的桌面上,將梳子垂直插放在電泳槽上固定,梳子的下端要和電泳槽保持有1mm的間隙。取出小錐形瓶后等到膠冷卻到60℃左右,在膠液中加入5μl的Goldview染料,加完染料之后要混勻,混勻后要把瓊脂糖倒入膠槽內,倒的時候的速度不應太快,否則會產生氣泡。等待膠完全凝固后拔出梳子,將膠槽小心放入電泳槽里,樣品孔在陰極。向電泳槽中加入1×TAE電泳緩沖溶液覆蓋凝膠。
3.4.2 電泳
將5μl的DNA和1μl載樣液利用移液槍吹打混勻之后,再將這混合液加入到倒好膠的槽里,加樣時一定要注意,在每加完一個樣的時候要改換一個槍頭,避免污染,使其電泳的效果不太好,加樣時也要避免將膠體刺破。在加完樣之后把電泳槽的蓋子蓋上,接通電源,當跑到凝膠的2/3時即可取出。
3.5 PlpE基因的PCR擴增
3.5.1 引物的設計與合成
根據所查閱的文獻用Primer premier5.0設計出來的引物預期產物的大小為1008bp,其引物序列為:
將設計好的引物進行短時間的離心,稀釋后放置于-20℃的冰箱中保存(引物儲存濃度為100μmol/L,使用濃度為10μmol/L)。
3.5.2 PCR擴增反應體系
準備PCR的反應溶液,取0.5mLPCR管,按照下列順序加入各試劑:
4. 結果
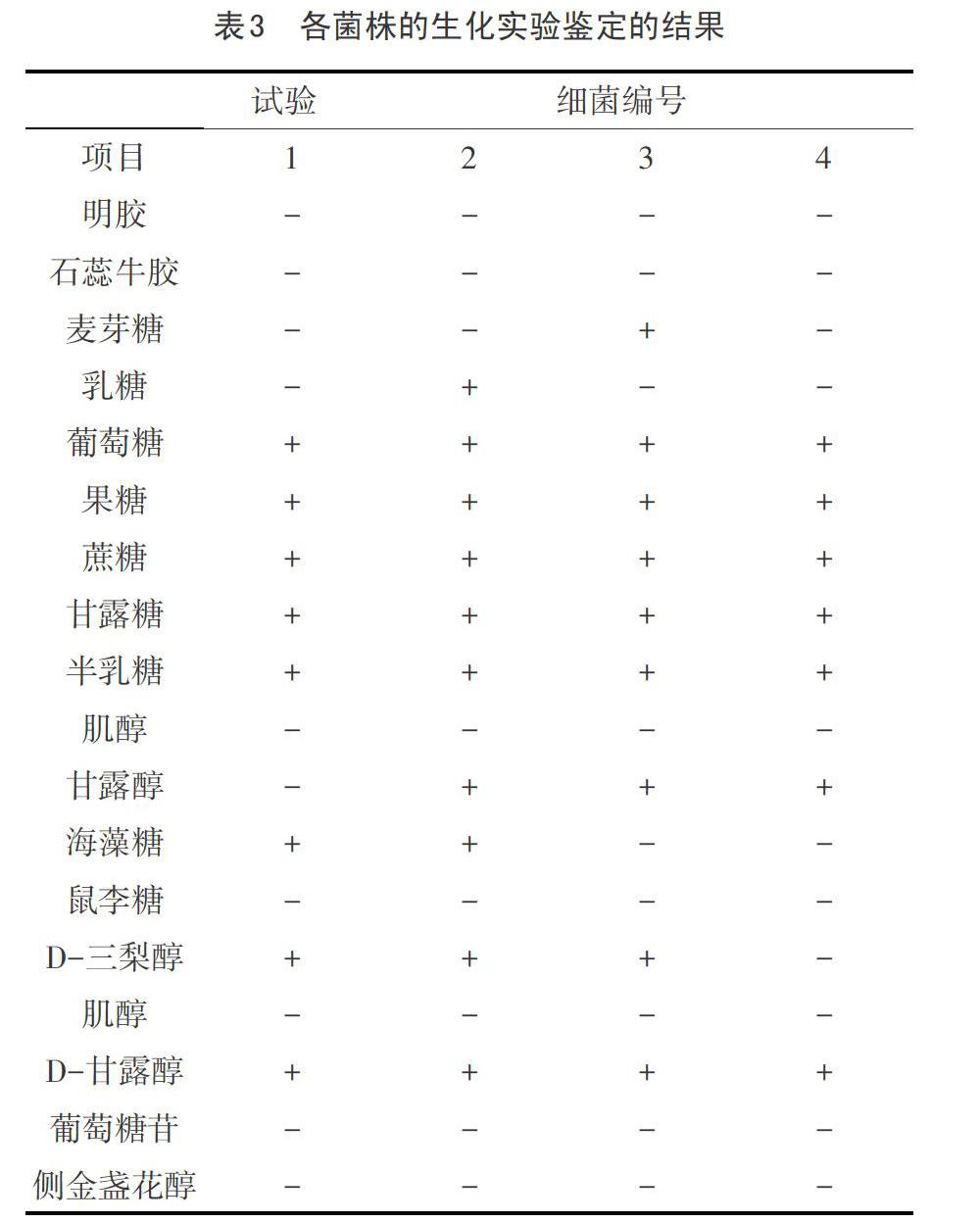
4.1生化試驗結果:
取純化培養的巴氏桿菌的菌株,分別接種生化試驗培養基進行生化實驗其結果見表1。
經對生化試驗結果分析,發現與多殺性巴氏桿菌的生化特性基本一致,可以初步判定該菌是多殺性巴氏桿菌,
4.2 PlpE基因擴增結果:
在提取出來的DNA中加入利用Primer premier5.0設計出來的禽巴氏桿菌PlpE基因的引物,通過PCR技術擴增之后,利用瓊脂糖凝膠電泳檢測可看出擴增出來有明顯清晰的條帶,從條帶上可以看出雜質較少并且沒有明顯降解。PlpE基因PCR擴增結果見圖1
5. 分析討論
5.1多殺性巴氏桿菌的血清型是比較復雜的,它們之間沒有或者是有比較弱的交叉免疫原性,不同血清型其致病性有很大差異,更為關鍵的是該病的傳播速度也是比較快的,且沒有宿主的特異性,因此,傳統檢測方法的準確性(如細菌的分離培養與鑒定),與診斷人員的實驗技能有直接關系,加之血清型不同致病性有很大差異,傳統診斷技術的可靠性能也比較差,給疾病的快速準確診斷帶來較大挑戰,建立準確、快速、穩定的診斷方法十分必要。此次實驗我們運用了PCR擴增技術進行PlpE基因檢測,目的就是初步探討該診斷方法的可靠性。通過此次的實驗建立了PlpE的PCR擴增,其產物大小為1008bp,通過條件的優化且具有良好的特異性、敏感性,為禽巴氏桿菌的快速檢測奠定了一定的條件基礎。
5.2試驗結果的準確性會受到許多因素的影響,在實際操作中需要注意的具體因素如下:
(1)在做細菌的培養時所有的操作都要在無菌的條件下進行,這是為了避免細菌中摻雜其他菌株,以導致影響下一步的實驗順利進行;在利用劃線法時也要小心不要把平板內的瓊脂刺破了,會影響細菌的正常生長;染色時要注意水洗的時候不要將細菌沖洗掉了,會影響細菌DNA的的提取,防止在顯微鏡下觀察不到細菌;在進行生化實驗過程中不能用手取藥品,應該用藥匙,若有液體灑出要利用抹布擦去。強酸強堿的廢液不能直接倒入水池中,應該倒在廢液缸中。過濾是要做好濾紙,以避免有氣泡產生。試管加熱時不要集中加熱,也不能將試管對著人。在硫酸和硝酸等液體弄到身上是要立即使用水洗凈,再利用碳酸鈉液洗。
(2)細菌基因組DAN的提取是好是壞,主要取決于菌的擴大培養是否純化,是否存在其他細菌,其他細菌存在的越少,說明細菌越純。而DNA提取的效果也是直接影響PCR擴增技術以及進一步的實驗。DNA提取的方法有很多種,為了確保之后的實驗能夠順利進行,在本次實驗中運用了DNA試劑盒來提取細菌的DNA,在提取DNA時為了防止DNA降解,操作時應盡量在低溫下或者是冰塊下進行。
(3)PCR擴增時要在一個沒有DNA污染的干凈的環境下進行,在操作的過程中都要戴手套,而且所有的試劑都要確保沒有核酸和核酸酶的污染,所有的試劑或者是樣品在準備的過程中都要使用一次性的滅菌的瓶子和管子,其他的玻璃器皿在洗干凈之后都要高壓滅菌,做好自我保護的措施。
6. 結論
禽多殺性巴氏桿菌是對畜禽養殖業影響較大的病原菌,尤其對養雞產業影響十分巨大,如何快速準確診斷十分必要,通過建立PCR技術快速擴增檢測PlpE基因,可以實現對禽巴氏桿菌病的快速診斷,同時也對了解細菌菌株對動物體的危害性和對疾病的免疫效果有所幫助。
參考文獻
[1]Jin Ru Wu.Jui Hung Shien,Happy K. Shien.Protective immunity conferred by recombinant Pasteurella multocida lipoprotein E(PlpE) [J].Vaccine,2007,25:4140-4148
[2]崔衛濤,胡思順,王延昭,周曉芬,李自力,肖運才,畢丁仁.《禽多殺性巴氏桿菌脂蛋白E基因的原核表達及其對小鼠的免疫原性》.[J],武漢,華中農業大學動物醫學院/農業微生物學國家重點實驗室,2011(04),第1-3頁
[3]劉用成 .《食品微生物檢驗技術》.[M ],北京: 中國輕工業出版社,2015,第79-80頁
[4]黃海燕.《豬源多殺性巴氏桿菌plpE基因的克隆、原核表達及其免疫原性研究》.[J].四川農業大學,2012,第14-23頁
[5]吾魯木汗·那孜爾別克; 陳亮; 卡馬勒別克·吾買爾; 嚴芳; 恩特馬克·布拉提白.《禽多殺性巴氏桿菌P1059成熟黏附蛋白的原核表達、純化和抗原性檢測》 .[J],吉首,中國生物工程雜志,2008(04),第1頁
[6]吳清民,主編.《動物傳染病學》[M].北京:中國農業出版社,2002.
[7]王帥濤,宮強,彭永剛,程茗,秦翠麗,張敏,牛明福.《禽多殺性巴氏桿菌外膜蛋白和脂多糖的免疫保護效果》.[J],河南,中國預防獸醫學報,2011(08)
[8]王娉、張富春.《多殺性巴氏桿菌毒力因子的研究進展》[J],地方病通報,2006(02)
[9]黃園媛.《牛源A型多殺性巴氏桿菌plpE基因的克隆表達及DNA疫苗的研究》.[J],西南大學,2013
[10]石少華.《禽巴氏桿菌病的流行特點及剖檢變化》.[J] 《養殖技術顧問》,2011\
[11]宮強.《禽多殺性巴氏桿菌基因組表達文庫的構建及其免疫效果》[J] 《中國獸醫學報》,2013
[12]牛思博; 姜志剛; 德艷艷; 于力.《重組牛源莢膜A型多殺性巴氏桿菌脂蛋白E的免疫保護性研究》[J],中國預防獸醫學報,2013,第2頁
[13]龍青山《牛源莢膜血清A型多殺性巴氏桿菌部分毒力相關基因研究》[J],西南大學,2013

