濕地松雄性不育和可育系小孢子葉球形態和細胞發育動態變化
周洋 楊章旗 黃永利

摘 要: 為了解濕地松‘松泰小孢子葉球在發育過程形態是否有差異變化,明確其敗育過程、敗育方式及影響因素,為濕地松雄性不育品種利用和后期開展相關研究提供科學依據。該研究以‘松泰 s10敗育系和s9可育系為材料,觀察小孢子葉球形態發育變化,并對其小孢子葉球進行石蠟切片,在光學顯微鏡下觀察小孢子發育過程。結果表明:s10敗育系和s9可育系在小孢子母細胞減速分裂前無明顯差異,小孢子葉球生長趨勢也一致;四分體時期,s10小孢子細胞發育異常,小孢子葉球形態發育也出現異常,二者異常發育具有同步性;可育系從四分體到單核小孢子發育階段的時間為5 d左右,而敗育系持續發育長達20 d左右,持續時間為可育系的4倍。在此期間出現小孢子絨氈層細胞發育異常、降解緩慢,小孢子囊壁組織排列紊亂、降解延遲等現象,s10形成異常二核花粉,且無花粉散出。因此,推論s10小孢子敗育的原因主要是小孢子囊壁細胞發育異常,其小孢子葉球形態異常,相對應的絨氈層在四分體時期發育異常,不能適時地分泌胼胝質酶來降解圍繞著四分體的胼胝質壁,也不能適時地合成輸送花粉形成所需能量物質,同時囊壁細胞出現降解延遲和層積,這一系列的異常變化導致不能形成正常四分體,從而使花粉敗育。
關鍵詞: 濕地松, 小孢子葉球, 雄性不育, 細胞發育, 形態變化
中圖分類號: Q944.46 ?文獻標識碼: A
文章編號: 1000-3142(2020)04-0482-10
Abstract: In order to understand whether there are differences in morphology of microstrobilus of Pinus elliottii ‘Songtai during development, to clarify its abortion process, abortion mode and influencing factors, and to provide scientific basis for utilization and later research of male sterile varieties of Pinus elliottii, the morphological changes of microstrobilus were observed by using ‘Songtai s10 abortive line and s9 fertile line as materials, and the microstrobilus was sliced in paraffin and the development of microspore was observed under optical microscope. The results were as follows: There was no significant differences between s10 abortion line and s9 fertile line before meiotic phase of microsporocy deceleration and division, and the growth trend of microstrobilus was the same. In the period of tetrad, s10 microspore cell development and microstrobilus morphological development were abnormal. The time from tetrad to monocyte microspore development of fertile lines is about 5 d. However, the abortion line continued to develop for about 20 d, and the duration was four times that of the fertile line. In the meantime, the development of tapetum cells was abnormal, the degradation was slow, the tissue arrangement of microsporangium wall was disordered, and the degradation was delayed. Finally, s10 forms abnormal dinuclear pollen and no pollen dispersion. So it can be reasoned that the abnormal development of microsporangium wall cells, and the abnormal morphology of microstrobilus.The tapetum develops abnormally in the tetrad period, and the callose enzyme can not be secreted at appropriate time to degrade the callosum wall surrounding the tetrad, nor can it synthesize and transport the energy substances needed for pollen formation in a timely manner. At the same time, the cystic wall cells showed delayed degradation and lamination. This series of abnormal changes leaded to the normal tetrad could not be formed, which made the pollen abortion.
Key words: Pinus elliottii, microstrobilus, male sterile, cell development, morphological changes
濕地松(Pinus elliottii)原產于美國東南部溫濕多雨的低海拔地區,海拔600 m以上,常綠大喬木(鄭萬鈞等,1978;朱志淞,1993)。我國最早在20世紀30年代開始引種濕地松,并于1964年在廣東省臺山縣建立了第一個濕地松初級種子園(唐國強,2015)。從20世紀70年代開始大面積推廣濕地松以來,從海南島屯昌縣(110°26′ E、19°22′ N,年平均溫度23.16 ℃)到山東半島的青島(120°25′ E、36°09′ N,年均溫11.9 ℃),再到煙臺(122° E、37°25′ N,年均溫12 ℃),西至云南均有濕地松分布(潘志剛和游應天,1994)。目前濕地松在我國的人工林種植面積已超過300萬公頃,成為了人工喬木林十大主要優勢樹種之一(張帥楠,2017)。
雄性不育(male sterility, MS)在高等植物中普遍存在,是指植物體不能產生正常有功能的花粉、花藥或雄配子的遺傳現象(范彥君等,2016)。“植物雄性不育”的概念最早在1876年由Coleman提出,迄今為止己在43個科、162個屬、320個種中發現雄性不育現象(Kaul, 1988; Wise & Pring, 2002)。當前雄性不育的研究主要以經濟農作物為主,研究也較為全面和深入,而林木由于育種時間長、不育材料發現少、生長周期長以及后期生長觀測較難等原因,致使其研究較為復雜和困難,可查及的文獻相對較少,研究深度也較淺,而松科類等裸子植物的雄性不育研究報道更為少見。‘松泰來源于美國佛羅里達州濕地松種源,于20世紀80年代,全國國外松協作組開展了濕地松引種種源試驗,利用廣西點種源試驗的結果,1992年—1993年在南寧市林科所營建濕地松改良1代無性系種子園。團隊經過連續5年以上的物候觀測,‘松泰均無花粉散出,表現出雄性敗育特征(唐國強,2015)。本次研究采用南寧市林科所濕地松改良1代種子園內‘松泰s10敗育系和可育系s9為實驗材料,通過對其小孢子葉球的形態發育過程、小孢子及其囊壁細胞結構發育過程進行觀察,跟蹤和了解‘松泰小孢子葉球的敗育過程、敗育方式及敗育時間等,以期為濕地松雄性不育的敗育機制及今后濕地松敗育相關研究提供基礎。同時,豐富林木雄性不育材料的不育機制理論,對松樹雜交育種及其雜種優勢利用提供依據。
1 材料與方法
1.1 材料
材料均采自廣西南寧市林業科學研究所濕地松改良1代25年生種子園內‘松泰s10敗育系和s9可育系植株。種子園位于108°00′ E、23°10′ N,屬南亞熱帶南緣季風氣候區,年均氣溫21.5 ℃,年均降雨量1 246 mm,年均蒸發量1 613.8 mm,全年無霜期358 d,干濕季節變化明顯,平均相對濕度約79%,林地建在石灰巖峰林峰叢間寬闊的緩丘臺地帶,海拔高約120 m,土壤為赤紅壤,pH為5.5~6.5,土層深厚。
1.2 研究方法
在濕地松種子園內分別確定3株‘松泰s10敗育系和s9可育系作為取樣植株,于2018年12月13日(小孢子葉球開始大量出現)開始取樣,直到敗育系小孢子葉球脫落(2月13號)和正常系小孢子葉球散粉完畢時(2月中旬)停止取樣。2019年1月23號前,間隔6~7 d采一次;1月23號到2月7號,間隔3~4 d采一次;取樣量每株樹不少于15個小孢子葉球,并用FAA固定液固定于50 mL離心管內,貼上標簽保存于4 ℃的冰箱內備用。
1.2.1 小孢子葉球形態觀測 按照取樣時間的不同選擇具有代表性的小孢子葉球,觀察記錄其外部形態發育變化;每次采樣隨機選擇30個小孢子葉球測量其長度與寬度,并記錄分析其動態變化趨勢。
1.2.2 小孢子及囊壁組織發育觀測 采用常規石蠟制片方法,通過愛氏蘇木精整體染色、脫水、透明、浸蠟、包埋、切片、封片等步驟(葉寶興等,2011),對小孢子葉進行橫切(切片厚度為5 μm),中性樹膠封片,選取最具有代表性且清晰的樣片,利用電動光學顯微鏡(型號:Axio Imagr Z2m)觀測不同時期小孢子內部形態的發育變化并做好相關記錄。
2 結果與分析
2.1‘松泰s10敗育系與s9可育系小孢子葉球生長期發育的動態變化
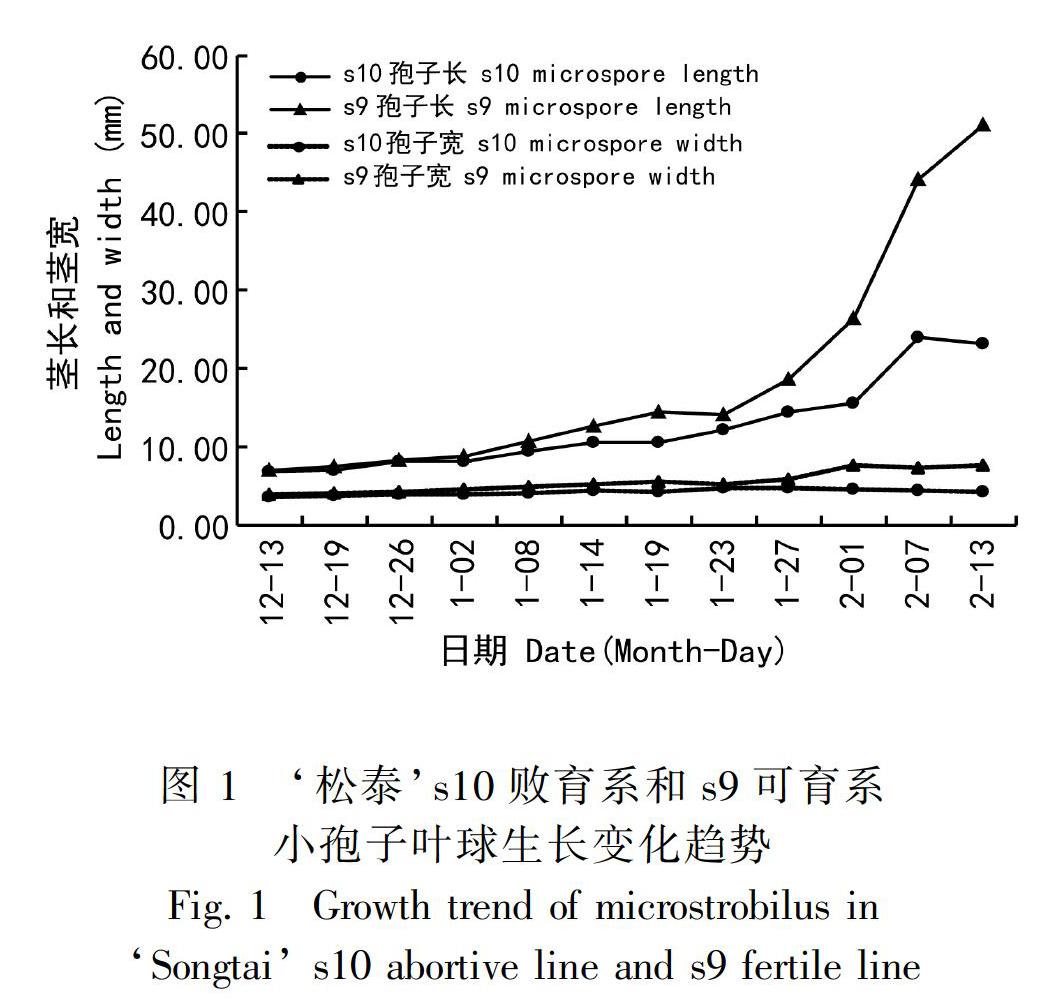
通過兩個月連續采樣,‘松泰s10與s9小孢子葉球生長發育變化趨勢見圖1。由圖1可知,1月中旬前,敗育系和可育系小孢子葉球個體生長發育較慢,s10與s9小孢子葉球的孢子長和寬并無明顯差異,表明二者在生長速率上差異不明顯,生長趨勢基本相同;1月下旬,小孢子葉球進入快速生長期,小孢子葉球莖長開始急速增長,s10與s9小孢子葉球的莖長生長量也開始出現差異,且隨著生長時間的延長,差異越來越明顯,猜測s10小孢子葉球中的小孢子在1月下旬時敗育已經發生,其敗育開始時間點在1月下旬前,這在形態觀察及后期的切片觀察實驗中得到證實。2月份后,s9小孢子葉球生長放慢,s10小孢子葉球在2月初即停止生長發育,小孢子葉球干枯萎縮,體型縮小,s10與s9小孢子的莖長差異急劇加大,直至2月中旬小孢子葉球脫落時二者的莖長生長量差達到最大值;而s10與s9小孢子葉球的寬長從小孢子葉球的開始生長直到脫落均無顯著差異。
2.2 ‘松泰s10敗育系與s9可育系小孢子葉球形態發育比較
通過對‘松泰s10敗育系與s9可育系小孢子葉球形態發育觀察發現,‘松泰s10敗育系在1月中旬時,小孢子葉球頂端開始出現干癟枯散的異常現象,在1月底表現最為明顯,且無花粉散出,而同時期s9小孢子葉球發育正常,故推測s10小孢子葉球敗育時間開始于1月中旬,即頂端出現干癟枯散現象時,具體不同時間階段比較分析如下。12月中旬:小孢子葉球聚集成簇腋生,被鱗片包裹著,鱗片黃褐色,呈卵型(圖2: a, s9),與s9形態發育相同,無異常發育(圖2: A, s10)。12月底:頂端露出鱗片,小孢子葉呈紫黑色(圖2: b, s9)。次年1月初:緩慢發育,呈圓錐形,小孢子葉呈紫黑色(圖2: C, s9),頂端露出鱗片,小孢子葉呈紫黑色(圖2: B, s10)。1月中旬:緩慢發育,呈圓錐形,小孢子葉呈紫黑色,并出現排列松散、不飽滿等異常狀態(圖2: C, s10)。1月底:小孢子葉球快速生長露出鱗片,小孢子葉成列或交互對生的排列在小孢子葉球中軸上,緊密飽滿,呈淺紫色(圖2: d, s9),小孢子葉球露出鱗片,生長發育緩慢,小孢子葉排列與可育系相同,小孢子葉球頂端,干癟枯散更加明顯,呈淺紫色(圖2: D, s10)。2月初:小孢子葉膨大飽滿,小孢子葉球松軟,呈黃色,開始散粉(圖2: e, s9),小孢子葉球整體呈枯散干癟狀,頂端呈紫紅色,底部呈淡黃色,開始脫落,但未見花粉散出(圖2: E, s10)。2月中旬:散粉后期,小孢子葉球大量散粉,并開始脫落(圖2: f, G, s9),小孢子葉球干癟萎縮,明顯小于可育系,大量脫落且無花粉散出(圖2: F, G, s10)。
2.3 ‘松泰s10敗育系和s9可育系小孢子葉球橫切觀察
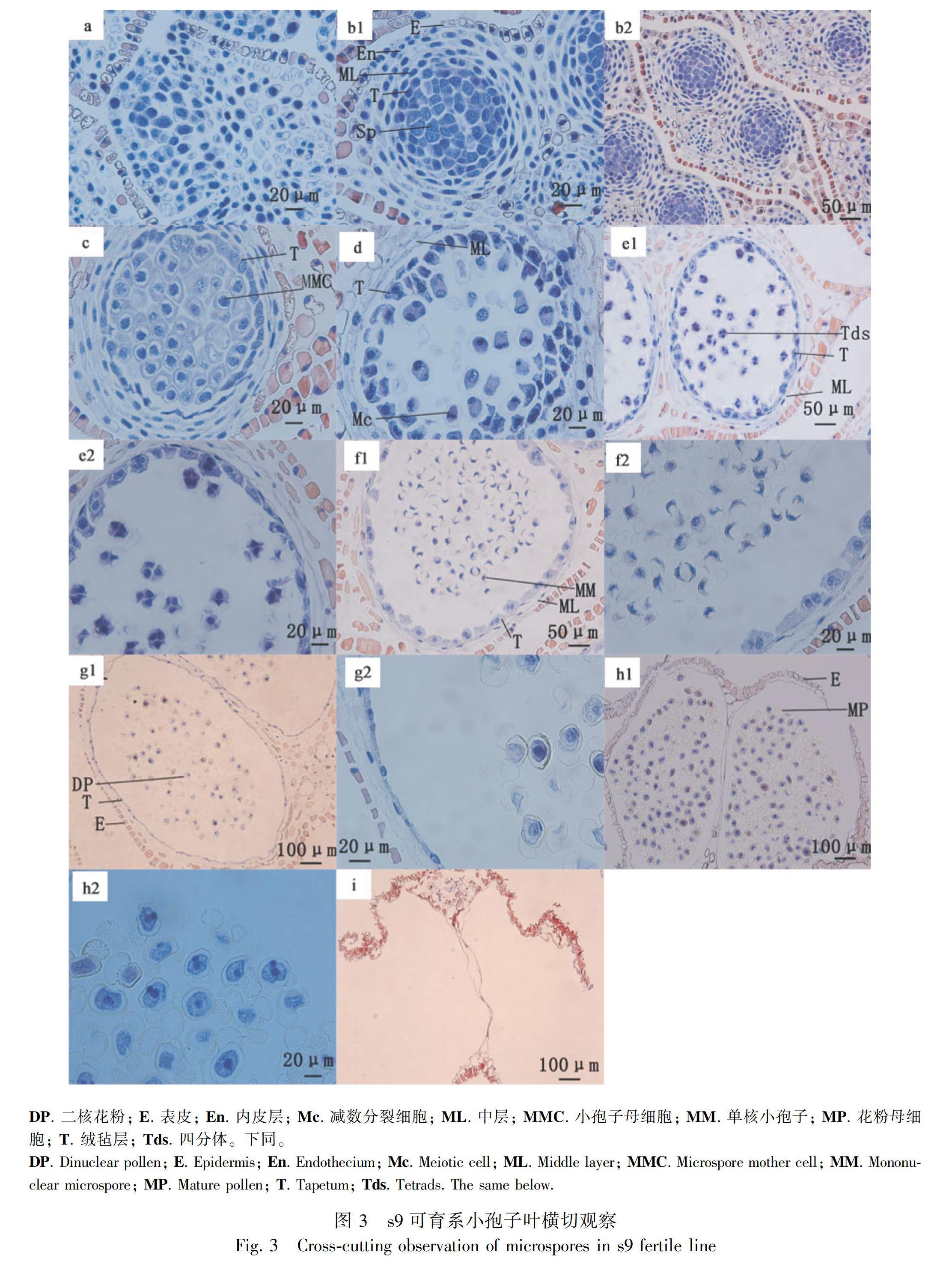
松科植物的花粉(雄性配子體)是在小孢子囊中孕育而來(林金星,2013),小孢子發育過程主要歷經初生造孢細胞(primary sporulation tissue period)、造孢細胞(sporulation tissue period)、小孢子母細胞(microsporocyte period)、小孢子母細胞減數分裂(meiotic phase of microsporocyte)、四分體(microspore tetrad period)、單核(mononuclear period)、二核細胞(dinuclear period)、散粉期(loose powder period)等時期(林金星,2013;Sanchez, 2018)。通過對小孢子葉球橫切觀察(圖3,圖4)發現,濕地松小孢子葉球從小孢子造飽細胞出現直到散粉完成需要60 d左右;與s9可育系小孢子相比,s10敗育系小孢子在四分體時期發育異常,部分小孢子明顯萎縮變形,并在后期的發育中同一小孢子葉球的發育情況不一致;小孢子囊壁組織也在四分體時期出現明顯差異,s10敗育系小孢子絨氈層細胞排列異常、降解緩慢,中層和內壁組織在單核小孢子時期也出現層積,降解緩慢延遲等現象;具體不同發育時期的比較分析如下。
初生造孢組織期:小孢子葉球生長發育初始階段,小孢子葉還未形成成熟小孢子囊(圖3: a, s9),與s9可育系發育情況一致(圖4: A, s10)。
造孢組織時期:每個小孢子葉孕育兩個小孢子囊腔,呈同心體對稱結構。小孢子囊分層清晰,從內到外分別是造胞細胞、絨氈層、中層、內壁和表皮細胞;造胞細胞和絨氈層排列緊密分明,細胞質稠密,整個細胞著色;中層、內壁及表皮細胞圍繞絨氈層排列整齊,核大染色清晰(圖3: b1, b2, s9),與s9可育系發育情況一致,形成同心體結構,細胞層次清晰(圖4: B, s10)。
小孢子母細胞時期:小孢子母細胞體積增大,呈圓形,核大染色深,核周圍有一圈不著色區域(空泡化);絨氈層細胞核分裂,出現雙核,體積增大,細胞質稠密,著色深,圍繞小孢子母細胞排列;中層、內壁細胞拉長,核著色深;表皮細胞核開始消失(圖3: c, s9),囊腔體積明顯小于同時期s9可育系,其他細胞發育情況與s9一致(圖4: C, s10)。
小孢子母細胞減數分裂期:每個小孢子母細胞散落分布在小孢子囊腔內,進行著減數分裂但不同步。絨氈層繼續緊緊圍繞在小孢子母細胞外(圖3: d, s9),小孢母細胞進行減數分裂,小孢子散落分布于囊腔中;絨氈層圍繞在小孢子外,被拉長。觀察到同一個小孢子葉球,從頂端往下發育階段不一致,分別是四分體時期、減數分裂中、后時期、母細胞減數分裂間期(圖4: D, s10)。
小孢子四分體時期:小孢子母細胞形成四分體,4個小孢子被胼胝質壁包圍,散落分布于小孢子囊腔中;絨氈層繼續圍繞小孢子四分體,染色變淺;小孢子囊壁細胞生長增快,囊腔體積增大明顯,中層和內壁細胞被拉長降解,表皮細胞發生角質化加厚(圖3: e1, e2, s9),小孢子母細胞分裂形成四分體,4個小孢子被胼胝質壁包圍,部分小孢子形態明顯萎縮變形;絨氈層在此時期排列不整齊,被拉長,核染色較深;小孢子壁細胞生長較快,囊腔體積增大(圖4: E1, E2, s10)。
單核時期:胼胝質釋放出小孢子,形成單核小孢子,核染色明顯,具有兩個氣囊;絨氈層染色淺,開始降解;中層及內壁繼續降解(圖3: f1, f2, s9),單核時期同一小孢子葉球中發育情況不一致。a-c. s9小孢子葉球緩慢發育期; d-e. s9小孢子葉球急速增長; f. s9散粉期; A, B. s10小孢子葉球緩慢發育期; C. s10小孢子葉球頂端出現異常; D-F. s10小孢子葉球異常發育; G. 散粉期對比。
(1)有形態不一的單核花粉形成,有氣囊;絨氈層降解明顯,排列紊亂;中層、內壁細胞組織層積,降解延遲,細胞核染色可見。(2)無單核花粉形成,囊腔中只有一些形態怪異干癟萎縮的殘留物,形成空囊(圖4: F1, F2, s10)。
二核時期:形成二核花粉,氣囊膨大明顯;絨氈層已經降解但還具有殘留物;中層降解完,全部液泡化(圖3: g1, g2, s9),同一小孢子葉球中發育情況不一致。(1)單核小孢子發生解體,破碎化,發生敗育,但有少部分形態異常2核花粉形成,有氣囊;絨氈層已降解,還有部分殘留物;中層及內壁細胞膨大液泡化,開始大量降解。(2)小孢子囊腔形成空囊,只見一些殘留物(圖4: G1, G2, s10)。
散粉初期和散粉后期:囊腔內擠滿發育成熟的二核花粉,絨氈層、中層及內壁完全消失,表皮層開裂,開始散粉(圖3: h1, h2, s9),后期完成散粉,只見殘留囊壁(圖3: i, s9),無正常花粉散出,且同一小孢子葉球中發育情況不一致。(1)有部分形態異常成熟花粉形成,氣囊萎縮不飽滿;絨氈層,中層及內壁細胞消失,表皮不開裂;(2)小孢子囊腔中無花粉形成,只有一些干癟萎縮的殘留物(圖4: H1, H2, s10)。
2.4 ‘松泰 s10敗育系與s9可育系小孢子葉球及小孢子發育進程比較
結合小孢子葉球形態變化和小孢子石蠟切片觀察比較發現,s10敗育系和s9可育系在小孢子母細胞減速分裂前并無明顯差異,小孢子葉球生長趨勢也一致;四分體時期,s10小孢子細胞發育異常,小孢子葉球形態發育也出現異常,二者異常發育具有同步性;從四分體到單核小孢子發育階段,s10敗育系與s9可育系差異最為顯著,s9小孢子葉球在這一階段快速增長,發育迅速,直至散粉,s10小孢子葉球則增長緩慢,發育延遲,出現干癟萎縮現象,直至脫落;因此,推測四分體到單核小孢子發育階段是s10小孢子敗育發生的主要時期。二者具體發育進程比較見表1。DP. 二核花粉; E. 表皮; En. 內皮層; Mc. 減數分裂細胞; ML. 中層; MMC. 小孢子母細胞; MM. 單核小孢子; MP. 花粉母細胞; T. 絨氈層; Tds. 四分體。下同。
3 討論
對濕地松‘松泰小孢子葉球發育過程的研究結果表明:從1月中旬開始,小孢子葉球頂端開始出現干癟松散異常現象,該時期的一個小孢子葉球從頂端到底部,小孢子發育時期不一致(頂端為四分體、中部為減數分裂中、后時期、底部為減數分裂間期),并在四分體釋放單核小孢子這一時期出現異常,造成敗育。因此研究認為‘松泰小孢子葉球敗育時期開始于四分體時期,這與Kaul(1988)的研究結果類似, Kaul (1988)對多種雄性不育類型花粉敗育時期進行統計發現,花粉敗育在造胞細胞至二核花粉各時期均有可能發生,其中有70%的材料敗育時期發生在四分體以后。而在四分體后續的發育過程中,同一個小孢子葉球中小孢子的發育分為兩種趨勢,一種是在小孢子葉球中上部分,胼胝質不能釋放單核小孢子,沒有單核小孢子的形成,直接降解萎縮,與絨氈層一起形成絮狀物,形成空囊,直至小孢子葉球脫落,囊壁表皮不開裂;另外一種發育趨勢則是在小孢子葉球的中下部分,四分體在胼胝質解體后,可以釋放出小孢子,形成異常單核小孢子繼續發育。這種同一個小孢子葉球中存在兩種不同的敗育方式,在杉木中也有發現(林金星等,2013)。而呂洪飛和余象煜(1999)在對杉木雄性不育細胞學研究中發現同一個小孢子葉球中同時存在無小孢子囊型、減數分裂I期前中層細胞增生型、減數分裂I期后中層細胞增生3種敗育類型,該研究認為小孢子囊壁的中層、內壁出現層積和降解延遲、表皮不開裂的異常發育現象也會影響小孢子的后續發育,造成敗育發生。
絨氈層是構成花藥壁的最內層組織結構,圍繞著小孢子分布,在物質代謝合成與分泌上都十分活躍,含有豐富的營養物質,是物質輸送的最后中轉站,對花粉的正常發育具有關鍵作用(范彥君等,2016;Tian et al., 2017)。本次研究結果顯示,‘松泰小孢子葉球在四分體時期之前與可育系相比并無異常,但在四分體時期,小孢子葉球開始出現異常,其胼胝質溶解緩慢,絨氈層及中層細胞降解延遲;可育系從四分體到單核小孢子發育階段的時間為5 d左右,而敗育系持續發育長達20 d左右,持續時間為可育系的4倍。在此期間,敗育系的絨氈層與可育系相比發育緩慢,降解延遲,導致其不能及時的分泌和轉化小孢子發育所需能量物質,造成敗育發生,這與唐國強(2015)對濕地松小孢子葉球敗育研究結果一致,劉望舒等(2019)在對楊樹雄性不育小孢子敗育過程的研究中也認為絨氈層的延遲降解會導致小孢子發生敗育;譚智文等(2013)與李六林(2007)分別對不同梨品種有關小孢子敗育過程的研究中也發現存在絨氈層、中層細胞的異常發育現象;這種現象在小麥(趙卜等,2015)、棉花(孔祥軍,2017)等其他植物有關雄性不育的細胞學觀察中,也有發生。同時,敗育系胼胝質降解緩慢,不釋放或不能及時的釋放單核小孢子,直接影響到小孢子的正常發育;而胼胝質合成于母細胞減數分裂時期,降解于四分體釋放小孢子時期,在這過程中它的合成、積累、抑或降解,任何一個步驟出現異常,都可能會造成敗育的發生( Down et al., 2008; Wan et al., 2011;楊莉芳和刁現民,2013)。
4 結論
小孢子發育過程的細胞學觀察是了解濕地松雄性敗育途徑、方式的重要研究手段,也是濕地松雄性不育家系在雜交育種優勢利用中的研究基礎。本次研究以‘松泰 s10敗育系和s9可育系為材料,通過對其小孢子葉球形態和細胞發育動態變化觀察發現,s10敗育系和s9可育系在小孢子母細胞減速分裂前無明顯差異,小孢子葉球生長趨勢也一致;但在四分體時期,‘松泰小孢子細胞組織發育異常,同時在小孢子葉球形態上也能觀察到干癟枯散現象,表明其外部形態變化和細胞異常發育具有同步性;此外,敗育系從四分體到單核小孢子階段與可育系相比發育時間較長,且在此期間敗育系出現小孢子絨氈層細胞發育異常、降解緩慢,小孢子囊壁組織排列紊亂、降解延遲等現象,最后,s10形成異常二核花粉,且無花粉散出。因此推論s10小孢子敗育的原因主要為小孢子囊壁細胞發育異常,其小孢子葉球形態異常,相對應的其絨氈層在四分體時期發育異常,不能適時地分泌胼胝質酶來降解圍繞著四分體的胼胝質壁,也不能適時地輸送花粉形成所需能量物質,同時囊壁細胞出現降解延遲和層積。這一系列的異常變化導致不能形成正常四分體,從而使花粉敗育。
參考文獻:
DOWN T, RAKYAN V, TUMER D, et al., 2008. A bayesian deconvolution strategy for immunoprecipitation-based DNA methylome analysis [J]. Nat Biotechnol, 26(7):779-785.
FAN YJ, WANG Y, LIU QY, et al., 2016. Advances in cytoplasmic male sterility in plant [J]. Chin Agric Sci Bull, 32(18): 70-75. [范彥君, 王瑜, 劉齊元, 等, 2016. 植物細胞質雄性不育研究進展 [J]. 中國農學通報, 32(18): 70-75.]
KAUL M, 1988. Male sterility in higher plants [M]. Springer Berlin Heidelberg.
KONG XJ, 2017. Studies on cytology and molecular biology of male sterility line H276A in Gossypium barbadense [D]. Nangning: Guangxi University. [孔祥軍, 2017. 海島棉H276A雄性不育的細胞學與分子生物學基礎研究 [D]. 南寧:廣西大學.]
LIN JX, HU YX, WU H, 2013. The biology of pollen in gymnosperms [M]. 1st ed. Beijing: Science Press: 37-40. [林金星, 胡玉熹, 吳鴻, 2013. 裸子植物花粉生物學 [M]. 1版. 北京:科學出版社: 37-40.]
LI LL, 2007. Study on the cytological and physiological characteristics of pollen abortion of ‘Niitaka (Pyrus pyrifolia Nakai) [D]. Nanjing: Nanjing Agricultural University. [李六林, 2007. ‘新高梨花粉敗育的細胞學和生理特性研究 [D]. 南京:南京農業大學.]
LIU WS, HAN LZ, ZHU W, et al., 2019. Cytological observation on pollen development of the male sterile poplar variety [J]. J Nanjing For Univ (Nat Sci Ed), 43(1): 198-203. [劉望舒, 韓林芝, 朱嵊, 等, 2019. 楊樹雄性不育品種花粉發育過程的細胞學觀察 [J]. 南京林業大學學報(自然科學版), 43(1): 198-203.]
L HF, YU XY, 1999. Change of callose wall and spropollenin of microsporangium abortion in Cunninghamia lanceolata [J]. J NW Bot, 19(1): 108-112. [呂洪飛, 余象煜, 1999. 杉木小孢子囊敗育過程中的胼胝質壁和孢粉素的消長 [J]. 西北植物學報, 19(1): 108-112.]
PAN ZG, YOU YT, 1994. Introduction and cultivation of major exotic tree species in China [M]. Beijing: Science and Technology Press: 79-92. [潘志剛, 游應天, 1994. 中國主要外來樹種引種栽培 [M]. 北京: 科學技術出版社: 79-92.]
SANCHEZ D, SONIA V, 2018. Embryology of Mammillaria dioica (Cactaceae) reveals a new male sterility phenotype [J]. Flora, 241: 16-26.
TAN ZW, JIN BK, CAO HN, et al., 2013. Study on male sterility cytology of small perfume pear in Yanbian [J]. J Agric Sci Yanbian Univ, 35(1): 28-31. [譚智文, 金炳奎, 曹后男, 等, 2013. 延邊小香水梨雄性不育細胞學研究 [J]. 延邊大學農學學報, 35(1): 28-31.]
TIAN Y, XIAO S, LIU J, et al., 2017. MALE STERILE6021 (MS6021) is required for the development of anther cuticle and pollen exine in maize [J]. Sci Rep, 7(1): 16736.
TANG GQ, 2015. Study on the growth and physiological characteristics of Pinus elliottii male sterile clone (SG001) [D]. Nanning: Guangxi University. [唐國強, 2015. 濕地松雄性不育無性系(SG001)生長及生理特性研究 [D]. 南寧:廣西大學.]
WAN L, ZHA W, CHENG X, et al., 2011. Arice β-1,3-glucanase gene Osg1 is required for callose degradation in pollen development [J]. Plant, 233(2): 309-323.
WISE R, PRING D, 2002. Nuclear-mediated mitochondrial gene regulation and male fertility in higher plants: Light at the end of the tunnel ? [J]. Proc Natl Acad Sci, 99 (16): 10240-10242.
YANG LF, DIAO XM, 2013. Progress in identification of plant male sterility related nuclear genes [J]. J Plant Gene Resour, 14(6): 1108-1117. [楊莉芳, 刁現民, 2013. 植物細胞核雄性不育基因研究進展 [J]. 植物遺傳資源學報, 14(6): 1108-1117.]
YE BX, BI JJ, SUN YS, 2011. Research methods of plant cell and tissue [M]. Beijing: Chemical Industry Press. [葉寶興, 畢建杰, 孫印石, 2011. 植物細胞與組織研究方法 [M]. 北京:化學工業出版社.]
ZHAO B, ZHANG XZ, ZHENG YJ, et al., 2015. Cytological observation on meiosis and development of microspores in F-type male sterile wheat line [J]. J Triticeae Crop, 35(7): 918-925. [趙卜, 張向展, 鄭煒君, 等, 2015. F型小麥雄性不育系小孢子發育的細胞學觀察 [J]. 麥類作物學報, 35(7): 918-925.]
ZHANG SN, 2017. Study on the evaluation technique of wood property and multiple trait selection of Pinus elliottii [D]. Beijing: Chinese Academy of Forestry. [張帥楠, 2017. 濕地松材性測定技術研究與多樣性聯合選擇 [D]. 北京:中國林業科學研究院.]
ZHENG WZ, FU LG, 1978. Flora Reipublicae Popularis Sinicae [M]. Beijing: Science Press, 7: 273-275. [鄭萬鈞, 傅立國, 1978. 中國植物志 [M]. 北京: 科學出版社, 7: 273-275.]
ZHU ZS, 1993. Pinus elliottii [M]. Guangzhou: Guangdong Science and Technology Press, 3: 1-4. [朱志淞, 1993. 濕地松 [M]. 廣州:廣東科技出版社, 3: 1-4.]
(責任編輯 周翠鳴)

