響應面分析法優化羅望子多糖提取工藝
邵慧敏, 張 匯, 向雨維, 楊 柳, 宋子波, 艾連中
(1. 上海理工大學 醫療器械與食品學院,上海 200093;2. 云南貓哆哩集團有限責任公司,玉溪 653100)
羅望子( Tamarindus indica L.) 是蘇木科(Caesalpiniaceae)酸豆屬(Tamarindus)的一種常綠大型喬木[1],又稱酸角、酸梅、酸豆、羅晃子、通血香等[2],盛產于緬甸、孟加拉、印度、老撾等國[3]。羅望子果肉酸甜,可供食用,營養價值高。羅望子種仁含有質量分數為65%~73%非纖維碳水化合物、15%~20%蛋白質、6%~8%脂肪、3%~5%纖維和2.5%~3.2%灰分[4]。研究表明,從羅望子種仁中提取的羅望子多糖是一種中性多糖[5],具有凝水、穩定、增稠、成膜、乳化等優良的理化性質[6-7],且耐熱、耐酸、耐堿、耐凍,是一種理想的食品添加劑。羅望子多糖分子結構為:主鏈是β-D-1,4 糖苷鍵連接的葡萄糖,側鏈是α-D-1,6 糖苷鍵連接的木糖和β-D-1,2 糖苷鍵連接的半乳糖[8];其分子量在720~880 kDa[9]。在我國海南、云南、廣西、四川等地均有羅望子的栽培[10],但其利用率極低,特別是對于羅望子多糖的開發利用。
目前,我國只有少數報道研究了關于羅望子多糖的提取及優化,如闞歡等[11]對料液比、pH 和沉降時間進行研究,將羅望子多糖的得率提高至52%;郇延軍等[12]加入了酶解工藝,羅望子多糖的得率達到55%;而在王文光等[13]的研究中,優化后的多糖得率可達70.2%。以上研究均以提取物得率為應變量,并未驗證其中多糖含量的高低,忽略了提取物中所含有的雜質,無法真正反映出羅望子多糖的提取率。另外,國家標準規定了羅望子多糖中蛋白質質量分數不得超過3%,但國內仍未有關于低蛋白羅望子多糖的研究。因此,本研究將綜合羅望子多糖提取率和蛋白質質量分數兩個指標,采用響應面分析法對羅望子多糖的提取工藝進行優化,以得到一種高效、經濟的工藝,并獲得符合國家標準的羅望子多糖,為工業生產奠定基礎。
1 材料與方法
1.1 材料與試劑
羅望子種仁由云南貓哆哩公司提供。
葡萄糖、半乳糖、木糖標準品購于Sigma 公司;無水乙醇、苯酚、硫酸、氫氧化鈉、鹽酸、檸檬酸、硼酸購于源葉生物。
1.2 儀器與設備
ME2002E 電子天平(梅特勒-托利多儀器有限公司);FiveEasy pH 計(梅特勒-托利多儀器有限公司);RCT 德國IKA 基本型加熱磁力攪拌器(德國IKA 公司);Avanti JXN-26 智能型高效離心機(美國貝克曼庫爾特有限公司);真空干燥箱(上海一恒科學儀器有限公司);SP-752 紫外可見分光光度計(上海光譜);FOSS 全自動凱氏定氮儀Kjeltec 8400(瑞典FOSS 公司)。
1.3 實驗方法
1.3.1 提取工藝
種仁去皮、粉碎、過篩后,按料液比1∶10 加入體積分數為80%的乙醇,室溫攪拌6 h 后,離心(8 000×g,20 min)并除去上清液,將沉淀置于烘箱(40 ℃,12 h)烘干,獲得除去小分子脂質、色素等雜質后的原料。
精確稱取80 目原料5.0 g,按料液比1∶40 加入200 mL 去離子水,用1 mol/L 的檸檬酸溶液調節pH 至3.5,在磁力攪拌器上加熱至80 ℃,待溫度穩定后,恒溫浸提20 min。將懸濁液靜置冷卻后離心(8 000×g,20 min),取上清液按體積比1∶1 倒入無水乙醇(一邊快速攪拌,一邊緩慢將乙醇倒入),使溶液的乙醇最終體積分數達到50%,4 ℃靜置2 h 后過濾、取沉淀,真空干燥(40 ℃,8 h)后即可得到粗多糖。
1.3.2 單因素實驗
原料目數:分別選擇10,40,80,120,160 目原料,在其他步驟不變的條件下進行提取,測定多糖提取率和蛋白質質量分數。
料液比:在獲得上述最優條件的情況下,分別按料液比1∶20,1∶30,1∶40,1∶50,1∶60加入100,150,200,250,300 mL 去離子水,在其他步驟不變的條件下進行提取,測定多糖提取率和蛋白質質量分數。
提取pH:在獲得上述最優條件的情況下,分別調節溶液pH 至2.5,3.5,4.5,5.5,6.5,在其他步驟不變的條件下進行提取,測定多糖提取率和蛋白質質量分數。
提取溫度:在獲得上述最優條件的情況下,分別將溶液加熱至60,70,80,90,100 ℃,在其他步驟不變的條件下進行提取,測定多糖提取率和蛋白質質量分數。
提取時間:在獲得上述最優條件的情況下,分別將溶液加熱10,20,30,40,50 min,在其他步驟不變的條件下進行提取,測定多糖提取率和蛋白質質量分數。
1.3.3 多糖提取率測定
采取苯酚硫酸法,測定粗多糖中的總糖含量。配制0.1 mg/mL 樣品溶液,取1 mL 加入0.5 mL體積分數3%的苯酚溶液和5 mL 濃硫酸,振蕩后靜置20 min,在490 nm 處測定吸光度,通過標曲測定總糖含量,并計算得到多糖提取率。

式中:η 為多糖提取率;a 為總糖百分含量;m1為粗多糖質量,g;m0為原料質量,g。
1.3.4 蛋白質質量分數測定
采用凱式定氮法[14]測定多糖中蛋白質的質量分數pro,蛋白質換算系數為6.25。
1.3.5 響應面分析
以單因素實驗的結果為基礎,采用Design Expert 8.0.5 軟件中的Box-Behnken[15]實驗設計法對提取工藝進行優化,設計三因素三水平的響應面分析實驗,分別用X1,X2,X3表示3 個關鍵因素,分別以-1,0,1 編碼每一個自變量的低、中、高實驗水平,以多糖提取率(Y1)和蛋白質質量分數(Y2)為響應值。根據軟件給出的17 組不同提取條件提取多糖,并計算多糖提取率和蛋白質質量分數。
2 結果與分析
2.1 單因素實驗
2.1.1 原料目數對Y1,Y2 的影響
如圖1(a)所示,多糖提取率和蛋白質質量分數都隨著原料目數的變化而顯著變化。其中多糖提取率隨目數的升高,先上升后下降,在120 目時達到最高值。而蛋白質質量分數隨著目數的升高,先下降后上升,并且在120 目達到最低值,因此選擇120 目為最佳目數。
2.1.2 料液比對Y1,Y2 的影響
如圖1(b)所示,多糖提取率隨料液比的增加先略有上升后略有下降,但波動較小,多糖提取率在料液比1∶40 時達到最高值。料液比對蛋白質質量分數的影響并不顯著,蛋白質質量分數在料液比1∶30 時達到最低值。因此,取1∶40 為最佳料液比,與王文光等[13]對最佳料液比的研究結果一致。
2.1.3 提取pH 對Y1,Y2 的影響
如圖1(c)所示,pH 對多糖提取率的影響較小,在pH 2.5~4.5 提取率波動較小,在pH 升高至5.5 后提取率略有降低。而蛋白質質量分數隨pH 的變化較大,隨著pH 的降低,蛋白質質量分數先降低后升高,并在pH 3.5 達到最低值,因此,綜合兩項應變量,選擇pH 3.5 為最佳pH。
2.1.4 提取溫度對Y1,Y2 的影響
如圖1(d)所示,多糖提取率隨著提取溫度的升高,先升高后降低,并在90 ℃達到最大值。而其中的蛋白質質量分數也是隨著溫度的升高,先升高后降低,但波動較小。90 ℃和100 ℃的多糖提取率和蛋白質質量分數都非常接近,而70 ℃的蛋白質質量分數是顯著降低的,且從生產上來說,100 ℃的成本和能耗也更高。
2.1.5 提取時間對Y1,Y2 的影響
如圖1(e)所示,多糖提取率和蛋白質質量分數隨提取時間的延長并無顯著變化。多糖提取率隨時間的延長先略有上升,后在50 min 時下降;蛋白質質量分數隨時間的延長稍有增加。因此,綜合多糖提取率、蛋白質質量分數以及能耗情況來看,取20 min為最佳提取時間。
2.2 響應面分析
2.2.1 響應面分析方案及結果
根據單因素實驗結果可知,與原料目數、提取pH 和提取溫度相比,料液比和提取時間對多糖提取率及蛋白質質量分數的影響都不顯著,因此選擇原料目數、提取pH 和提取溫度為響應面的三因素進一步研究。采用Design Expert 8.0.5 軟件中的Box-Behnken 實驗設計法對羅望子多糖提取工藝進行分析,并處理實驗數據。響應面的分析因素及水平見表1。
實驗方案與結果見表2。對實驗結果進行方差分析及方程擬合見表3、表4。
根據多元回歸分析得到多糖提取率的回歸方程[16]:
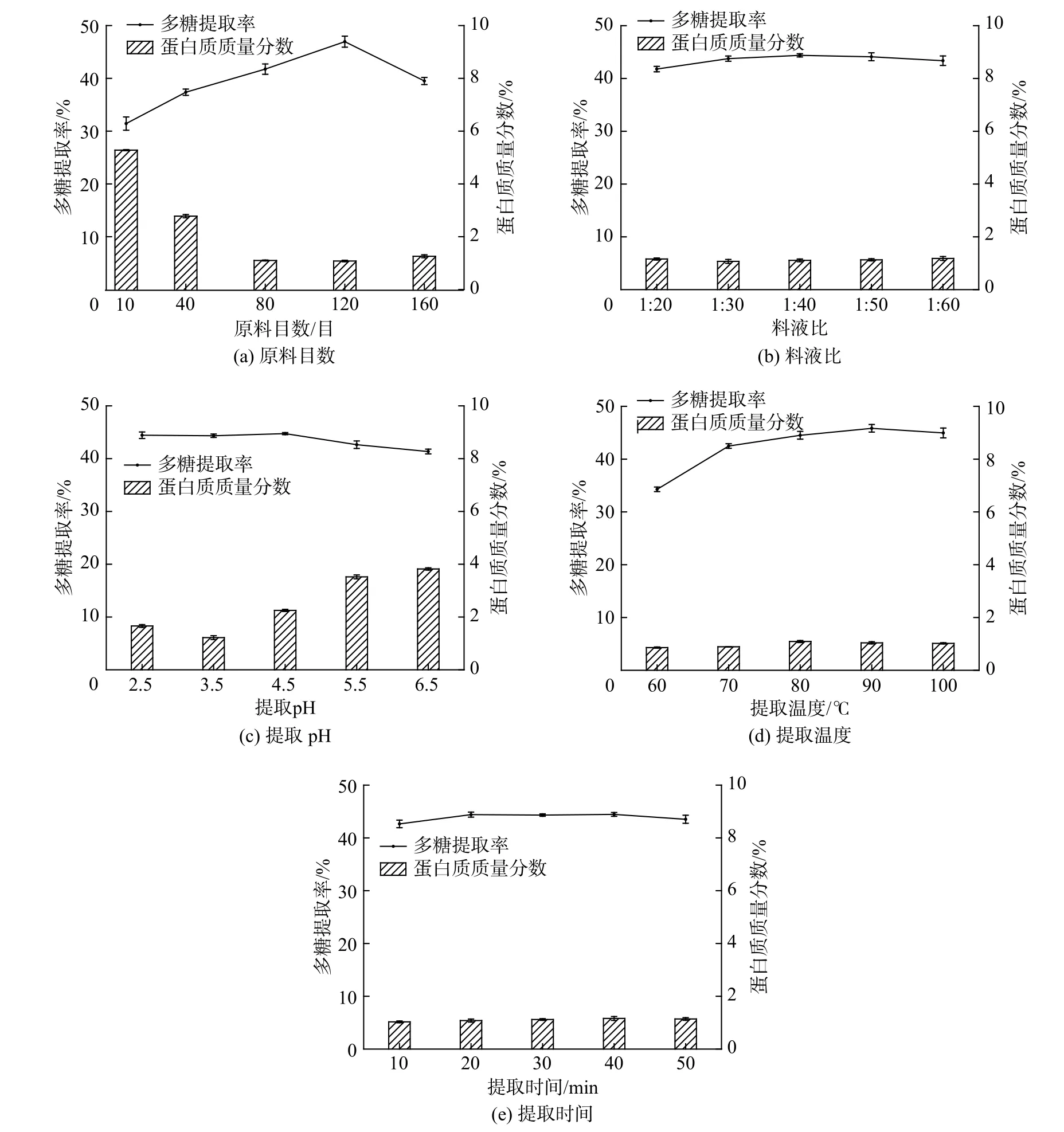
圖1 不同因素對羅望子多糖提取率和蛋白質質量分數的影響Fig.1 Effect of different factors on the extraction yield and protein mass fraction of TSP

表1 響應面分析因素與水平Tab.1 Independent variables and levels for the response surface design
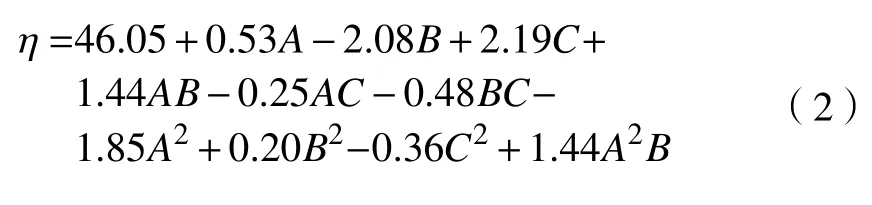
式中:A 表示原料目數;B 表示提取pH;C 表示提取溫度。
如表3 所示,模型的P<0.000 1,表明回歸方程(2)極顯著。模型校正決定系數Radj2=0.973 0,表明有97.30%可用該模型解釋,而只有2.70%無法解釋。模型確定系數R2=0.989 9,表明實際值和預測值的相關性良好[17],此二次回歸模型可用于分析羅望子多糖的提取率。由P 值可知,提取pH和提取溫度對多糖提取率的影響極顯著,原料目數對多糖提取率的影響顯著。由F 值可知[18],各因素對多糖提取率的影響貢獻率為提取溫度最高,其次為提取pH,最后為原料目數。交互項AB 和BC 影響顯著,交互項AC 影響不顯著,說明各影響因素對多糖提取率的影響不是簡單的線性關系。

表2 羅望子多糖提取響應分析方案及結果Tab.2 Analysis scheme and results for the response surface design
根據多元回歸分析得到優化提取工藝的回歸方程:
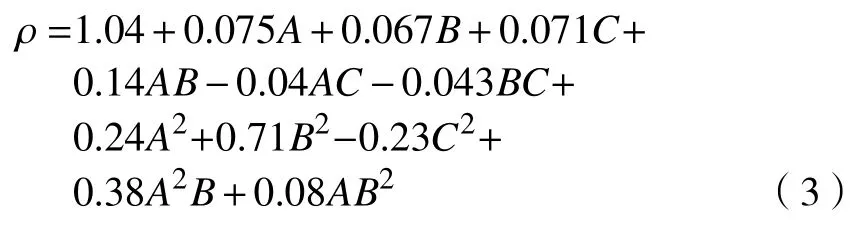
如表4 所示,模型的P<0.000 1,表明回歸方程(3)極顯著。模型校正決定系數Radj2=0.993 7,表明有99.37%可用該模型解釋,而只有0.63%無法解釋。模型確定系數R2=0.998 0,表明實際值和預測值的相關性良好[16],此二次回歸模型可用于分析羅望子多糖中蛋白質質量分數。由P 值可知,原料目數、提取pH 和提取溫度對多糖提取率的影響均為顯著。由F 值可知,各因素對蛋白質質量分數的影響貢獻率為提取溫度最高,其次為原料目數,最后為提取pH。交互項AB 影響顯著,交互項AC 和BC 影響不顯著,說明各影響因素對蛋白質質量分數的影響不是簡單的線性關系。
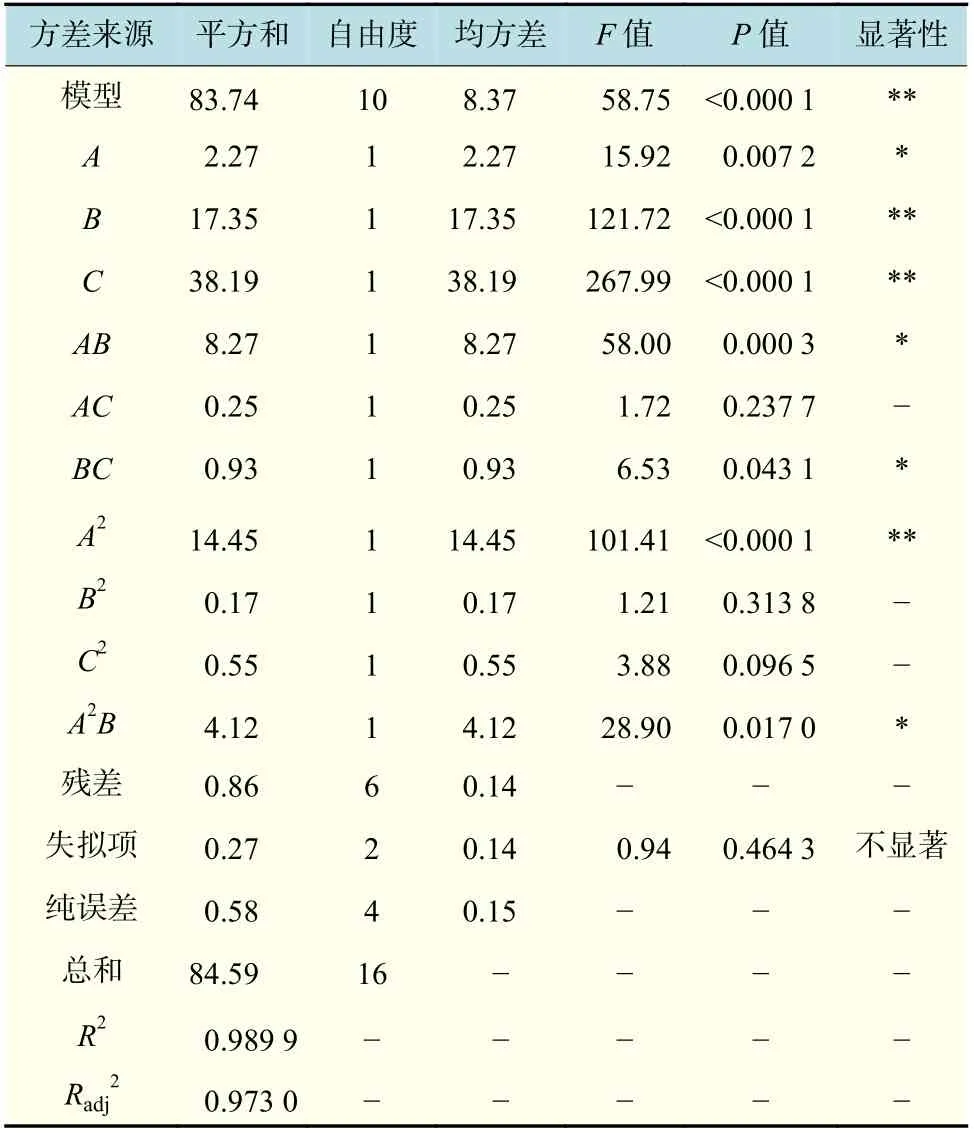
表3 羅望子多糖提取率的回歸模型方差分析Tab.3 Variance analysis variance for the fitted regression model of TSP yield
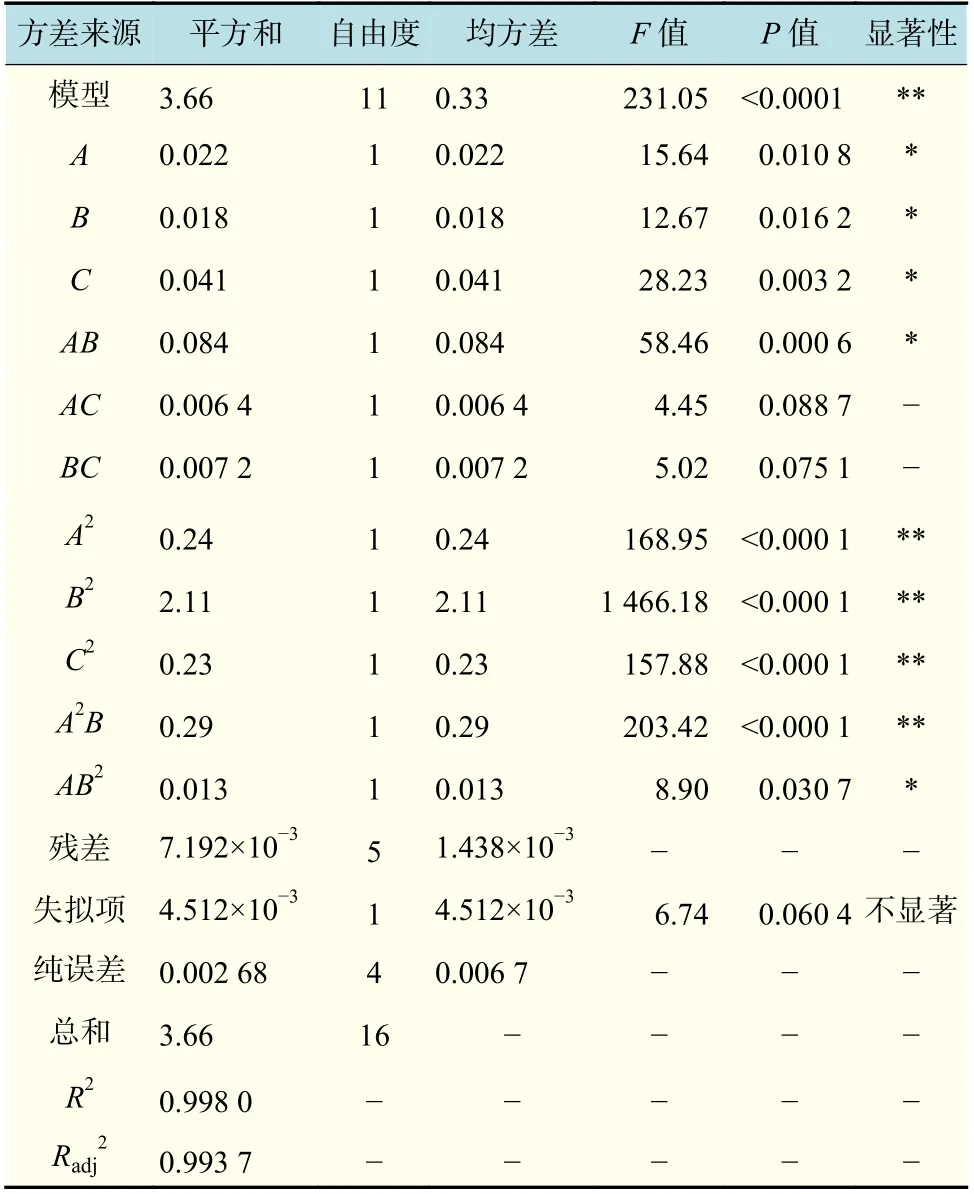
表4 羅望子多糖中蛋白質質量分數的回歸模型方差分析Tab.4 Variance analysis variance for the fitted regression model of protein mass fraction
2.2.2 交互作用分析
由圖2(a)可知,提取溫度不變時,固定原料目數,多糖提取率隨提取pH 的降低呈升高的趨勢;固定提取pH,多糖提取率隨原料目數的提高先升高后降低(P<0.05)。由圖2(b)可知,提取pH 不變時,固定原料目數,多糖提取率隨提取溫度的升高呈升高的趨勢;固定提取溫度,多糖提取率隨原料目數的提高先升高后降低。由圖2(c)可知,原料目數不變時,固定提取溫度,多糖提取率隨提取pH 的降低呈升高的趨勢;固定提取pH,多糖提取率隨提取溫度的升高呈升高的趨勢(P<0.05)。
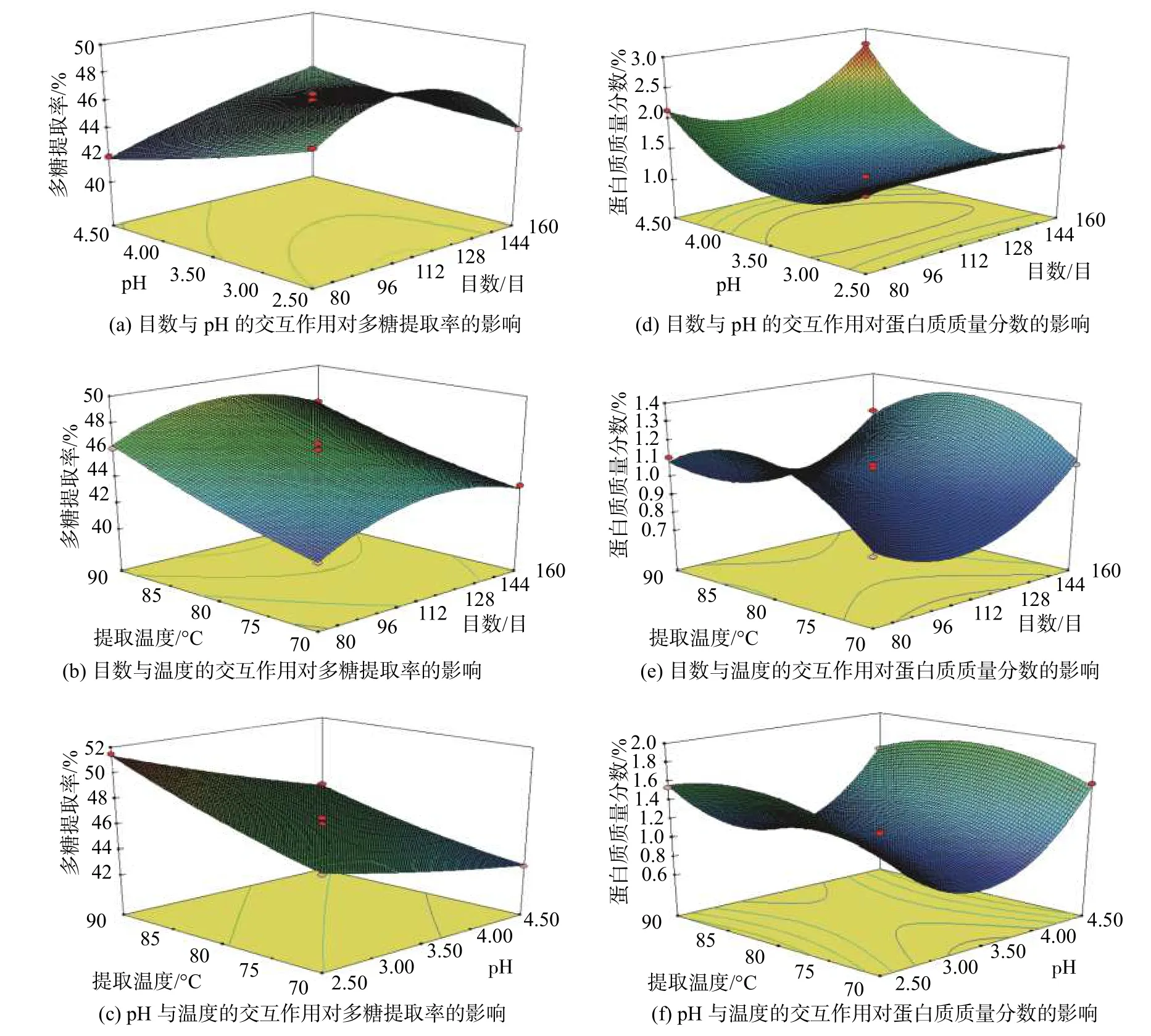
圖2 兩因素的交互作用對羅望子多糖提取率和蛋白質質量分數的影響Fig.2 Influence of response surface plots of variable parameters on the TSP yield and protein mass fraction
由圖2(d)可知,提取溫度不變時,固定原料目數,蛋白質質量分數隨提取pH 的降低先降低后升高;固定提取pH,蛋白質質量分數隨原料目數的提高先升高后降低(P<0.05)。由圖2(e)可知,提取pH 不變時,固定原料目數,蛋白質質量分數隨提取溫度的升高先升高后降低;固定提取溫度,蛋白質質量分數隨原料目數的提高先降低后升高。由圖2(f)可知,原料目數不變時,固定提取溫度,蛋白質質量分數隨提取pH 的降低先降低后升高;固定提取pH,蛋白質質量分數隨提取溫度的升高先升高后降低。
2.2.3 響應面分析最優羅望子多糖提取工藝條件
通過Design Expert 8.0.5 軟件得出多糖提取率相對高且蛋白質質量分數相對低的工藝優化方案。
優化方案為:原料目數118 目,提取pH 3.06,提取溫度90 ℃,羅望子多糖提取率的理論值為49.76%,蛋白質質量分數理論值為1.00%。以此條件進行驗證實驗,實際值為原料目數120 目,提取pH 3.1,提取溫度90 ℃,羅望子多糖提取率的實際值為49.59%±0.36%,蛋白質質量分數實際值為1.02%±0.05%,表明實驗實際值與模型預測值相符度高,該模型具有實際意義。與國內現有的研究[3,11-13]相比,該模型以多糖提取率代替多糖得率,更為準確地反映了產物中的多糖含量;且首次結合了多糖提取率和蛋白質質量分數兩項指標,對提取工藝進行優化,使其操作簡便、成本低廉,為羅望子膠的大規模生產提供一定的參考和理論依據。
3 結 論
本實驗通過對羅望子多糖提取工藝的研究,初步確定了影響羅望子多糖提取率的主要因素,在單因素實驗的基礎上,本實驗采用了響應面分析法,以高多糖提取率和低蛋白質質量分數為指標,對羅望子多糖的提取工藝進行了優化,從而得到的最佳工藝條件為:原料目數120 目,提取pH 3.1,提取溫度90 ℃,羅望子多糖提取率為49.59%±0.36%,蛋白質質量分數為1.02%±0.05%,實驗實際值與模型預測值相符度高,該模型具有實際意義。本實驗所采用的提取工藝簡單,成本低廉,為羅望子膠的大規模生產提供一定的理論依據。

