淮山藥等4種藥食同源中藥對免疫抑制小鼠免疫功能影響的對比研究
高長曌,李方琪,嚴 婧,高一禎,夏晶瑩,郭冉冉,張 玉,楊丹聃
(1.吉林大學中日聯誼醫院,吉林 長春130033;2.吉林大學臨床醫學院;3.吉林大學基礎醫學院)
免疫調節在人體及動物中發揮著重要的作用,一旦調控失衡,可能會造成如系統性紅斑狼瘡、類風濕性關節炎、硬皮病等多種自身免疫病。同時,利用正確調控的免疫調節機制,可以調節免疫缺陷疾病、感染性疾病、慢性病及腫瘤和癌癥等的治療。現有臨床較多采用西藥治療的方法,但其具有作用單一、毒副作用明顯、沒有特異性療效等缺點。中藥因其含有多種免疫活性成分、多靶點、毒副作用小等優點,越來越得到臨床等廣泛認可。最近,也有不少研究機構在食物免疫調節疾病治療方面也取得突破性研究進展,哈佛醫學院的科學家發現像西蘭花這種我們常見的食物中含有的天然分子3-吲哚甲醇(I3C)可以通過調節抑制腫瘤生長[1]。國內也有許多食物有效成分的研究。香菇多糖能夠減輕化療所誘發脂代謝紊亂[2]。枸杞多糖(LBP)存在于枸杞子鐘,為其活性成分,有增強機體的免疫功能和顯著的抗腫瘤效應,其能帶動機體主動免疫能力,殺傷腫瘤細胞等等[3]。本實驗選取淮山藥、薏米、蒲公英、酸棗仁4種日常生活常見的食物,同時是藥食同源的大宗藥材,其主要成分在各種文獻報道中發現有不同程度提高機體免疫水平的作用[4-7]。構建環磷酰胺免疫抑制模型探討4種中藥對免疫抑制小鼠機體的特異性及非特異性免疫功能的具體調控作用,為其日后在臨床免疫疾病、腫瘤等的治療中應用奠定基礎。
1 材料與方法
1.1 實驗動物
選擇SPF級6-8周ICR小鼠,體重18-22 g,90只均為雄性,購自長春市億斯實驗動物技術有限公司,實驗動物生產許可證號:SCXK(吉)2018-0007。
1.2 實驗藥品與試劑
蒲公英、淮山藥、酸棗仁、薏米4種藥材,每種300 g均購自長春市吉深藥店,且已粉碎加工,過12目篩。注射用環磷酰胺(CTX),批號:18022625,規格每只0.2 g,江蘇盛迪醫藥有限公司生產。1640培養基,GIBCO生產。新生牛血清,浙江天杭生物科技有限公司生產。鼠IgG ELISA 試劑盒、鼠IL-12 ELISA 試劑盒和鼠INF-γ試劑盒,上海酶聯生物科技有限公司生產。
1.3 方法
1.3.1試劑配制 采用傳統水煎法供試藥液配制。按要求稱取藥材,用藥材6.5倍量水浸泡,武火煮至沸騰后用文火繼續煮至1.0 h,倒出藥液并過濾,向藥渣中加2倍蒸餾水進行二煎,武火煮至沸騰后用文火繼續煮至1.0 h,倒出藥液并過濾,向二煎藥渣中再加2倍蒸餾水進行三煎,武火煮至沸騰后用文火繼續煮至1.0 h,倒出藥液并過濾,合并三次所得的濾液,99-100℃濃縮至1.0 g/ml,即得所需藥液,50 ml離心管,標記,4℃冰箱貯存。
1.3.2實驗設計 小鼠根據體重隨機分成6組(每組15只),稱量記錄每組小鼠的初始體重。分別設計為空白組、模型組、蒲公英組(5.0 g/kg)、酸棗仁組(5.0 g/kg)、淮山藥組(5.0 g/kg)、薏米組(5.0 g/kg)。除空白組和模型組灌喂0.9%生理鹽水外,其余各組每天灌喂一次相應受試藥物,連續14天。給藥第4天起,除空白組,其余隔3天注射一次環磷酰胺建立免疫抑制模型。
1.3.3增重率與免疫器官臟器指數 實驗結束后,對小鼠稱重,計算增重率=(最終體重-初始體重)/初始體重×100%。末次給藥后,小鼠摘眼球處死。取脾臟和胸腺稱重,并觀察,計算相應臟器指數(mg/g)=臟器重量(mg)/體重(g)。
1.3.4血清溶血素的測定 給藥第11天,小鼠腹腔注射0.2 ml 5%雞紅細胞懸液(CRBC),末次給藥24 h后,摘眼球取血到EP管中,待血清析出,取上層血清到新的離心管,3 500 r/min分離血清,4℃備用。血清用生理鹽水稀釋100倍,取稀釋血清0.1 ml于試管中,與10%CRBC懸液0.05 ml混合置冰浴,再加10%補體0.1 ml混合,同時設置不加血清的對照組。37℃恒溫水浴30 min后,立即冰浴終止反應。2 000 r/min 離心10 min,取上清0.1 ml,加都氏試劑0.3 ml,混勻,放置10 min后,取上清轉移至96孔板,同時設置半數溶血組,用酶標儀于λ=540 nm,測定吸光度值(OD),以對照組做空白調零,同時設空白對照,血清對照,補體對照,雞血對照,實驗均設副孔。溶血素的量以半數溶血值(HC50)表示,
HC50=(樣品光密度值/CRBC半數溶血時光密度值)×稀釋倍數。
1.3.5免疫球蛋白、血清IL-12、 IFN-γ含量測定 末次給藥12 h后,眼眶取血,離心,收集血清,按照ELISA試劑盒提供的方法檢測血清中IgG、IL-12、IFN-γ含量。室溫平衡20 min后,向酶標板中分別加入不同濃度的標準品和稀釋后的待測血清樣品50 μl,同時設置空白孔,實驗均設副孔。蓋封板膜,37℃培養箱中孵育30 min。棄液,甩干,洗滌液洗滌5次,拍干。每孔加入酶標抗體100 μl,37℃孵育60 min,棄液,甩干,洗滌液反復洗5次,拍干。依次每孔加入底物A、B各50 μl,37℃避光孵育15 min。每孔加入終止液50 μl,15 min內,在450 nm波長處測定各孔的OD值。根據標準品濃度和OD值,運用Origin軟件獲得標準曲線的回歸方程,計算出待測樣品IgG、IL-2、IFN-γ含量水平。
1.3.6脾淋巴細胞增殖反應 取小鼠脾臟研磨,用含5%小牛血清(FCS)的培養液制備懸液,計數,調細胞濃度至1×107/ml,每孔體積100 μl接種到96孔板,每實驗組均設3副孔,對照組每孔補加100 μl的5%FCS培養液,刺激組每孔加100 μl的10 μg/ml的ConA。37℃ 5%CO2培養箱中,培養48 h。每孔加MTT溶液(5 mg/ml)10 μl,繼續孵育2 h,小心吸棄孔內培養上清液。每孔加100 μl 二甲亞砜(DMSO),震蕩,使結晶物充分融解。在570 nm波長,酶標儀上測定各孔光吸收值(空白孔調零)。結果判定:SI (刺激指數) =Con A刺激孔A值/對照孔A值。
1.3.7吞噬 飼養結束前兩天,小鼠腹腔注射5%淀粉溶液1 ml,最后一次給藥后,腹腔注射3%雞紅細胞懸液0.5 ml,60 min后處死小鼠,腹腔打入2 ml生理鹽水,吸出腹腔液腹腔液在載玻片上涂片,Giemsa-wright染色液染色,40倍鏡顯微鏡下查找100個巨噬細胞觀察計數。結果判定:吞噬百分率:有吞噬作用的巨噬細胞數/ 100×100%;吞噬指數:有吞噬作用的巨噬細胞吞入的雞紅細胞總數/100。
1.4 統計學分析
數據結果用平均值±標準差方式表示,采用SPSS 25.0軟件進行多組均數間的單因素方差(ANOVA)分析,兩組均數間的相互比較采用LSD或 Dunnett法進行差異顯著性檢驗,結果P<0.05為差異顯著性的判斷標準。
2 結果
2.1 藥物對免疫抑制小鼠體重的影響
連續給藥14天后,稱量小鼠的最終體重,并分別計算增重率,結果表明,初始體重和最終體重各組間差別不大(P>0.05),但增重率結果表明,實驗導致各組增重情況有所變化,其中空白組平均增重率最高,使用藥物后,小鼠體重增長程度較空白組均有不同程度的下降。與模型組相比,使用藥物各組體重增長率升高并不明顯,其中薏米組甚至稍有下降,但與模型組相比P>0.05,不具有統計學意義。但薏米組增重率與正常組差別明顯(P<0.05)。見表1。
2.2 藥物對小鼠臟器指數的影響(mg/g)
14天后處死小鼠,取其脾臟、胸腺稱重并計算小鼠臟器指數,即器官重比體重。見表2,空白組、模型組、蒲公英組、酸棗仁組、淮山藥組、薏米組的脾臟指數分別為5.23±1.04,3.53±0.75, 4.30±0.31,4.82±1.19,5.04±0.61,4.59±0.73;胸腺指數分別為5.24±0.74,1.30±0.40, 1.98±0.31,2.48±0.73,2.15±0.44,2.21±0.69。與正常空白組比較,模型組小鼠的脾臟和胸腺指數顯著降低(P<0.05),差異有統計學意義,說明造模成功。各組的脾臟和胸腺指數均有所上升。與模型組比較,只有淮山藥組差異顯著(P<0.05),明顯恢復,接近正常水平,但所有實驗組小鼠與正常組比較,差異并不明顯(P>0.05)。酸棗仁、淮山藥、薏米組相比模型組胸腺指數有明顯恢復(P<0.05),盡管酸棗仁組指數最高,但與正常組相比,差異顯著(P<0.05),仍未恢復到正常水平。說明給藥后,4組藥物對脾臟和胸腺均有不同程度的積極作用,但胸腺指數仍未恢復到正常水平。
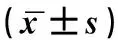
表1 4種中藥對小鼠體重的影響
注:a表示與空白組比較,P<0.05;b表示與模型組比較,P<0.05;c表示與蒲公英組比較,P<0.05;d表示與酸棗仁組比較,P<0.05;e表示與淮山藥組比較,P<0.05。下表同。
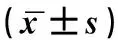
表2 4種中藥對小鼠主要器官重量的影響
2.3 藥物對小鼠體液免疫的影響
2.3.1血清溶血素檢測 給藥第11天,腹腔注射5% CRBC,末次給藥24 h后,摘眼球取血,檢測計算,數據見表3。空白組、模型組、蒲公英組、酸棗仁組、淮山藥組、薏米組的半數溶血值分別為72.96±5.90、49.72±0.76、53.64±7.67、56.01±5.85、59.99±9.04、59.78±9.78、63.16±6.37。與模型組相比,各組的半數溶血值均有提高,高于模型組,但差異不顯著(P>0.05),其中薏米組對于提高半數溶血值效果最好,接近空白組,與正常小鼠差異不顯著(P>0.05),接近正常水平。
2.3.2血清免疫球蛋白和細胞因子檢測 末次給藥12 h后,取血,ELISA試劑盒檢測血清中IgG、IL-12、IFN-γ含量,數據見表4。空白組、模型組、蒲公英組、酸棗仁組、淮山藥組、薏米組的測得IgG含量分別為29.51±6.22、16.82±5.53、44.29±8.20、35.98±13.22、34.42±6.81。4個中藥實驗組的IgG水平顯著高于空白對照組(P<0.05),表明幾種中藥均能提高免疫抑制小鼠免疫功能。其中蒲公英組與薏米組相比空白組增多最明顯(P<0.05),表明其改善體液免疫作用顯著。
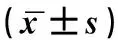
表3 4種中藥對小鼠血清溶血素的影響
IL-12的檢測結果為91.75±7.93、77.85±2.22、98.32±22.86、82.26±6.25、91.94±6.35、98.49±5.17。IFN-γ的檢測結果為712.13±76.60、545.79±33.21、654.60±32.07、556.41±81.51、658.44±78.40、674.65±96.55。各組IL-12和IFN-γ的含量水平檢測具有相近趨勢。模型組和空白組相比,IL-12和IFN-γ的結果都有顯著差異(P<0.05),與模型組相比,蒲公英、淮山藥、薏米組的IL-12和IFN-γ均有顯著增多(P<0.05),其中薏米組在IL-12和IFN-γ的血清含量檢測中皆為最佳。可見4種中藥在促進小鼠體液免疫抗體分泌反面,有各自不同作用。
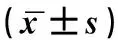
表4 4種中藥對小鼠血清IgG、IL-12、IFN-γ含量的影響
2.4 藥物對小鼠細胞免疫的影響
脾淋巴細胞增殖轉化實驗結果見表5,空白組、模型組、蒲公英組、酸棗仁組、淮山藥組、薏米組的增值刺激指數分別為1.83±0.75、1.00±0.12、1.48±0.44、1.09±0.09、1.34±0.37、1.11±0.10。除酸棗仁組,其余各組的增值刺激指數均升高,其中蒲公英組最高,為1.48±0.44,其次為淮山藥組,為1.34±0.37,表明蒲公英組和淮山藥組小鼠細胞免疫水平得到明顯提高,較接近正常空白組(P>0.05)。
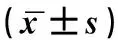
表5 4種中藥對小鼠淋巴細胞增殖的影響
2.5 藥物對小鼠吞噬細胞功能的影響
最后1次給藥后,腹腔注射雞紅細胞懸液,腹腔液涂片計算吞噬率和吞噬指數見表6。空白組、模型組、蒲公英組、酸棗仁組、淮山藥組、薏米組的吞噬率分別為39.33±1.15、11.50±0.71、23.35±0.71、33.46±2.12、39.61±4.94、32.51±3.36;吞噬指數分別為0.42±0.19、0.14±0.06、0.38±0.04、0.32±0.10、0.43±0.12、0.37±0.12。與模型組相比,各組的吞噬率顯著提高(P<0.05),吞噬指數也均不同程度升高,其中淮山藥組的吞噬率和吞噬指數升高最多,與模型組有顯著差異(P<0.05),且都超過了正常水平,表明淮山藥組在提高吞噬細胞功能上效果顯著。
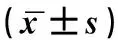
表6 4種中藥對小鼠吞噬功能的影響
3 討論
本實驗以環磷酰胺構建小鼠免疫抑制模型,探究小鼠灌胃蒲公英、酸棗仁、淮山藥、薏米4種藥食同源中藥的免疫調節作用。注射環磷酰胺后,小鼠的臟器比重、體液免疫、細胞免疫及吞噬作用等各項檢測結果均顯著低于正常小鼠(P<0.05),使小鼠處于免疫抑制狀態。
使用藥物后,小鼠體重增長程度較空白組均有不同程度的下降。與模型組相比,使用藥物各組體重增長率升高并不明顯,其中薏米組甚至稍有下降,利用統計學方法分析P值<0.05,不具有統計學意義。
包括脾臟、胸腺等在內的免疫器官是多種免疫細胞增殖、分化和成熟的場所,免疫器官指數可作為判斷免疫器官發育和機體免疫狀態的初步指標[8]。脾臟作為人體外周最大器官,是淋巴細胞接受抗原刺激并產生免疫反應的重要場所[9]。本實驗結果顯示,藥物對脾臟指數均有所恢復,淮山藥組的脾臟指數有明顯恢復(P<0.05),表明淮山藥組對于脾臟淋巴細胞增殖活化最為明顯。胸腺是T細胞成熟、分化的場所,主要介導細胞免疫[10],數據顯示,酸棗仁、淮山藥、薏米組相比模型組胸腺指數有顯著恢復(P<0.05)但與正常組相比,仍未恢復到正常水平。與模型組相比,表明中藥對促進免疫抑制小鼠免疫器官的發育具有較好的效果。
檢測機體紅細胞溶血過程中血紅蛋白的量可以反映抗體產生水平,進而代表機體的體液免疫水平[11]。與模型組相比,四組血清溶血素水平均有不同程度的升高,其中薏米組的血清溶血素水平升高最多,接近正常,與空白小鼠無顯著差異(P>0.05),表明薏米組可以提高小鼠外周血的抗體生成率,增強體液免疫。但幾種藥未達到相對模型組十分顯著的提高效果(P>0.05)。IgG是血液里含量最高的免疫球蛋白,在抗體介導的防衛機制中發揮重要作用,對體液免疫至關重要[12]。各組相對模型組均顯著提高。IL-12具有刺激活化型T細胞增殖和誘發Th0細胞向Th1輔助細胞分化,標志性的分泌IFN-γ、TNF-α等,并能誘導CTL和NK細胞毒性,有抗腫瘤的積極作用。IFN-γ能增強Th1細胞的活性,對巨噬細胞、淋巴細胞、NK細胞等有重要的免疫調節作用。薏米組的IL-12和IFN-γ兩項檢測結果均顯示比模型組顯著的提高,推測其可能促進Th1細胞的活性,增強細胞免疫功能。
有絲分裂原刀豆蛋白A(ConA)可誘導脾T淋巴細胞增殖,用以測定淋巴細胞的免疫應答功能。淋巴轉移實驗結果除酸棗仁組外,其他三組均對增殖有所提高,但不顯著,其中蒲公英組和淮山藥組結果顯示能刺激產生更多的淋巴細胞,表示其增強機體細胞免疫功能較好,有趨近正常趨勢。
吞噬作用可評估動物的非特異性免疫狀態。巨噬細胞吞噬作用是最重要的,可防御所有類型的入侵細胞,還可通過分泌細胞因子和處理呈遞抗原,間接發揮作用從而調節免疫系統。與模型組相比,四種中藥組小鼠吞噬率、吞噬指數均明顯上升,其中淮山藥組吞噬率、吞噬指數上升最明顯均超過空白組。結果表明這四種中藥均能增強腹腔巨噬細胞的吞噬作用,并且淮山藥的增強作用最明顯。
本實驗采取的4種中藥:蒲公英、酸棗仁、淮山藥、薏米均為藥食同源物品,在生活中食用較為廣泛。以灌胃的方式作用在環磷酰胺抑制的小鼠模型中,發現其對免疫器官指數、特異性的體液免疫和細胞免疫,非特異性的吞噬功能均有不同程度的提高。淮山藥在脾臟指數、細胞免疫、吞噬等調節作用中均為相對最佳,而薏米在體液免疫的促進溶血素和多種免疫細胞因子分泌的中也有相對最好效果,蒲公英、酸棗仁均有各自不同免疫調節作用。綜合各項指標,淮山藥的免疫調節相對更全面和顯著。實驗對在免疫調節的臨床應用上,可根據不同需求選用中藥調節免疫低下疾病,或者在腫瘤放療、化療患者作為輔助治療藥物或輔食增強免疫力有參考價值。

