工程水質簡分析中應注意的問題及數據的合理性檢驗
毛雪梅
(甘肅省地質礦產勘查開發局第四地質礦產勘查院,甘肅 酒泉 735000)
建設生態文明的現代化強國是國家戰略之一,相關部門在進行決策和監管時,水質檢測作為基礎依據,精準以及合理的水質檢測結果尤為重要。然而,在水質檢測過程中,檢測環節多、水質成分復雜等都可能會影響到檢測數據的準確性、科學性,為了保證數據的科學性,需要進行合理性、科學性分析。我國自然界中蘊含著豐富的水資源,這些水資源的水質成分原本就比較復雜,伴隨著工農業發展,加劇水質成分的復雜化。但總的來說,水質成分中存在耦合關系,其表現為相對固定性,對于部分元素而言,其耦合性表現親密,則規律性有穩定的特征。水質檢測是否科學,除了借助內在規律判斷,耦合關系也是一個重要指標,通過兩者,可以合理性分析實驗室檢測水質檢測所得的數據[1]。
1 水質簡分析中應注意的問題及解決方法
1.1 莫爾法測定水中的Cl-
在實際試驗操作中,莫爾法選取的指示劑一般為K2CrO4,對Cl-的滴定則選取AgNO3溶液,一般需要在弱堿性或者中性環境中進行。在進行滴定時,判定滴定是否達到終點的標準是從黃色的溶液顏色變成微磚紅色。采用莫爾法來測定水中的Cl-時,有以下幾點需要操作人員注意:
(1)莫爾法對溶液的PH值有很高的要求,原因如下:①在滴定過程中,當溶液PH值大于10.5時,溶液中會產生黑色的沉淀,其成分為氧化銀。為了不影響檢測結果,需中和溶液,選用醋酸,濃度為1%作為中和試劑即可。②在滴定過程中,當溶液PH值小于6.5時,由于溶液過強的酸性,會拖后終點。為了不影響檢測結果,需中和溶液,選用碳酸鈉,濃度為0.5%作為中和試劑即可。
(2)在滴定作業過程中,會出現難以判斷滴定終點的情況。作為指示劑,鉻酸鉀使用量過少,紅色會過早出現;使用量過多,紅色會較晚出現,這些都影響著終點顏色的出現和觀察。通過大量的實驗數據,發現將鉻酸鉀加入試劑時,應當保持0.1g/100ml的比例,這樣做出來的鉻酸鉀指示劑效果最好。同時,為了防止出現終點提前,在滴定過程中,應當搖晃滴定瓶以避免出現氯化銀,氯化銀會吸附溶液中Cl-,影響效果。滴定瓶的搖晃,應當在不濺出溶液以及保證滴定瓶完好無損的情況下,劇烈晃動。
(3)在進行滴定時,水樣中過高含量的Cl-對滴點終點的觀察不利,主要是因為氯化銀這種白色沉淀物的產生。所以,進行測定前,要適當稀釋溶液中的Cl-。
1.2 EDTA滴定水中的Ca2+、Mg2+
試驗原理:
在實驗過程中,所生成配合物的穩定性CaIn-最小、依次為MgIn-、MgY2-,CaY2-最大。在進行滴定前,溶液的PH要先調到10,然后加入少許鉻黑T指示劑,在與Mg2+發生反應后生成MgIn-,顏色呈現酒紅色。進行滴定時,溶液中游離的鎂離子、鈣離子與ED-TA發生化學反應結合成MgY2-、CaY2-,其化學反應式為:

該方法在具體操作中,所選用的指示劑會因PH值的不同而有不同的選擇,指示劑選用鉻黑T適用于在PH=10;指示劑選用紫脲酸銨適用于PH值在12~13范圍內。在實際操作中,常見的問題以及解決辦法如下:
(1)在測定水硬度時,滴點應當在加入指示劑和緩沖溶液后立即進行,并且要在5分鐘內完成滴點,以免影響測定質量。滴點過程中,溶液的濃度會發生改變,顏色表現為:酒紅、淺紅、紫、藍。在操作過程中,溶液顏色會發生變化,在顏色由淺紅色向紫色轉變時,說明反應已經差不多完成,所以,要放慢滴定的速度。將1滴EDTA分別滴入每份溶液后,試驗人員要劇烈晃動滴定瓶。判斷滴定是否為到達終點的標準就是滴定瓶溶液顏色呈現藍色[2]。
(2)Fe3+、AI3+等金屬離子會對指示劑造成干擾,進而影響滴定結果。因此,滴定時,在將緩沖溶液加入溶液前,為了消除金屬離子的不利影響,應當將在溶液中加入三乙醇胺,以便能消除溶液中的各種金屬離子[3]。
1.3 測定水溶液中的電導率
對物理物理導電能力表征,并對其定量,可用電導率這一物理量表示。本文所指的電導率是水體導電能力的表征。無雜質的水,導電能力微弱;但大自然中的水體一般都含有無機物、有機物,所以其具有一定的導電性。在水質檢測中,礦化度采用重量法測定,主要對無機礦物質在水體中的含量進行定量表征。采用重量法測定礦化度,有可能出現誤差,其來源主要是以下3方面:
(1)在對水體樣本做烘干和蒸發操作時,樣本重量會出現減
(2)在烘干水體樣本時,NO3-和Cl-會出現部分丟失的情況,如出現MgCl2轉化為MgO·MgCl2等情況,就會誘發負誤差。
(3)對鹽類物質進行烘干操作時,一般選取溫度為103℃~105℃。即便進行了烘干操作,因鹽類的吸水性,會使得依然含有少量結晶水,這會導致在做質量測定時,出現正誤差。水體中離子的種類和含量對水體的礦化度和導電性有影響,有些影響是關鍵性的。固定的礦化度和導電性取決于水體離子的分布是否相對固定。
2 數據的合理性檢測
2.1 電導率與可溶離子總量之間的關系
作為水溶液電阻倒數,電導率是對溶液傳導電流能力的表示,在對水樣檢測時,可通過間接的方式推算出可溶離子的總量。水質比較好的情況下,水中含有少量的可溶性離子,這樣電陰大,而電導率小;相反,在水質較差的情況下,水中含有大量的可溶性離子,電陰小,而電導率大。因此,通常判斷水質情況可依據可溶離子總量和電導率之間的關系。
2.2 溶液pH值與堿度、游離CO2間的關系
作為審查其他實驗結果的依據之一,PH值還同很多實驗的分析方法和結果有著緊密的關系。判斷水中是否存在或可能存在的游離CO2和堿度,可通過PH值判定,主要是依據OH-、、、CO2相間隔時不能共存,在相鄰時可共存的原理。在pH<4時不存在 ;、OH-在pH<8.4時不存在;游離CO2在pH>8.4時不存在;、CO2在PH>12時不存在。
對于干凈的天然水而言,PH值在水中含有HCO3-和游離狀態的CO2,可用PH=6.37+lg[HCO3-]-lg[CO2]表示;PH值在水中含有HCO3-和時,可 用PH=10.25+lg[CO32-]-lg[HCO3-]表示;PH的實測值和計算所得數值,誤差一般不大于0.3。

表1 水樣①、②堿度、PH值和游離CO2的關系
由表1可知,PH實測值和計算值在兩個水樣中相差都不大于0.3,這充分表明了對水樣分析所得結果是合理的。在實際操作中,當PH實測值和計算值相減大于0.3時,需要做定性判斷。出現這種情況主要是因為各項離子和PH值的測定會有一定誤差,特別是在礦化度大、含有較多有機物質的水的情況下。
2.3 總硬度與總堿度之間的關系
總硬度由兩部分組成,分別是非碳酸鹽硬度和碳酸鹽硬度,是對水體中含有碳酸氫根、氯離子以及氫氧根離子總量的反映。當水中碳酸鹽和重碳酸鹽含量小于Ca2+和Mg2+時,多出來的Ca2+和同水中硝酸鹽、硫酸鹽以及氯化物發生反應而形成的硬度,即非碳酸鹽硬度又稱為永久性硬度;水中的碳酸鹽和重碳酸鹽同Mg2+和Ca2+發生反應而形成的硬度,即碳酸鹽硬度又稱為暫時硬度。
永久硬度在總硬度<總堿度時,不存在;永久硬度在總堿度<總硬度時,存在;永久硬度=總硬度一暫時硬度。
例如某水樣測試結果如表2所示。
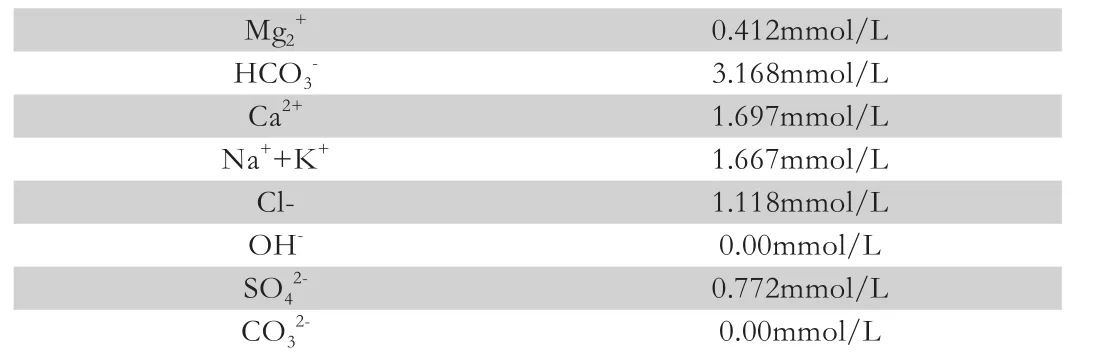
表2 某水樣部分離子測試結果
經過驗證總堿度和總硬度兩者的關系,充分證明了試驗結果的科學性和合理性。在驗證后,出現矛盾的離子關系時,則要查出原因,并進行糾正。
2.4 水中陰、陽離子摩爾濃度的關系
水中的陰陽離子存在著相互制約、相互聯系的關系,只有在陰離子的摩爾濃度和陽離子大致相同的情況下,才能保持水溶液中的陽離子和陰離子的電荷相平衡。基于電荷平衡關系,在對以Ca2+、Mg2+為主的陽離子進行簡易的水質分析時,選用“差減法”來計算Na++K+的濃度。當有未測定的其他金屬離子或者檢測數據有錯誤時,則會出現Na++K+的濃度為負數,這種情況下,需要采用其他辦法對Na+、K+的含量進行測定或重新檢查陰陽離子的測定是否準確[4]。
3 總結
本文針對在水質單項檢測時需要注意的問題以及解決的辦法。為了能更好更真實的反映水體的基本情況,應當避免出現文中所列舉的注意事項。在日常的水質檢測工作中,應當多實踐、多分析,多積累,遇到問題及時查找原因,合理解決,以保證結果的合理性、準確性和科學性。對分析結果用化學平衡原理進行校正和審查,進而提高分析質量。水質成分具有復雜性,在測定時,既要綜合考慮,也要綜合歷史資料,相互驗證和核對,以便進行全面分析得出科學合理的結論。

