兒茶素對肌原纖維蛋白氧化、結構及凝膠特性的影響
賈娜 金伯陽 劉丹 孫嘉 劉登勇


摘 要:采用羥自由基氧化體系(10 μmol/L FeCl3、100 μmol/L VC和1 mmol/L H2O2)研究不同添加量兒茶素(10、50、100、150 μmol/g)對肌原纖維蛋白氧化、結構及凝膠特性的影響,同時以未氧化和氧化后未添加兒茶素(0 μmol/g)肌原纖維蛋白作為對照組,對肌原纖維蛋白羰基含量、總巰基含量、表面疏水性、溶解度、粒徑分布、凝膠強度、凝膠保水性及肌原纖維蛋白流變特性進行測定,并觀察凝膠微觀結構。結果表明:添加兒茶素能減少羰基化合物的產生,但添加量過高會促進肌原纖維蛋白氧化;與未氧化和未添加兒茶素組相比,添加兒茶素降低了肌原纖維蛋白表面疏水性;隨著兒茶素添加量增加,肌原纖維蛋白巰基含量逐漸降低,溶解度顯著降低,粒徑逐漸增大,凝膠強度和保水性逐漸下降,凝膠微觀結構更加疏松多孔,蛋白膠束聚集,中、高添加量(50、100、150 μmol/g)兒茶素使得肌原纖維蛋白失去典型的流變曲線。中、高添加量兒茶素與肌原纖維蛋白發生共價交聯,并導致肌原纖維蛋白發生疏水性聚集,最終削弱了肌原纖維蛋白的凝膠特性。
關鍵詞:兒茶素;肌原纖維蛋白;氧化;結構;凝膠特性
Effect of Catechin on the Oxidation, Structure and Gel Properties of Myofibrillar Protein
JIA Na, JIN Boyang, LIU Dan, SUN Jia, LIU Dengyong*
(National and Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for
Fresh Agricultural and Aquatic Products, Food Safety Key Laboratory of Liaoning Province, College of Food and Technology,
Bohai University, Jinzhou 121013, China)
Abstract: The effects of different concentrations of catechin (10, 50, 100 and 150 μmol/g proteins) on the oxidation, structure and gel properties of myofibrillar proteins were studied. Oxidation was carried out in a hydroxyl radical oxidation system (10 μmol/L FeCl3, 100 μmol/L VC and 1 mmol/L H2O2). Non-oxidized and oxidized myofibrillar proteins without added catechin were used as control groups. The carbonyl content, total sulfhydryl content, surface hydrophobicity, solubility, particle size distribution, gel strength, water holding capacity and rheological properties of all samples were determined, and the microstructure of heat-induced protein gel was observed. The results showed that catechin could reduce the production of carbonyl compounds, but at high concentration promote the oxidation of myofibrillar proteins. Compared with the control groups, catechin decreased the surface hydrophobicity. With increased concentration of catechin, the sulfhydryl content decreased gradually, the solubility declined significantly, the particle size increased and the gel strength and water-holding capacity fell gradually. The gel microstructure became more loose and porous and the protein micelles were aggregated. Medium and high concentrations of catechin (50, 100 and 150 μmol/g) caused the protein to lose its typical rheological behavior. In conclusion, high and medium concentrations of catechin could covalently cross-link with myofibrillar proteins and cause the hydrophobic aggregation, ultimately weakening the gel properties of myofibrillar proteins.
Keywords: catechin; myofibrillar protein; oxidation; structure; gel properties
DOI:10.7506/rlyj1001-8123-20200220-043
中圖分類號:TS251.5 ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼:A 文章編號:1001-8123(2020)04-0013-07
引文格式:
賈娜, 金伯陽, 劉丹, 等. 兒茶素對肌原纖維蛋白氧化、結構及凝膠特性的影響[J]. 肉類研究, 2020, 34(4): 13-19. DOI:10.7506/rlyj1001-8123-20200220-043. ? ?http://www.rlyj.net.cn
JIA Na, JIN Boyang, LIU Dan, et al. Effect of catechin on the oxidation, structure and gel properties of myofibrillar protein[J]. Meat Research, 2020, 34(4): 13-19. DOI:10.7506/rlyj1001-8123-20200220-043. ? ?http://www.rlyj.net.cn
蛋白質發生氧化不僅會破壞蛋白質的結構,還會導致蛋白質的功能性質發生改變,從而導致產品質地、色澤等發生改變[1]。利用植物多酚能有效抑制肉及肉制品的脂肪和蛋白質氧化。研究表明,在豬肉糜中加入迷迭香精油能有效減少巰基的損失,抑制蛋白質氧化[2]。Ganh?o等[3]發現,大部分水果提取物能抑制羰基化合物的生成,降低豬肉糜蛋白氧化程度。Estévez等[4]對植物多酚抑制蛋白質氧化的效果進行研究,發現低添加量多酚能夠抑制蛋白質氧化過程中羰基的形成。
多酚能夠清除自由基,降低蛋白質氧化程度,但近年來很多研究發現,多酚類物質在起到抑制肉制品氧化作用的同時還能與蛋白質發生共價或非共價相互作用,從而對蛋白質結構產生影響,進而導致蛋白質功能特性發生改變,尤其是凝膠特性,其對蛋白質功能特性的影響與多酚添加量有關。沒食子酸能夠抑制肌原纖維蛋白乳液中脂肪和蛋白質的氧化,但卻能夠促進巰基和氨基的損失,破壞蛋白質三級結構,導致蛋白質發生聚集和交聯,高添加量沒食子酸(150 μmol/g)導致蛋白質凝膠結構破壞,凝膠強度和保水性顯著下降,但低、中添加量沒食子酸(6、30 μmol/g)對蛋白質凝膠強度和保水性影響不
大[5]。多酚與蛋白質之間的非共價鍵結合也可以導致蛋白質的溶解度降低[6]。綠原酸導致肌原纖維蛋白巰基和氨基損失程度增加,二級結構和三級結構發生改變,表面疏水性增加,溶解度降低,高添加量綠原酸(150 μmol/g)破壞蛋白質凝膠結構,蛋白質凝膠特性變差[7]。
兒茶素是從綠茶中提取的一種功能因子,作為茶多酚中主要的黃烷醇類成分具有很強的抗氧化能力。能夠形成熱誘導凝膠是肌原纖維蛋白的主要特性之一,因此,本研究以兒茶素作為抗氧化劑,采用Fenton反應體系制備肌原纖維蛋白氧化模型,對蛋白質氧化程度、結構、凝膠特性及流變特性等進行測定,研究兒茶素引起的蛋白質結構變化與凝膠特性變化之間的關系,為探究多酚對肌肉蛋白功能特性及凝膠類肉制品的影響提供理論依據。
1 材料與方法
1.1 材料與試劑
新鮮豬背最長肌 當地超市。
兒茶素 阿拉丁試劑有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazone,DNPH)、5,5-二硫代雙-(2-硝基苯甲酸)(5,5-dithiobis-(2-nitrobenzoic acid),DTNB) 北京索萊寶科技有限公司;氯化鈉、三氯化鐵、乙二胺四乙酸二鈉、過氧化氫、冰乙酸、溴酚藍、β-巰基乙醇、VC、磷酸氫二鈉、磷酸二氫鈉、三氯乙酸(均為分析純) 錦州藥業(集團)器化玻有限公司。
1.2 儀器與設備
BT-9300 ST激光粒度分布儀 丹東市百特儀器有限公司;Allegra 64R冷凍離心機 美國Beckman公司;T25數顯型均質機 德國IKA集團;UV-2550紫外-可見分光光度計 日本Shimadzu公司;TA-XT2i質構儀 英國Stable Micro Systems公司;S4800場發式掃描電子顯微鏡 日本日立公司;Discovery DHR-1流變儀 美國TA公司。
1.3 方法
1.3.1 肌原纖維蛋白提取及氧化體系的構建
豬肉肌原纖維蛋白的提取按照Park等[8]的方法進行。采用雙縮脲法,利用牛血清蛋白作為標準蛋白測定肌原纖維蛋白含量[11]。
參照Xiong等[9]的方法建立氧化體系。將提取所得肌原纖維蛋白溶于pH 6.0、10 mmol/L磷酸緩沖溶液(含0.6 mol/L NaCl),再向其中添加不同量兒茶素(0、10、50、100、150 μmol/g),然后加入10 μmol/L?FeCl3、100 μmol/L VC和1 mmol/L H2O2,制備羥自由基氧化體系,肌原纖維蛋白終質量濃度為40 mg/mL,4 ℃反應12 h。以未氧化肌原纖維蛋白(即不作任何處理的40 mg/mL肌原纖維蛋白)和在羥自由基氧化體系中氧化后未添加兒茶素的肌原纖維蛋白(質量濃度40 mg/mL)作為對照。
1.3.2 羰基含量測定
參照Oliver等[10]的方法。將1.3.1節制備的肌原纖維蛋白溶液用pH 6.0、10 mmol/L磷酸鹽緩沖液(含0.6 mol/L NaCl)稀釋到2 mg/mL,取1 mL與1 mL 10 mmol/L DNPH混合均勻,室溫反應1 h,加入1 mL 20 g/100 mL三氯乙酸,10 000 r/min離心5 min,取沉淀,用1 mL乙酸乙酯-乙醇(體積比1∶1)洗滌沉淀3 次,加入3 mL 6 mol/L鹽酸胍,37 ℃水浴保溫15 min,沉淀溶解后,10 000 r/min離心3 min,上清液于370 nm波長處測定吸光度。羰基含量表示為每毫克蛋白中羰基的物質的量(nmol/mg)。
1.3.3 巰基含量測定
參照Di Simplicio等[11]的方法。將1.3.1節制備的肌原纖維蛋白溶液用pH 6.0、10 mmol/L磷酸鹽緩沖液(含0.6 mol/L NaCl)稀釋到10 mg/mL,取1 mL加入8 mL Tris-甘氨酸,混勻,10 000 r/min離心15 min,取4.5 mL上清液與0.5 mL 10 mmol/L Ellmans試劑反應30 min,于412 nm波長處測定吸光度。巰基含量表示為每毫克蛋白中巰基的物質的量(nmol/mg)。
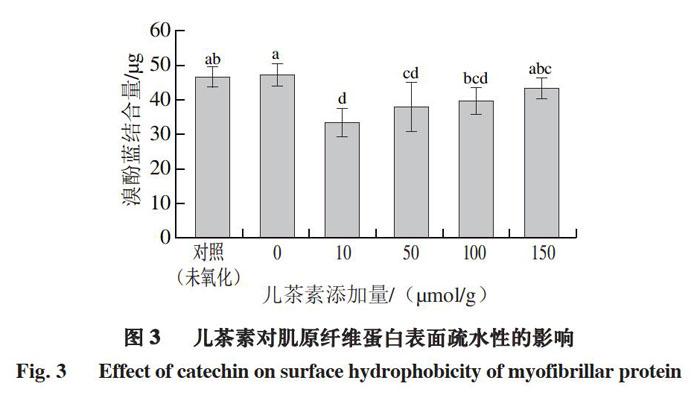
1.3.4 ?表面疏水性測定
參照Chelh等[12]的方法,將1.3.1節制備的肌原纖維蛋白溶液用pH 7.0、20 mmol/L磷酸緩沖溶液稀釋到5 mg/mL,取1 mL加入200 μL 1 mg/mL溴酚藍溶液,混勻,6 000 r/min離心15 min,將上清液稀釋10 倍,于595 nm波長處測定吸光度,對照組用1 mL磷酸鹽緩沖溶液替代肌原纖維蛋白溶液。表面疏水性以溴酚藍結合量表示,按式(1)計算。
(1)
1.3.5 溶解度測定
參照Joo等[13]的方法,并略作修改。將1.3.1節制備的肌原纖維蛋白溶液用pH 6.0、10 mmol/L磷酸鹽緩沖液(含0.6 mol/L NaCl)稀釋到10 mg/mL,取3 mL于離心管,4 ℃放置2 h,4 ℃、10 000 r/min離心20 min。取上清液1 mL,采用雙縮脲法測定蛋白質質量濃度。溶解度按式(2)計算。
(2)
式中:ρ1為上清液肌原纖維蛋白質量濃度/(mg/mL);
ρ2為離心前肌原纖維蛋白質量濃度/(mg/mL)。
1.3.6 粒徑測定
將1.3.1節制備的肌原纖維蛋白溶液用pH 6.0、10 mmol/L磷酸鹽緩沖液(含0.6 mol/L NaCl)稀釋到5 mg/mL,用激光粒度儀對肌原纖維蛋白粒徑進行測定。測定參數:物質折射率1.520,介質為水,介質折射率1.333。
1.3.7 肌原纖維蛋白熱誘導凝膠的制備
將1.3.1節制備的肌原纖維蛋白溶液分裝于密封玻璃瓶中(直徑25 mm,高度40 mm),在水浴鍋中加熱至72 ℃,保持20 min,形成凝膠后取出,冰浴冷卻1 h。將所有凝膠樣品貯藏在2~4 ℃冰箱中備用。每次分析前凝膠需在室溫(25~27 ℃)條件下放置30 min。
1.3.8 凝膠強度測定
使用質構分析儀進行測定,探頭型號選擇P/0.5。參數設置為:在測定模式選擇下壓距離為4 mm,測試前速率5 mm/s,測試速率2 mm/s,測試后速率2 mm/s,觸發力5 g。
1.3.9 凝膠保水性測定
稱取離心管質量,記為m0(g),取5 g凝膠放入離心管,再稱取此時離心管質量,記為m1(g);4 ℃、3 000 r/min離心10 min,將離心析出的水分析干,再次稱取離心管質量,記為m2(g)。凝膠保水性按式(3)計算。
(3)
1.3.10 微觀結構觀察
參照李明清[14]的方法,采用掃描電子顯微鏡進行觀察,加速電壓3.0 kV,放大倍數100 000 倍。
1.3.11 動態流變學測定
將1.3.1節制備的肌原纖維蛋白溶液均勻涂抹于流變儀測試平臺,排出氣泡。測試參數為:頻率0.1 Hz,應變2%,上下夾縫為1 mm,升溫程序:30~80 ℃,升溫速率1 ℃/min。
1.4 數據處理
每個實驗重復3 次,結果表示為平均值±標準差。采用SPSS 19.0軟件中的Linear Models程序進行數據統計分析,采用LSD程序進行差異顯著性分析(P<0.05)。使用Sigmaplot 12.5軟件作圖。
2 結果與分析
2.1 兒茶素對肌原纖維蛋白羰基含量的影響
小寫字母不同,表示差異顯著(P<0.05)。下同。
羰基含量是反映蛋白質氧化程度的重要指標之一[15],
羰基含量越高,蛋白質氧化越嚴重。由圖1可知,氧化后肌原纖維蛋白(兒茶素添加量0 μmol/g)的羰基含量顯著高于未氧化時(P<0.05),加入兒茶素后,羰基含量顯著降低
(P<0.05),說明兒茶素能抑制肌原纖維蛋白氧化進程,這主要是由于兒茶素中的酚羥基對自由基的清除作用。兒茶素添加量為10、50、100 μmol/g時,肌原纖維蛋白羰基含量逐漸降低,即兒茶素添加量升高,蛋白氧化抑制能力增強,但是,當兒茶素添加量為150 μmol/g時,肌原纖維蛋白羰基含量有所增加,可能是由于兒茶素添加量增加使其起到促氧化作用,有研究表明,酚類物質的抗氧化性與其濃度有關,濃度過高時反而會促進氧化[16]。
Estévez[17]研究發現,在沒食子酸、綠原酸、槲皮素、蘆丁和染木料素等多種多酚中,除蘆丁外,其他多酚對蛋白質羰基化合物的形成均具有抑制作用,這與本研究的結果相一致。
損耗模量(G)用來表示凝膠的黏性特征。由圖9B可知,與G的變化趨勢相似,兒茶素添加量10 μmol/g時,G的變化趨勢與未氧化組和兒茶素添加量0 μmol/g組相似,當兒茶素添加量達到50、100、150 μmol/g時,加熱至45 ℃不會出現峰值,G的變化曲線趨于平坦,說明凝膠網絡結構已不能形成。肌原纖維蛋白流變特性測定結果與凝膠強度和保水性測定結果相一致。
3 結 論
兒茶素能抑制肌原纖維蛋白氧化過程中羰基化合物的產生,但添加過多兒茶素會促進蛋白質氧化。隨著兒茶素添加量增加,肌原纖維蛋白巰基含量降低,表面疏水性低于未氧化組和兒茶素添加量0 μmol/g組,溶解度降低,粒徑增大,肌原纖維蛋白發生聚集,肌原纖維蛋白凝膠強度和保水性逐漸下降,凝膠微觀結構更加松散,蛋白膠束聚集,凝膠網絡結構變差;中、高添加量兒茶素(50、100、150 μmol/g)使肌原纖維蛋白失去典型的流變曲線。因此,中、高添加量兒茶素與肌原纖維蛋白的共價交聯或兒茶素導致的肌原纖維蛋白疏水性聚集會削弱肌原纖維蛋白的凝膠特性。
參考文獻:
[1] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science, 2006, 73(3): 536-543. DOI:10.1016/j.meatsci.2006.02.005.
[2] NIETO G, JONGBERG S, ANDERSEN M L, et al. Thiol oxidation and protein cross-link formation during chill storage of pork patties added essential oil of oregano, rosemary, or garlic[J]. Meat Science, 2013, 95: 177-184. DOI:10.1016/j.meatsci.2013.05.016.
[3] GANH?O R, MORCUENDE D, EST?VEZ M. Protein oxidation in emulsified cooked burger patties with added fruit extracts: influence on colour and texture deterioration during chill storage[J]. Meat Science, 2010, 85(3): 402-409. DOI:10.1016/j.meatsci.2010.02.008.
[4] EST?VEZ M, HEINONEN M. Effect of phenolic compounds on the formation of α-aminoadipic and γ-glutamic semialdehydes from myofibrillar proteins oxidized by copper, iron, and myoglobin[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 4448-4455. DOI:10.1021/jf903757h.
[5] CAO Yungang, TRUE A D, CHEN Jie, et al. Dual role (anti- and pro-oxidant) of gallic acid in mediating myofibrillar protein gelation and gel in vitro digestion[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 3054-3061. DOI:10.1021/acs.jafc.6b00314.
[6] SIEBERT K J. Effects of protein-polyphenol interactions on beverage haze, stabilization, and analysis[J]. Journal of Agricultural and Food Chemistry, 1999, 47(2): 353-362. DOI:10.1021/jf980703o.
[7] CAO Yungang, XIONG YoulingL.. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180: 235-243. DOI:10.1016/j.foodchem.2015.02.036.
[8] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3): 1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[9] XIONG Y L, PARK D, OOIZUMI T. Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J]. Journal of Agricultural and Food Chemistry, 2009, 57(1): 153-159. DOI:10.1021/jf8024453.
[10] OLIVER C N, AHN B W, MOERMAN E J, et al. Age-related changes in oxidized proteins[J]. Journal of Biological Chemistry, 1987, 262(12): 5488-5491.
[11] DI SIMPLICIO P, CHEESEMAN K H, SLATER T F. The reactivity of the SH group of bovine serum albumin with free radicals[J]. Free Radical Research Communications, 1991, 14(4): 253-262. DOI:10.3109/10715769109088954.
[12] CHELH I, GATELLIER P, SANT?-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[13] JOO S T, KAUFFMAN R G, KIM B C, et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and water-holding capacity in porcine longissimus muscle[J]. Meat Science, 1999, 52(3): 291-297. DOI:10.1016/S0309-1740(99)00005-4.
[14] 李明清. 鯉魚肌原纖維蛋白功能特性的研究[D]. 哈爾濱: 東北農業大學, 2010: 15-16. DOI:10.7666/d.y1787263.
[15] M?LLER I M, ROGOWSKA-WRZESINSKA A, RAO R S P. Protein carbonylation and metal-catalyzed protein oxidation in a cellular perspective[J]. Journal of Proteomics, 2011, 74(11): 2228-2242. DOI:10.1016/j.jprot.2011.05.004.
[16] UTRERA M, EST?VEZ M. Analysis of tryptophan oxidation by fluorescence spectroscopy: effect of metal-catalyzed oxidation and selected phenolic compounds[J]. Food Chemistry, 2012, 135(1): 88-93.
DOI:10.1016/j.foodchem.2012.04.101.
[17] EST?VEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89(3): 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[18] JONGBERG S, T?RNGREN M A, GUNVIG A, et al. Effect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J]. Meat Science, 2013, 93(3): 538-546. DOI:10.1016/j.meatsci.2012.11.005.
[19] JONGBERG S, GISLASON N E, LUND M N, et al. Thiol-quinone adduct formation in myofibrillar proteins detected by LC-MS[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 6900-6905. DOI:10.1021/jf200965s.
[20] CAVALLIERI A L F, DA CUNHA R L. The effects of acidification rate, pH and ageing time on the acidic cold set gelation of whey proteins[J]. Food Hydrocolloids, 2008, 22(3): 439-448. DOI:10.1016/j.foodhyd.2007.01.001.
[21] MOHAN M, RAMACHANDRAN D, SANKAR T V, et al. Physicochemical characterization of muscle proteins from different regions of mackerel (Rastrelliger kanagurta)[J]. Food Chemistry, 2008, 106(2): 451-457. DOI:10.1016/j.foodchem.2007.05.024.
[22] NEHA B, POONAM A, HARINDER S O. Influence of green tea polyphenols on the colloidal stability and gelation of WPC[J]. Food Hydrocolloids, 2011, 25(5): 1077-1084. DOI:10.1016/j.foodhyd.2010.10.004.
[23] LI Chunqiang, XIONG YoulingL., CHEN Jie. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry, 2012, 60(32): 8020-8027. DOI:10.1021/jf302150h.
[24] SHI Yan, LI Ruyi, TU Zongcai, et al. Effect of γ-irradiation on the physicochemical properties and structure of fish myofibrillar proteins[J]. Radiation Physics and Chemistry, 2015, 109: 70-72. DOI:10.1016/j.radphyschem.2014.12.016.
[25] JIANG Lianzhou, WANG Zhongjiang, LI Yang, et al. Relationship between surface hydrophobicity and structure of soy protein isolate subjected to different ionic strength[J]. International Journal of Food Properties, 2015, 18(5): 1059-1074. DOI:10.1080/10942912.2013.865057.
[26] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3): 137-150. DOI:10.1016/S0141-8130(02)00016-8.
[27] SUN Weizheng, CUI Chun, ZHAO Mouming, et al. Effect of composition and oxidation of proteins on their solubility, aggregation and proteolytic susceptibility during processing of Cantonese sausage[J]. Food Chemistry, 2011, 124: 336-341. DOI:10.1016/j.foodchem.2010.06.042.
[28] SCHMITT C, BOVAY C, ROUVET M, et al. Whey protein soluble aggregates from heating with NaCl: physicochemical, interfacial, and foaming properties[J]. Langmuir, 2007, 23(8): 4155-4166. DOI:10.1021/la0632575.
[29] TANG Changbo, ZHANG Wangang, ZOU Yufeng, et al. Influence of RosA-protein adducts formation on myofibrillar protein gelation properties under oxidative stress[J]. Food Hydrocolloids, 2017, 67: 197-205. DOI:10.1016/j.foodhyd.2017.01.006.
[30] YAN Mingyan, LI Bafang, ZHAO Xue, et al. Physicochemical properties of gelatin gels from walleye pollock (Theragra chalcogramma) skin cross-linked by gallic acid and rutin[J]. Food Hydrocolloids, 2011, 25(5): 907-914. DOI:10.1016/j.foodhyd.2010.08.019.
[31] XIONG Y L, BLANCHARD S P. Myofibrillar protein gelation: viscoelastic changes related to heating procedures[J]. Journal of Food Science, 1994, 59(4): 734-738. DOI:10.1111/j.1365-2621.1994.tb08115.x.
收稿日期:2020-02-20
基金項目:遼寧省重點研發計劃項目(2017205003);遼寧省高等學校產業技術研究院重大應用研究項目(041804)
第一作者簡介:賈娜(1982—)(ORCID: 0000-0003-1770-8200),女,副教授,博士,研究方向為肉品加工與質量安全控制。
E-mail: jianaxia_2010@163.com
通信作者簡介:劉登勇(1979—)(ORCID: 0000-0003-4588-9985),男,教授,博士,研究方向為肉品加工與質量安全控制。
E-mail: jz_dyliu@126.com

