蜂毒肽與二元脂膜相互作用過程的單分子運動行為*
徐成 林召 楊愷2)? 元冰2)?
1) (蘇州大學軟凝聚態物理及交叉研究中心,蘇州 215006)2) (蘇州大學物理科學與技術學院,蘇州 215006)(2020年2月1日收到; 2020年3月31日收到修改稿)
蜂毒肽等抗菌肽可通過破壞細菌的細胞膜而直接殺滅細菌, 因此它的殺菌功能具有高效、廣譜和不易產生耐藥性等特點, 并被認為有望能從根本上解決目前正嚴重威脅人類健康的抗生素耐藥性問題. 然而, 抗菌肽通過增強細胞膜的通透性來實現殺菌的分子機制至今尚不清楚. 本文結合單分子熒光追蹤技術和分子動力學模擬, 從單分子運動的角度對蜂毒肽與二元脂質細胞膜的界面相互作用過程進行了研究. 結果表明, 相較于其他大多數脂分子而言、部分脂分子在膜內的擴散速率會由于蜂毒肽的吸附、聚集、插膜成孔等擾動行為發生顯著降低; 而蜂毒肽傾向于作用在多組分脂膜相疇的邊界處, 干擾并降低脂膜相分離的程度, 進而降低相邊界對脂質分子擴散運動的限制. 本工作闡明了蜂毒肽的膜作用活性對脂分子運動行為和脂膜相行為的影響、以及三者之間的關聯. 這些結果對于從單分子運動行為的角度來探索抗菌肽生物活性的分子機制和開發新型抗菌藥物具有重要的指導意義.
1 引 言
細胞膜是分隔細胞內部與外界環境的界面, 更是許多重要的生物學過程發生和藥物發揮作用的主要場所. 在這些生物學過程中, 抗菌肽與細胞膜的相互作用近年來廣受關注. 抗菌肽是生物體免疫系統為抵抗外界細菌入侵或殺滅被感染的細胞而分泌的一類短肽, 通常包含20—60個氨基酸殘基、帶正電[1,2]. 與大多數傳統抗生素的作用機制不同, 抗菌肽通過破壞細菌內最保守的結構之一-細胞膜, 并進而導致細菌內容物的泄漏來殺滅細菌[3],因此其殺菌功能具有高效、廣譜和不易產生耐藥性等特點. 因此, 面對目前正在嚴重威脅全球人類健康的抗生素耐藥性甚至“超級細菌”問題, 抗菌肽被認為是一類有效而根本的解決途徑[4,5]. 然而天然抗菌肽具有工作濃度高、細胞毒性大等缺點, 限制了其臨床應用[1,4], 解決這些瓶頸問題的關鍵在于深入了解抗菌肽與細胞膜相互作用的分子機制.
蜂毒肽是最典型的抗菌肽種類之一, 包含26個氨基酸殘基, 帶6個正電荷. 根據目前普遍接受的觀點[6], 蜂毒肽與細胞膜的相互作用過程大致遵循“兩態”模型: 當吸附到膜表面后, 蜂毒肽會由原本的無規卷曲變為a 螺旋結構(附錄A 中圖A1);隨后這些吸附的多肽會進一步插入膜中, 形成跨膜孔和導致跨膜物質泄漏. 蜂毒肽從表面吸附到跨膜插入的轉變是其發揮生物活性的核心, 需要克服較高的能量勢壘(22—37kBT)[7], 而多肽在膜表面的吸附和局部高濃度聚集以及由此對膜結構和性質造成擾動是實現這一轉變的關鍵[7]. 實驗結果顯示,蜂毒肽導致膜孔形成的臨界濃度約為3.0 μg/mL[8];在此臨界濃度附近, 蜂毒肽在脂膜表面的吸附會導致脂膜厚度變薄約3%, 面積延展約4%[7]. Mishra等[9]利用X 射線衍射技術, 證明在多肽作用下、脂膜重組和負高斯曲率結構的出現與多肽的成孔功能密切相關; Weisshaar 等則利用熒光成像等技術證明蜂毒肽對細菌膜的成孔作用是一個反復透化、愈合、再透化的動力學過程; Huang 等[10]和Rzepiela 等[11]的模擬結果顯示, 抗菌肽在膜表面的吸附及其局部濃度的增加, 會改變膜表面的壓力分布, 導致磷脂尾鏈有序程度降低; 而我們之前的研究結果也證明, 聚集的多肽團簇能夠選擇性地從脂膜上葉抽離脂質分子, 造成脂膜兩葉間分子成分和力學狀態的不對稱性[8]. 這些多肽對膜結構的擾動, 結合多肽自身的聚集和構象變化 (例如U 形彎折), 能夠顯著降低蜂毒肽跨膜插入的自由能勢壘[12].然而, 這些相關的實驗研究結果大都是從脂膜和多肽的結構變化的角度出發, 對多肽與膜相互作用過程中大量分子平均效果進行分析和對首末狀態進行刻畫 (例如對跨膜泄漏效果的表征和膜孔結構的分析). 此外, 大多數研究是基于單組分脂質膜模型[13], 并未涉及真實細胞膜體系內不同種類脂質分子之間的復雜相互作用對脂膜物理化學性質及脂膜與外界物質相互作用過程 (例如不同脂質分子在膜平面內的分相行為或所謂的側向不均勻性的出現、脂筏或小窩的形成)的影響[14].
近年來, 單分子追蹤及分析技術的發展使得從物理學分子運動規律研究的角度來了解生物過程的內在機制成為可能[15?17]. 本文構建了二元脂質細胞膜模型, 結合單分子熒光追蹤技術和分子動力學模擬方法, 研究了不同的多肽濃度下、或多肽與脂質膜相互作用過程的不同階段中, 蜂毒肽對脂質分子運動行為的影響. 我們的結果從單分子運動學的角度揭示了脂膜側向不均勻性對兩者相互作用的影響, 以及蜂毒肽增大細胞膜通透性和跨膜成孔的生物活性與細胞膜內的脂分子運動、以及脂膜相行為之間的重要關聯.
2 實驗方法與模型
2.1 材 料
磷脂分子1, 2-dioleoyl-sn-glycero-3-phosphocholine (DOPC), 1, 2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC), 1, 2-dipalmitoyl-snglycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (Rh-PE) (分子結構式見附錄A 中圖A2) 購于AvantiPolarLipids. 蜂毒肽和鈣黃綠素購于SigmaAldrich.
2.2 樣品制備
二元脂膜以傳統囊泡融合法制備.將DOPC 和DPPC 以1∶1 摩爾比混合, 加入0.1%摩爾比例的羅丹明標記的脂質Rh-PE 后在氯仿中充分溶解 (2.0 mg/mL), 利用氮氣吹干并真空干燥2 h 確保氯仿完全揮發. 加入PBS 溶液后在200W 功率下超聲45 min 令其重新分散為囊泡(0.1 mg/mL), 保持50 ℃(DPPC 的相變溫度以上)、利用100 nm 孔徑的聚碳酸酯膜擠壓21次,使其成為尺寸均勻的小囊泡分散液, DLS 測定其尺寸為110 ± 15 nm. 將小囊泡分散液轉移至基底表面親水處理的玻璃倉中, 50 ℃下孵育2h 以上,最后使用1 mL PBS 溶液分三次緩慢沖洗, 即獲得固體基底支撐的二元脂膜. 利用蠕動泵加入一定量蜂毒肽溶液 (濃度如正文所述)、孵育30 min 后在熒光顯微鏡下原位觀察. 需要注意的是, 在實驗中通過預摻雜少量以羅丹明化學標記的脂質RhBPE 分子來自組裝制備脂膜、繼而加入多肽與之發生相互作用, 這種方法可以在一定程度上避免外加染料特異性吸附的過程對脂分子運動行為的影響、以及染料分子對多肽與脂膜之間相互作用的干擾.
2.3 實驗樣品表征
樣品的觀察采用裝有全內反射 (TIRF, 100 ×)鏡頭的熒光顯微鏡(IX71; Olympus)進行, 使用EMCCD(Andor DU-897U)采集圖片數據, 采集速率30 fps. 每個實驗體系皆進行至少3次獨立重復實驗, 每次實驗在不同的樣品或同一樣品的不同區域共計采集6—8 組視頻數據. 視頻采集后, 采用Image J 軟件MOSAIC 插件對所記錄的每一個熒光標記脂質的軌跡進行分析, 從中選取有效軌跡(連續且持續時長大于3 s), 然后根據下列式子分別計算其時間平均均方位移 (time-averaged MSD,和相應的擴散系數:
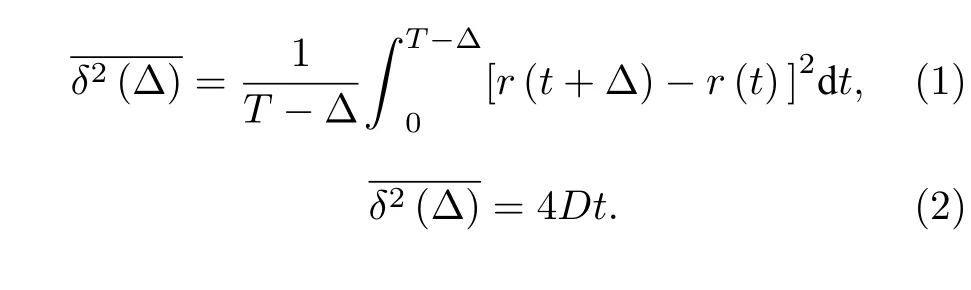
2.4 模擬方法
分子動力學模擬采用粗粒化分子動力學方法,并通過Gromacs 5.1.2 運行. 脂質、水和多肽都采用MARTINI 粗粒化力場進行描述. 模擬按照Verlet 算法執行,時間步長為20 fs. 所有模擬系統都采用NPT 系綜, 系統的壓強設定為1 bar(1 bar=105Pa), 采用Parrinello-Rahman 方法控制; 溫度采用velocity-rescale 的方法維持在300K.粗粒化粒子之間的Lennard-Jones 勢在0—1.1 nm之間衰減為0. 靜電相互作用計算使用reactionfield 方法, 介電常數為15. 在系統的三個方向都使用周期性邊界條件.
2.5 模擬模型
根據MARTINI 力場的特點, 為了使脂膜具有更好相分離能力, 我們在模擬中采用飽和脂質DPPC、不飽和脂質dilinoleoylphosphatidylcholine(DUPC) 和膽固醇 (比例為2:2:1) 來構造脂膜.Helger 和Siewert[18]的模擬表明, 這個體系能夠在有限的模擬時間尺度內實現不同脂質之間的相分離現象, 且所形成的相疇結構等特征與DPPC/DOPC 體系類似. 蜂毒肽的晶體結構可從protein data bank 網站獲得 (PDB 號: 2MLT), 其粗粒化模型可進一步通過Martinize 腳本構造得到. 模擬系統中包含有12個蜂毒肽分子. 為了與實驗保持一致, 我們在模擬中使用脂質相分離已經達到穩定狀態的脂膜來構建初始構型, 并將蜂毒肽分子均勻放置在脂膜表面.為了考察系統在較長時間內的相互作用情況, 每一個系統都模擬了10 μs 以上.
2.6 數據處理
分別對三組實驗體系下的所有有效分子軌跡進行時間平均均方位移分析, 對其擴散系數的頻數分布進行多峰擬合; 利用秩和檢驗法確定實驗結果的置信度, 利用方差檢驗確定小比例部分數據的統計意義; 數據顯示為平均值 ± 標準差的形式 (具體的數據處理細節參見附錄B).
3 結果與討論
3.1 蜂毒肽作用導致的脂質分子運動的多樣性
脂分子的流動性是細胞膜的重要特性, 受單個脂分子所處的局部膜環境和膜周圍介質影響, 與細胞膜的結構、性質及行為密切相關 (例如脂膜相形為、脂筏的形成、小窩的出現、配體受體識別、細胞膜的形變及細胞遷移等)[19,20,21].對于蜂毒肽與膜相互作用體系, 脂質分子運動的變化可以直接反映多肽作用的影響, 脂分子的運動行為反過來也可能影響多肽的活性和功能. 另一方面, 濃度是影響蜂毒肽與脂膜相互作用的重要因素, 也是調控多肽與脂膜作用狀態的關鍵. 在較低濃度下, 蜂毒肽將吸附于細胞膜的表面 (可能伴隨多肽的寡聚和淺插膜行為); 當多肽濃度超過某一臨界值, 多肽插膜和形成跨膜孔, 導致膜通透性增大[22,23]. 我們基于巨囊泡泄漏動力學的實驗結果顯示, 在3.0 μg/mL 的臨界濃度之上, 蜂毒肽的加入會導致染料分子(例如鈣黃綠素) 發生跨膜泄漏, 同時巨囊泡保持其連續和完整性, 意味著膜通透性增大和跨膜孔的形成;而在此濃度之下, 沒有泄漏現象發生(附錄A 中圖A3); 當濃度高于8.0 μg/mL時, 蜂毒肽的加入會導致部分巨囊泡發生破裂. 因此在單分子運動追蹤實驗中, 我們選擇了介于臨界成孔泄漏和破膜濃度之間的5.0 μg/mL 和遠低于臨界成孔濃度的0.5 μg/mL 來開展實驗: 按照相關文獻和我們前期的研究結果[6?8], 在5.0 μg/mL 濃度下, 蜂毒肽分子應處于跨膜插入、形成膜孔的狀態. 而在0.5 μg/mL濃度下, 多肽應處于脂膜表面的吸附狀態.此時, 多肽會在膜表面發生肽鏈的聚集、構象變化, 甚至淺插入等現象, 對膜結構產生擾動[5?8]. 因此, 這一狀態也等同于多肽在跨膜成孔之前的中間時間過程.總的來說, 在這兩個多肽濃度下脂質分子運動的變化可以分別反映出多肽在膜吸附和導致膜通透性增大的劇烈擾動 (例如跨膜成孔) 兩個作用狀態下與脂膜的相互作用情況和特點.
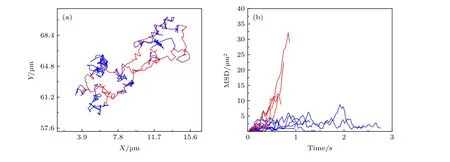
我們利用傳統囊泡融合法制備了玻璃基底搭載的DOPC/DPPC 二元單層脂膜, 以0.1%摩爾比例的Rh-PE 進行熒光標記, 熒光淬滅后恢復(FRAP) 實驗驗證了脂膜具有良好的流動性. 由于DOPC 與DPPC 在分子尾鏈結構上的差異, 此時實驗中的二元單層脂膜應處于相分離狀態[24].相對于常用的單組分脂膜而言, 二元相分離脂膜更有助于理解真實細胞膜體系與外界物質的相互作用過程. 之后, 我們將脂膜與0, 0.5 或5.0 μg/mL濃度的蜂毒肽溶液共同孵育30 min 后置于TIRF 顯微鏡下, 原位追蹤單個脂分子的擴散運動軌跡. 圖1(a) 是0.5 μg/mL 多肽濃度下脂膜的顯微鏡照片, 部分脂分子的運動軌跡典型性地顯示于圖1 (b)中. 由圖1 (b)可以看出, 脂質分子的運動呈現出高度不均勻性. 相同時間間隔內 (例如圖中軌跡時長皆為 3 s), 有些脂質運動速率快, 能夠移動較大的范圍; 而有些脂質的運動則僅局限于很小的范圍之內, 甚至很難分辨出其位置的變化 (藍色箭頭標注). 為了對其進行定量統計, 我們計算了每個脂質分子運動軌跡對應的時間平均均方位移(MSD; 典型曲線顯示于圖1(c)中). 與運動軌跡分布情況相似, MSD 的分布也呈現出高度的不均勻性.
為了了解不同濃度下的蜂毒肽對細胞膜內脂分子運動行為的影響, 我們分別構建了原始脂膜以及暴露于0.5 和5.0 μg/mL 濃度蜂毒肽的脂膜體系, 并分別計算了三種體系中單個脂分子運動擴散系數(DL)的數值及其概率密度分布(PDF). 如圖2所示, 對于原始脂膜, 脂質的擴散系數呈現雙峰分布, 其峰位分別位于0.008 μm2/s (圖2 (a) 中紅色峰)和1.778 μm2/s (藍色峰). 這說明體系中同時存在大量運動較慢和運動較快的脂分子, 這一現象與之前報道的DPPC/DOPC 二元脂膜在該摩爾比例下呈現的相分離狀態是一致的(室溫下DPPC應處于運動緩慢的凝膠相 (gel phase), DOPC 應處于運動較快的流體相(liquid phase))[25]. 在參照實驗中我們構建了純DOPC 脂膜體系, 其中的脂分子運動基本呈現2.780 μm2/s 位置的單峰分布(附錄A 中圖A4). 并且, 在該系統中熒光脂分子Rh-PE 同時存在快慢兩種運動狀態, 說明其分布于不同相疇區域, 這為我們研究脂膜相行為與多肽作用活性的關聯提供了可能.
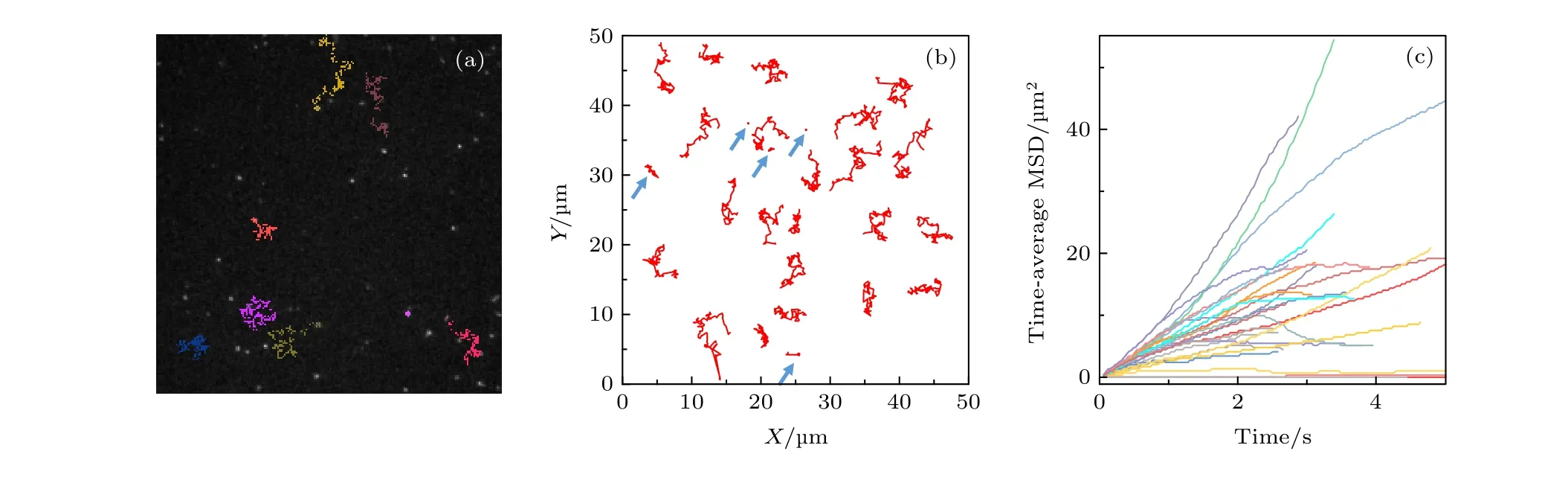
圖1 蜂毒肽作用下脂質分子在脂膜上的運動情況 (a) 熒光顯微鏡照片, 部分脂分子的運動軌跡以彩色線標注; (b) 典型的脂質分子運動軌跡, 采集時間皆為3s, 部分移動范圍較小的軌跡以藍色箭頭標注; (c) 典型的脂質分子時間平均均方位移分布. 蜂毒肽濃度為0.5 μg/mLFig. 1. Diffusion of lipids on a DOPC/DPPC membrane under the action of melittin at 0.5 μg/mL: (a) Microscopy image with some trajectories marked in colors; (b) typical lipid trajectories in 3 s; Some of the immobile ones are marked with blue arrows; (c) representative time-averaged MSD of lipids.
當體系中加入濃度為0.5 μg/mL 的蜂毒肽后,脂質擴散系數分布立即發生了變化. 原本的兩個峰的峰位皆發生輕微左移(例如從1.778 μm2/s 降至1.660 μm2/s), 并且, 在兩峰的中間出現了一個新的分布峰. 從圖2(b) 中的面積比例變化可以推斷,該峰的出現是由于部分快速運動的脂分子的運動速率變緩導致的(由1.778 μm2/s 降低至0.129μm2/s).根據我們之前的實驗及模擬結果, 在此濃度下, 大部分蜂毒肽應呈現脂膜表面吸附的狀態, 偶爾伴有瞬時孔的產生[26]. 該結果表明多肽在膜表面的吸附會限制部分脂分子的運動行為, 顯著降低其擴散系數; 尤其是, 低速率新峰的出現暗示著其對脂膜相行為的影響. 繼而, 在濃度為5.0 μg/mL 蜂毒肽的作用下, 脂質分子的運動發生了更為顯著的變化, 三個峰皆出現明顯的左移, 體系內所有分子的平均擴散系數由1.316 μm2/s 降低至0.661 μm2/s.同時, 新峰的面積比例增加(由5.49%增大到8.02%). 考慮到在此濃度下多肽已經能夠形成大量跨膜孔, 該現象表明多肽導致的膜通透性增大和跨膜孔的形成會顯著限制脂分子的擴散行為, 以及對脂膜相行為帶來更強烈的擾動.
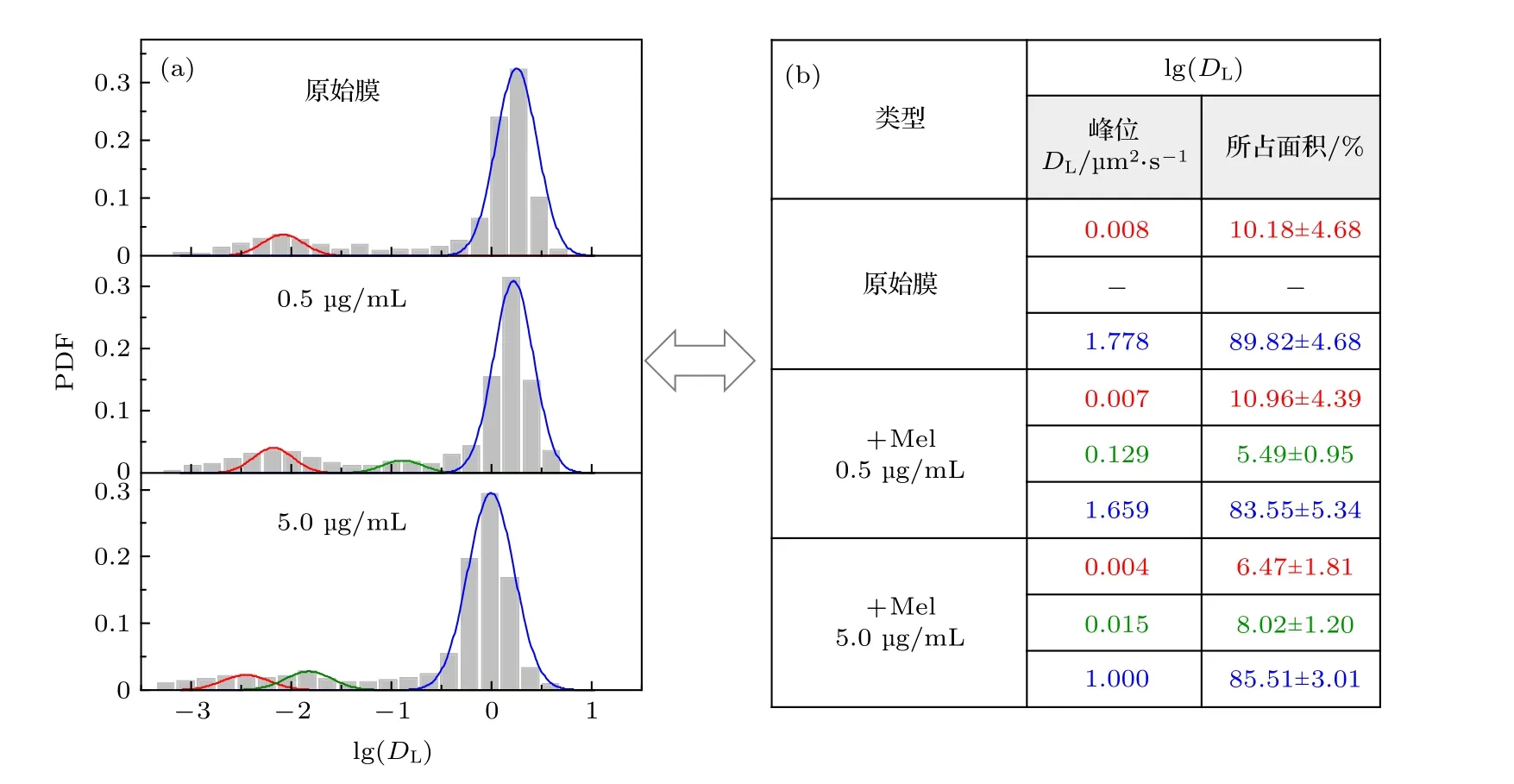
圖2 不同濃度蜂毒肽作用下脂分子擴散系數的分布 (a) 脂質擴散系數分布柱狀圖及擬合曲線; (b) 相應的擬合峰中心位置和在 (a) 圖中所占面積比例, 顯示為擬合曲線面積比例(± 與原始柱狀圖面積比例之間的誤差). 三個體系對應的實驗樣本數分別為657 (原始膜體系), 427 (蜂毒肽濃度0.5 μg/mL)和507 (蜂毒肽濃度5.0 μg/mL)Fig. 2. PDF distribution of lipid diffusion coefficients (DL) of membrane with different melittin concentrations: (a) Histograms andfittings of the PDF; (b) corresponding peak locations and area proportionsin (a). Sample numbers are 657 (pristine membrane), 427(with Mel at 0.5 μg/mL) and 507 (with Mel at 5.0 μg/mL), respectively.
3.2 蜂毒肽導致的脂質分子運動的復雜性
脂質分子在膜內的運動非常復雜. 由于所處局部膜環境不同, 不同的脂質分子側向擴散運動能力也有所不同.我們基于小波變換方法分別分析了單個分子的運動軌跡 (附錄A 中圖A5—圖A7 及相應方法闡述), 以獲得單個脂質分子運動 (或MSD)隨時間變化的情況. 結果顯示, 脂質分子在膜內的運動大致分為三種模式: 某些脂質分子在整個觀察時間段內持續受到移動限制, 運動速率緩慢.這表明此類脂質分子運動強烈受限或者受到外界物質的阻礙; 與之相對, 有些脂質分子在觀察時間段內所受到的限制或阻礙很小, 能夠保持快速運動; 此外, 也有脂質分子的運動模式會隨著時間發生變化, 快、慢運動間隔發生, 說明這些脂質分子在不同的時間階段或位置所受到的限制程度不同.相應地, 我們將脂質分子的這三種運動模式分別稱為Slow 型、Fast 型和Mixed 型 (更多細節參見附錄B). 總的來說, 這些脂質分子的運動模式或模式的變化都是由其所處局部環境的變化導致的, 是脂質分子與脂質分子、溶劑或外界其他物質(如多肽等) 之間復雜相互作用的直接體現.
實驗發現 (圖3), 對于原始脂膜體系, 約69%的脂質分子呈Mixed 型運動模式, 這說明大部分脂分子呈現快、慢交替的運動方式, 這一現象體現了脂分子運動過程中所遭受到的環境不均勻性 (例如跨越相邊界). 然而, 隨著蜂毒肽的加入和濃度的提高, Slow 型的脂質比例逐步增加. 這說明蜂毒肽在膜表面的吸附會限制部分脂分子的運動.而高濃度多肽對膜的劇烈擾動會增強這一限制效果, 使得更多的脂分子體現出運動受限的特性.這與前面的結果是一致的. 事實上, 與原始脂膜相比, 蜂毒肽的加入導致了Mixed 型脂分子所占比例大幅下降(由69%降至36%), 降低的該部分脂分子分別呈現了Slow 和Fast 型運動模式, 這暗示著蜂毒肽的吸附和插膜等作用傾向于發生在Mixed 型運動的脂分子區域, 降低了該部分脂分子運動過程中所遭受到的環境不均勻性, 這應是多肽對脂膜相分離行為的干擾導致的.
3.3 蜂毒肽對脂膜相邊界的干擾
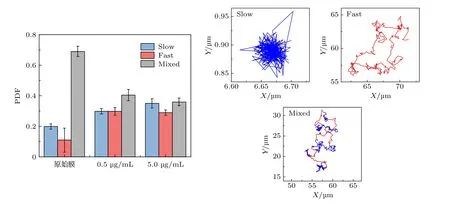
圖3 脂質分子的三類運動模式及其在不同體系中的比例分布. 右圖為典型的三類運動模式的分子軌跡, 藍色和紅色分別對應緩慢和快速運動階段Fig. 3. Three different types of lipid diffusion modes and their PDFs in three conditions of membrane without or with melittin exposure. Representative trajectories are shown on the right.
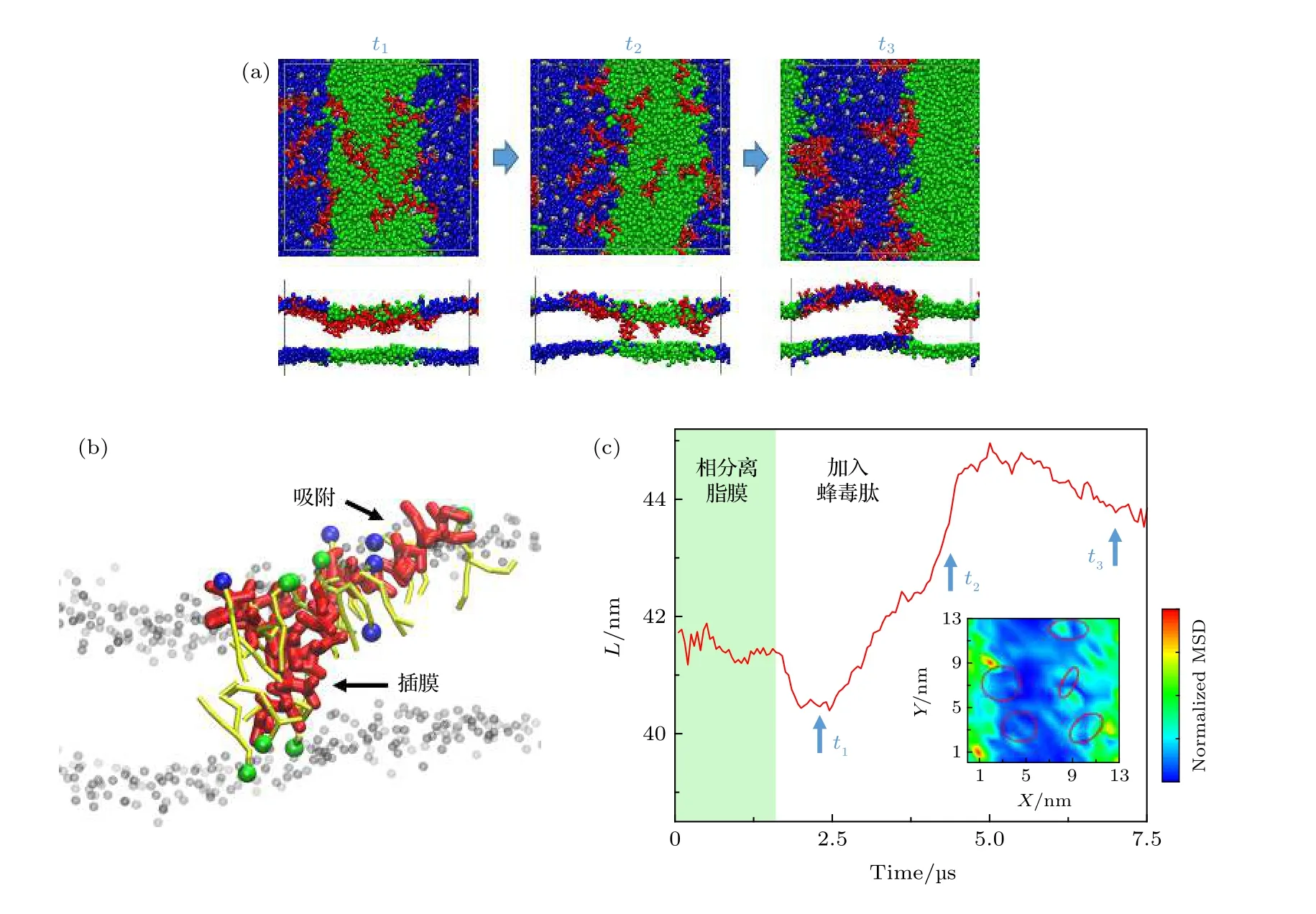
圖4 蜂毒肽對脂膜相分離行為的干擾 (a) 蜂毒肽與相分離脂膜相互作用過程的分子動力學模擬截圖.上圖是俯視圖, 下圖是側視圖. 紅色對應蜂毒肽, 藍色代表DPPC 脂分子頭基, 綠色為DUPC 脂分子頭基. 側視圖中脂質尾鏈未顯示; (b) 吸附或插膜狀態下多肽與周圍脂質分子的相互作用細節. 顏色同 (a). 此外, 多肽周圍的部分脂分子尾鏈以黃色棒表示, 遠離多肽的脂質分子僅顯示頭部 (灰色); (c)相邊界長度(L) 在蜂毒肽加入前后隨時間的變化. 圖(a) 中的時間點對應標記于圖(c) 中. 插圖為多肽作用下單個脂分子擴散MSD 的等值分布圖, 其中以紅色圓圈標出多肽位置 P/L = 12/512Fig. 4. Interaction between melittin and a phase-separated bilayer: (a) Snapshots showing the melittin-inducedporeformation process. Top: top view, bottom: side view. Red: melittin, blue: DPPC headgroup, green: DUPC headgroup. For clarity, lipid tails are not shown; (b) interaction details between Mel (red) and the surrounding lipids. Color codes are the same as in (a), with tails of the surrounding lipids in yellow, and heads of lipids away from the peptides in grey; (c) time evolution of phase boundary length (L) before and after the addition of melittin at P/L = 12/512. The time points of (a) are marked correspondingly in (c).
為了進一步驗證我們的推斷, 我們采用分子動力學模擬方法追蹤了蜂毒肽與多組分脂質膜相互作用和成孔的過程. 如圖4 所示, 原始脂膜呈現清晰的兩相分離狀態; 蜂毒肽的加入(多肽與脂分子之間的摩爾比為P/L=12/512) 會導致膜孔的形成.多肽與脂膜的相互作用具有兩個顯著的特點.其一, 多肽在膜表面會逐步聚集形成團簇, 并且, 無論多肽是處于表面吸附還是跨膜插入狀態, 它都會對其周圍的脂質產生強烈的吸引作用 (圖4 (b)),從而顯著限制吸附區域脂質的運動, 使脂分子的運動變緩(附錄A 中圖A8). 這與實驗中觀察到的脂質擴散系數下降以及快速運動脂分子比例降低的結果(圖2) 是一致的. 其次, 模擬結果顯示, 多肽對膜的作用顯著傾向于發生在脂膜兩相邊界附近區域, 這可能是由于相邊界區域脂膜呈現相對較多的結構缺陷供多肽實現插膜成孔功能.基于單個脂分子短時均方位移變化, 我們定量分析了由于多肽作用導致的脂膜不同區域的脂分子擴散運動變化,如圖4(c)插圖所示, 由圖可以發現, 多肽在相邊界區域的作用能起到模糊相分離的效果, 并對多肽吸附區域及周邊脂分子的運動行為產生了明顯的擾動.為了分析蜂毒肽對脂膜相分離行為的影響, 我們定量統計了整個相互作用過程中相邊界的長度值(L) 隨時間的變化, 結果顯示, 在蜂毒肽的吸附和成孔過程中, 脂膜兩相的邊界長度出現波動并顯著增大(圖4 (c)). 由于在加入多肽之前脂質體系的相分離已經達到穩定狀態, 因此, 此時相邊界長度的變化清楚地表明了蜂毒肽對脂膜相行為的干擾和破壞性, 令兩相分離程度降低.相分離行為被模糊化的現象降低了該區域脂分子環境的不均勻性, 由此降低了相邊界對附近區域脂質分子運動的限制, 改變了脂質分子的運動行為規律 (例如從Mixed 模式轉變為Fast 模式或Slow 模式). 這些模擬結果很好地解釋了實驗中觀察到的由于蜂毒肽所導致的脂質分子運動行為的變化趨勢(如脂質的擴散系數新的分布峰出現和Fast/Slow 模式脂質的增加等), 并證明了蜂毒肽生物活性與脂分子運動模式以及細胞膜相行為之間的關聯.
4 結 論
在本工作中, 我們結合單分子熒光追蹤技術和計算機分子動力學模擬方法, 從單分子運動行為分析的角度, 研究了蜂毒肽與二元脂膜的界面相互作用動力學過程, 尤其是該過程中, 處于不同作用狀態的多肽(吸附于膜表面的階段以及導致膜通透性增大和跨膜成孔的階段) 對脂分子在膜內運動行為的影響, 以及二者之間的關聯. 實驗及模擬結果顯示, 脂分子在二元脂膜內的運動呈現快、慢兩種狀態; 蜂毒肽的表面吸附會顯著降低部分快速運動的脂質分子的運動速率, 而多肽對膜的進一步擾動和成孔會進一步加劇這一影響; 同時, 會令所有脂分子的運動速率發生不同程度的減慢. 并且, 蜂毒肽傾向作用于多元脂膜相分離的邊界區域, 擾動并降低脂膜相分離的程度, 進而降低該區域單個脂分子運動過程中所遭受到的環境不均勻性, 降低相邊界對脂質分子運動的限制. 本文從描述單分子運動行為的角度對蜂毒肽跨膜成孔實現殺菌功能的過程進行了研究, 從一個新的角度來闡述兩者的相互作用分子機制. 此外, 對于今后的實驗, 一個重點可以放在雙色單分子成像實驗上, 通過同時對多肽和脂質進行熒光標記來實現對不同組分分子的運動情況的追蹤和刻畫, 這將有助于全面準確地理解多肽作用和脂質運動之間的關聯. 總的來說, 本工作表明抗菌肽的膜活性與脂膜的相行為密切相關,證明了細胞膜的相疇邊界是抗菌肽發揮生物活性的重要作用點. 哺乳動物細胞與細菌在膜組分和結構上有明顯區別, 相應的相疇結構和相邊界組分也有所不同. 因此, 本文的結果表明針對這些差異來調節蜂毒肽與不同細胞膜相疇的作用方式可能是實現抗菌肽靶向選擇性的有效途徑之一. 這對開發新型抗菌藥物具有一定的參考意義.
附錄A 利用小波變換處理脂質分子運動軌跡
小波變換可以將一條軌跡中不同的運動模式區別開來.以圖A5 (a) 所示的軌跡 (X坐標隨時間的變化) 為例. 這條軌跡可以基于Haar 小波分別做第2—64 階的變換, 其中每一階的變換系數由下式計算得到:
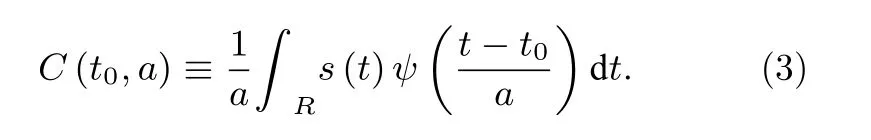
圖A5 (b) 顯示了這條軌跡相應的小波變換系數. 對于不同階的變換, 系數所包含的信息也有所不同, 圖A6 (a)—圖A6(c)分別是第2 階、32 階和64 階對應的系數. 因此選擇適當的系數有助于區分軌跡中所包含的不同信息. 這里, 根據相對的變化程度, 我們選擇第32 階系數作為研究對象, 通過計算閾值δ來區分軌跡中不同的運動模式. 閾值δ的計算可通過低階變換系數 (如第2 階) 計算得到:
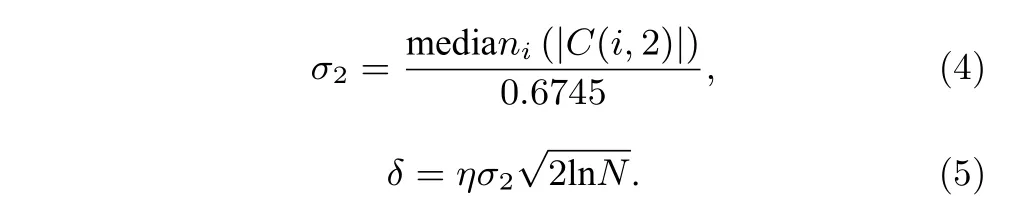
圖A6 (d) 顯示了此軌跡經小波變換得到的第32 階系數以及相應的閾值紅線 (±δ). 紅線所包含的陰影部分是軌跡中運動較慢的部分, 而在閾值以外的部分即可認為是軌跡中運動變化較快的部分. 圖A7 (a)顯示了經過區分后的軌跡, 紅色和藍色分別表示了軌跡中運動較快和較慢的部分.為了驗證此方法的效果, 我們分別計算了軌跡中紅色和藍色部分所對應的均方位移. 如圖A6 (b)所示, 兩個部分的擴散方式的確有明顯的區別.

圖A1 蜂毒肽的 (a) 氨基酸序列和 (b) 吸附在膜表面后的a 螺旋結構Fig. A1. The sequence and a-helical structure of melittin.
圖A2 DOPC, DPPC, Rh-PE 分子的結構式Fig. A2. A2. Molecular structure of DOPC, DPPC and Rh-PE.
脂分子運動模式的定量區分: Slow 型、Fast 型和Mixed 型.
我們對每一條脂質分子的軌跡進行了小波變換處理,其中紅色部分即為fast 部分, 藍色部分為slow部分, 相應地, 我們計算了這兩部分軌跡的均方位移, 從中發現紅色部分的斜率均大于2 (長距離擴散), 而藍色部分的斜率均小于0.1 (短距離徘徊).
附錄B 數據處理
1 數據采集及樣本數
我們的實驗包含三個體系, 即原始膜、加入0.5 μg/mL濃度蜂毒肽、加入5.0 μg/mL 濃度蜂毒肽體系; 每個體系分別進行了至少三次獨立重復實驗, 每次實驗在不同的樣品或同一樣品的不同區域采集共計6—8個視頻片段. 一般來說, 視頻視野中熒光分子信號總數約為200—500個, 其中經篩選后得到的有效軌跡約占總數的25%左右 (篩選標準為軌跡必須連續且持續時長大于3 s). 每一個體系所采集到的有效軌跡的數量 (即PDF 的實驗樣本數) 如表B1所列.
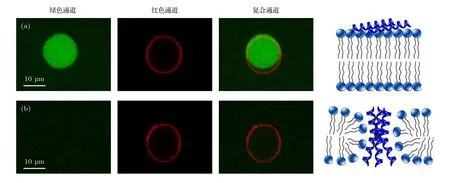
圖A3 包裹鈣黃綠素的巨單層囊泡在濃度為 (a) 0.5 和 (b) 5.0 μg/mL 蜂毒肽溶液中的熒光共聚焦顯微照片, 包括綠色 (鈣黃綠素) 通道、紅色 (脂分子) 通道和復合通道. 右圖為對應的蜂毒肽作用方式的卡通圖, 包括膜表面吸附和跨膜插入Fig. A3. Confocal images of calcein-encapsulated GUVs exposed to melittin at 0.5 or 5.0 μg/mL. The images were taken in the green (calcein), red (lipid) and overlaid channels. Cartoons on the right refer to the corresponding action states of peptides, including surface adsorption and transmembrane insertion.
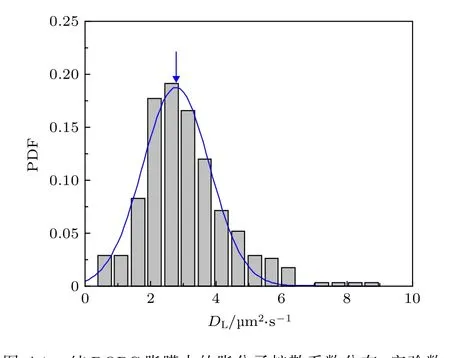
圖A4 純DOPC 脂膜中的脂分子擴散系數分布. 實驗數據來自3次獨立重復實驗, 樣本數為404, 擬合曲線的峰位位置2.780 μm2/sFig. A4. PDF of lipids in a pure DOPC bilayer. The data were obtained from three times of independently repeated tests, with a sample number of 404. Peak of the fitted curve locates at 2.780 μm2/s.
2 實驗置信度分析
我們繼而使用秩和檢驗(Gibbons J D, Chakraborti S 2011Nonparametric Statistical Inference(5th Ed.) (Boca Raton: Chapman & Hall/CRC Press); Hollander M,Wolfe D A 1999Nonparametric Statistical Methods(Hoboken: John Wiley & Sons, Inc.)) 法對三次獨立重復實驗的結果進行了分析. 選擇秩和檢驗的原因是它不依賴于總體分布的具體形式, 而t檢驗等一般要求數據符合正態分布.
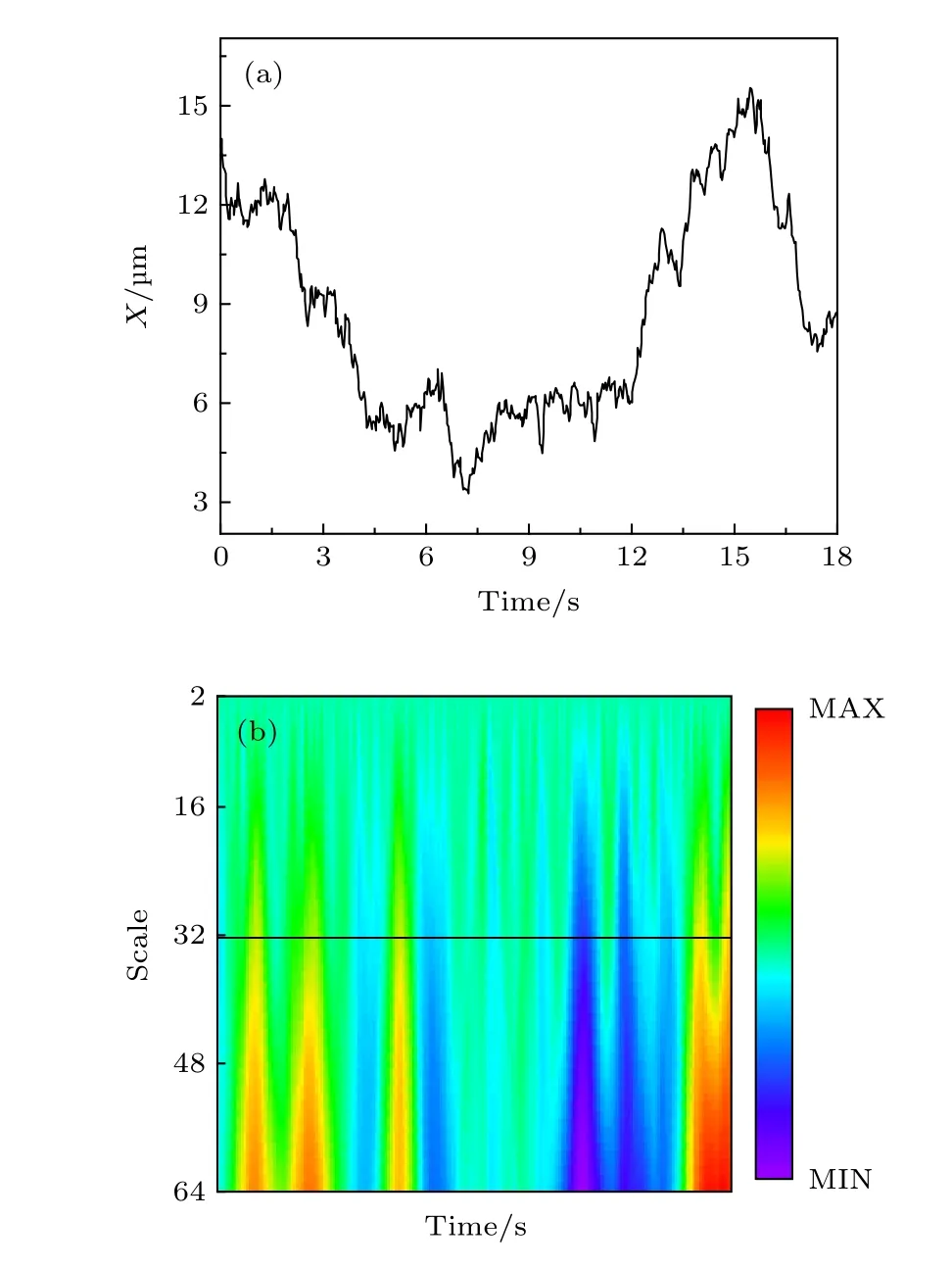
圖A5 小波變換法處理脂分子運動模式舉例 (a) 原始軌跡中X 坐標隨時間變化曲線; (b) 從第2 階到第64 階的連續小波變換系數Fig. A5. Example of lipid trajectories handled by wavelet:(a) X-coordinate profile of the original trajectory;(b) wavelet coefficients from the 2 nd to the 64 th.
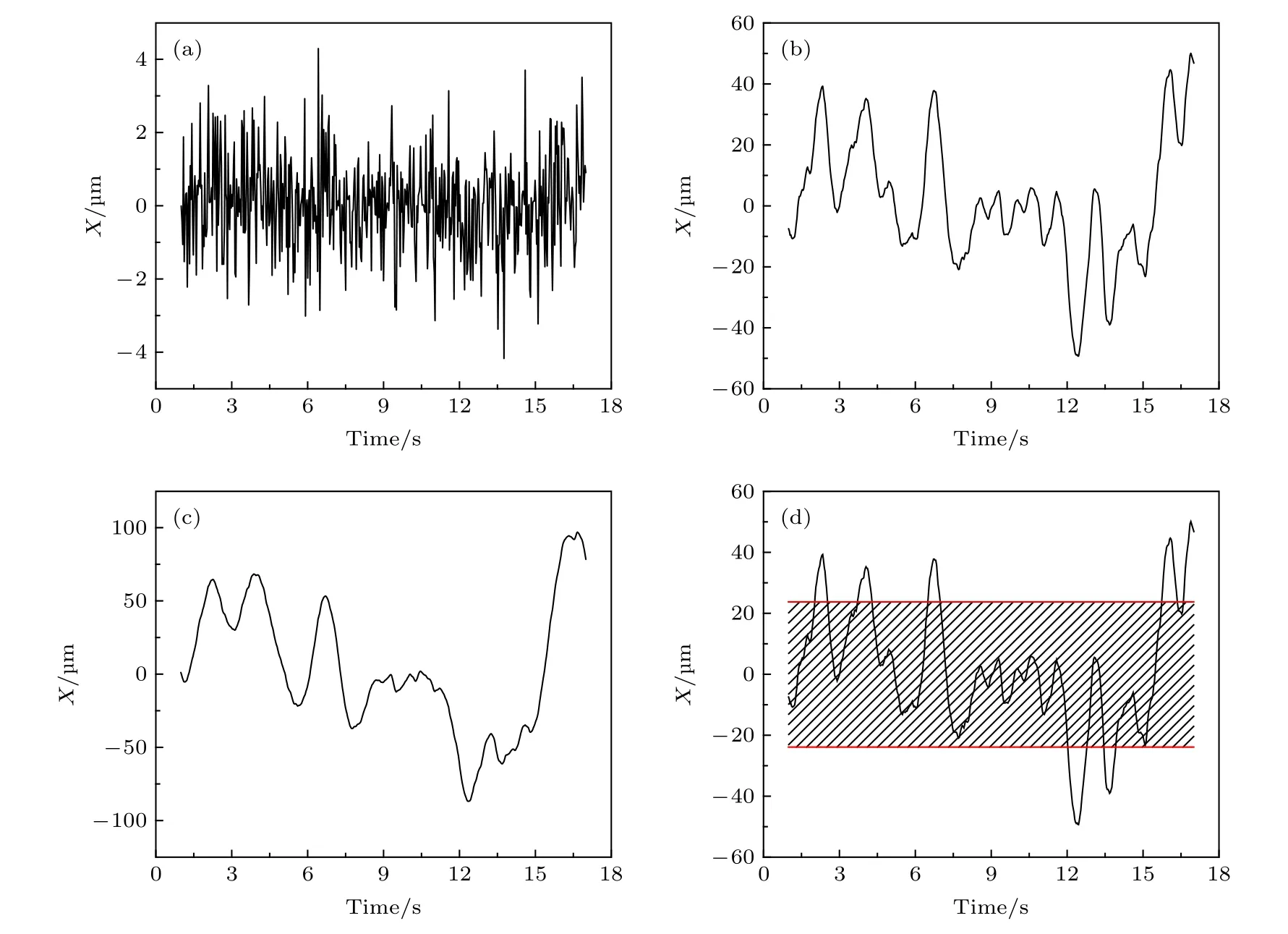
圖A6 第2 階 (a)、32 階 (b) 和64 階 (c) 對應的小波變換系數; (d) 此軌跡經小波變換得到的第32 階系數以及相應的閾值紅線Fig. A6. The wavelet coefficients of the 2 nd, 32 th and 64 th scale; (d) the 32 th wavelet coefficient and the corresponding red line of threshold value.
圖A7 (a) 第32階系數小波變換區分后的軌跡曲線, 紅色和藍色分別對應軌跡中運動較快和較慢的階段;(b) 與圖 (a) 中紅色、藍色階段相對應的MSD 分布Fig. A7. (a) Trajectory discriminated by wavelet using the 32 th scale coefficient, whose red part refers to the “fast” motion type and blue part refers to the “slow” motion type;(b)the corresponding MSD distributions of the red and blue parts.
選擇置信區間為95% (a= 0.05),p為實驗數據總體一致的概率,h為檢驗結果. 由表B2 中三組實驗的結果分析, 擴散系數的分布大致相當,h為0, 實驗結果可信.
3 脂分子擴散系數PDF 分布 (正文圖2) 的統計價值討論
針對這個問題我們計算了每一個體系所有擴散系數的均值和方差 (標準差), 如表B3 所更. 由統計結果可以看出,方差 (標準差) 相對于均值顯然是不可忽略的. 使用均值這一指標雖然可以反應體系的一些變化, 但是掩蓋了體系中的一些關鍵的信息. 而如此之大的方差也意味著那些占比較小的部分不可忽略、具備統計價值.

表B1 實驗樣本數Table B1. Number of samples in different experimental conditions.
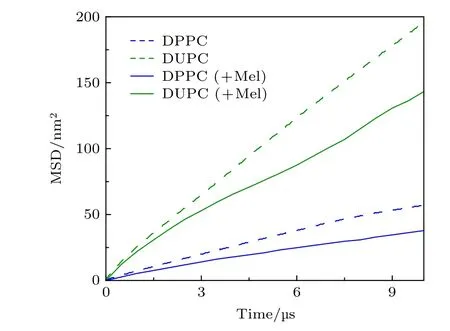
圖A8 模擬體系中蜂毒肽加入前后脂質分子對應的MSD 分布. 蜂毒肽加入后, 脂質運動明顯變慢Fig. A8. Changes in MSD distributions of lipids before and after the addition of Mel in the simulations.
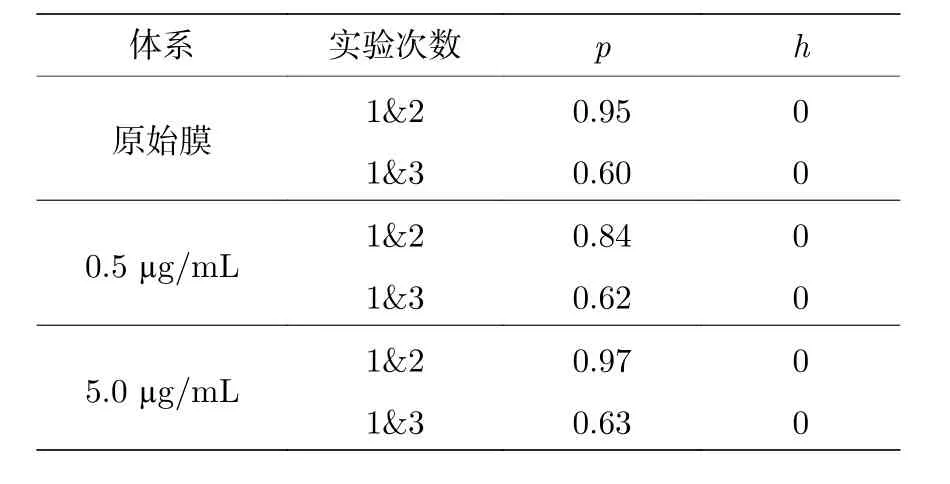
表B2 基于三次獨立實驗結果的秩和檢驗置信度分析Table B2. Confidence analysis using rank sum test based on three independently repeated experiments.
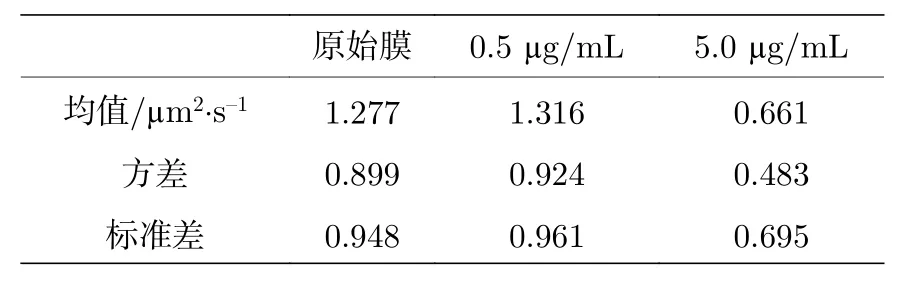
表B3 脂分子擴散系數PDF 分布的方差分析Table B3. Variance analysis of the DL distribution in different conditions.

