燕麥β-葡聚糖、多酚及黃酮的抑菌活性研究
(長江師范學院現代農業與生物工程學院,重慶408100)
燕麥屬一年生植物,是重要的谷類作物之一,在中國、美國、加拿大等世界各地作為糧食、牧草和飼料均有種植。燕麥有皮燕麥和裸燕麥之分,其中我國主要以裸燕麥為主[1-2]。燕麥富含蛋白質、不飽和脂肪酸、維生素和礦物質等諸多營養成分[3],尤其是其富含的β-葡聚糖、多酚、黃酮、皂苷、生物堿等物質表現出的良好生物活性,使其被越來越多的人所熟知[4-5]。有學者研究發現燕麥β-葡聚糖具有調節血糖、降血脂、提高免疫力、改善腸道功能、抗氧化、抗癌等諸多功效[6-7],其中β-葡聚糖的分子量是影響其生理功效的重要因素之一。李文全等[8]研究發現大分子燕麥β-葡聚糖可促進糞膽固醇和膽汁酸的排出,抑制肝臟甘油三酯(triglyceride,TG)和膽固醇的沉積,增加膽汁酸的合成。王英[9]發現燕麥β-葡聚糖可增加胃腸道食糜黏性,抑制腸道酶活性,延緩胃排空,降低餐后血糖水平,增加飽腹感。任錦麗等[10]發現燕麥β-葡聚糖還可改善腎功能,有效延緩糖尿病腎病大鼠的腎臟組織結構損傷。另外燕麥中含有多種酚類物質,如阿魏酸及其衍生物、黃酮類化合物、花青素和燕麥蒽胺等,燕麥蒽胺是僅存在于燕麥中的一種N-肉桂酸衍生物,不存在于其他谷物中[11],不同品種燕麥中多酚含量也存在差異[12]。已有研究表明燕麥多酚具有較好抗氧化活性,且能有效預防酒精造成的急性肝損傷[13-15]。黃酮類化合物是膳食多酚的主要亞類之一,其具有較強的抗氧化活性和抗癌活性[16]。
燕麥β-葡聚糖、多酚及黃酮的提取及抗氧化活性功能屢有報道,但對其抑菌活性的研究較少。本研究以燕麥為原料,提取其中的燕麥β-葡聚糖、黃酮及多酚物質,選用大腸埃希氏菌、枯草芽孢桿菌、產酯酵母以及黑曲霉為指示菌,探究其抑菌活性,為燕麥在食品防腐方面的開發利用提供參考。
1 材料與方法
1.1 試驗材料
1.1.1 主要試驗材料及試劑
燕麥米、馬鈴薯:新大興愛家超市;燕麥β-葡聚糖(標準品):西格瑪奧德里奇(上海)貿易有限公司;蘆丁:合肥博美生物科技有限責任公司;沒食子酸、葡萄糖、氯化鈉:天津市大茂化學試劑廠;卡拉膠:海南省瓊海市長青瓊脂廠;牛肉膏、蛋白胨:北京奧博星生物技術有限責任公司。
1.1.2 試驗菌種及培養基
大腸埃希氏菌(CMCC(B)44102)、枯草芽孢桿菌(CMCC(B)63501)、黑曲霉(CMCC(F)98003):上海魯微科技有限公司;產酯酵母:長江師范學院生物工程微生物實驗室提供。
培養基配制:參考蔣詠梅[17]的馬鈴薯培養基(potato dextrose agar,PDA)配方以及牛肉膏蛋白胨培養基配方進行配制。
1.1.3 儀器與設備
FZ102型微型植物粉碎機:天津市泰斯特儀器有限公司;CI540DWS型自動壓力蒸汽滅菌器:致微(廈門)儀器有限公司;L550型醫用離心機:長沙高新技術產業開發區湘儀離心機儀器有限公司;LRHS-150-Ⅱ型恒溫恒濕培養箱:上海躍進醫療器械有限公司;ZHJH-C1112C型超凈工作臺、ZFD-5040型全自動新型鼓風干燥箱:上海智城分析儀器制造有限公司;T6新世紀型紫外可見分光光度計:北京普析通用儀器有限責任公司。
1.2 試驗方法
將燕麥米置于鼓風干燥箱中,于50℃條件下烘干4 h,然后用植物粉碎機粉碎,過50目篩備用。
1.2.1 燕麥β-葡聚糖的提取
采用超聲輔助浸提法提取[18]:稱取預先制備好的燕麥粉20 g,加水400 mL,調節pH值至10.0,于50℃條件下超聲浸提35 min,采用耐高溫α-淀粉酶去除淀粉,加入20%的HCl溶液靜置過夜離心除蛋白,加入無水乙醇沉淀離心得β-葡聚糖沉淀,將β-葡聚糖加水溶解定容至5 mL,即得β-葡聚糖提取液。
1.2.2 燕麥多酚的提取
稱取預先制備好的燕麥粉20 g,加入50.6%的乙醇400 mL,于60℃水浴中浸提65 min,離心去除沉淀,將濾液旋轉濃縮至10 mL,所得溶液即為燕麥中多酚提取液[19]。
1.2.3 燕麥黃酮的提取
稱取預先制備好的燕麥粉20 g,加入70%的乙醇320 mL,于55℃條件下超聲提取90 min,然后離心,去除沉淀,將濾液旋轉濃縮至10 mL,所得溶液即為燕麥中黃酮提取液[20]。
1.2.4 燕麥β-葡聚糖標準曲線的繪制
以燕麥β-葡聚糖為標準品,采用剛果紅分光光度法在545 nm波長條件下測定各吸光度值[21]。
燕麥β-葡聚糖標準溶液的配制:準確稱取0.020 g燕麥β-葡聚糖,加少量去離子水,在70℃水浴條件下攪拌溶解,待其溶解完全后,取出冷卻至20℃,加去離子水定容至200 mL,得標準溶液(0.1 mg/mL)。
剛果紅溶液:準確稱取剛果紅試劑0.020 g,用磷酸緩沖液(0.1 mol/L、pH 8.0)溶解并定容至200 mL。取10mL 試管 6 只,分別加入 0、0.2、0.4、0.6、0.8、1.0 mL燕麥β-葡聚糖標準儲備液(0.1 mg/mL),用去離子水補至1.0 mL,然后各加入4.0 mL剛果紅溶液(0.1 mg/mL),搖勻,于20℃的水浴中靜置30 min,在545 nm波長條件下測定吸光度值,以燕麥β-葡聚糖的質量濃度為橫坐標,吸光度值為縱坐標,繪制標準曲線。
1.2.5 燕麥多酚標準曲線的繪制
精確稱取25 mg沒食子酸,用水溶解并定容至250 mL,得標準溶液(0.1 mg/mL)。取10 mL試管6只,分別加入 0.0、0.2、0.4、0.6、0.8、1.0 mL 沒食子酸標準溶液,然后各加入1 mL福林酚試劑,搖勻,加15%Na2CO3溶液2mL,定容至10 mL,20℃條件下20℃下靜置2 h,在760 nm處測定吸光度值,以沒食子酸的質量濃度為橫坐標,吸光度值為縱坐標,繪制標準曲線[19]。
1.2.6 燕麥黃酮標準曲線的繪制
稱量預先烘干至恒重的蘆丁標準品32.2 mg,用70%的乙醇溶解定容至500 mL,搖勻,得蘆丁標準溶液(0.064 4 mg/mL)。取10 mL試管6只,分別加入標準溶液 0.00、0.25、0.50、1.00、1.50、2.00 mL,然后各加入0.10 mol/L AlCl3溶液 1.00 mL、1.0 mol/L 的 CH3COOK溶液1.50 mL,用70%的乙醇定容至5 mL后搖勻,于20℃下靜置30 min,于420 nm處測定吸光度值,以蘆丁的質量濃度為橫坐標,吸光度值為縱坐標,繪制標準曲線[20]。
1.2.7 指示菌液的制備
將供試細菌(大腸埃希氏菌、枯草芽孢桿菌)接種于牛肉膏蛋白胨固體斜面培養基上,供試真菌(產酯酵母、黑曲霉)接種于馬鈴薯培養基(PDA培養基)上,分別置于37℃(細菌)和28℃(真菌)恒溫恒濕培養箱中培養48 h,連續傳代2次。在無菌條件下取活化好的菌株,用接種環分別挑取1環菌種放入100 mL無菌生理鹽水中,振蕩混合均勻,制成菌懸液,備用。
1.2.8 抑菌試驗
濾紙片法:將提取的各燕麥活性物質稀釋成0.00、0.06、0.12、0.24、0.36、0.48 mg/mL 的系列溶液,用鑷子夾取經高壓蒸汽滅菌后的濾紙片(6 mm),將其浸泡在不同濃度的提取物溶液中備用;在無菌條件下,加入0.1 mL供試菌種懸液,用涂布器均勻涂布于培養基表面,然后將經作用液浸泡后的濾紙片置于含菌培養基表面,放于培養箱中培養24 h,觀察抑菌圈的形成,采用十字交叉法測定抑菌圈直徑,重復3次,取平均值。當抑菌圈直徑大于6 mm時,表示有抑菌作用;若對照組也產生抑菌圈,表示試驗失敗無效[22]。
牛津杯法:將已滅菌的培養基冷卻至60℃左右,倒入培養皿內,每皿約20 mL待其凝固;在無菌條件下,吸取0.1 mL菌懸液置于平板內,用涂布器涂布均勻;然后將經滅菌處理的牛津杯(內徑6 mm,外徑8 mm)垂直擺放于培養基表面,輕輕按壓使其與培養基無隙接觸,加入 0.00、0.06、0.12、0.24、0.36、0.48 mg/mL的系列溶液0.25 mL,放在培養箱里培養24 h,觀察抑菌圈并記錄數據,重復3次,取平均值。當抑菌圈直徑大于8 mm時,表示有抑菌作用;若對照組也產生抑菌圈,表示試驗失敗無效。
1.3 數據處理
2 結果與分析
2.1 燕麥β-葡聚糖標準曲線
以燕麥β-葡聚糖質量濃度為橫坐標,相應吸光度值為縱坐標,繪制標準曲線,如圖1。

圖1 β-葡聚糖標準曲線Fig.1 Standard curve of β-glucan
得到曲線方程為:y=0.038 7x-0.011,根據曲線方程計算得提取液中燕麥β-葡聚糖的含量為0.526 mg/mL。
2.2 燕麥多酚標準曲線
以沒食子酸質量濃度為橫坐標,相應吸光度值為縱坐標,繪制標準曲線,如圖2。
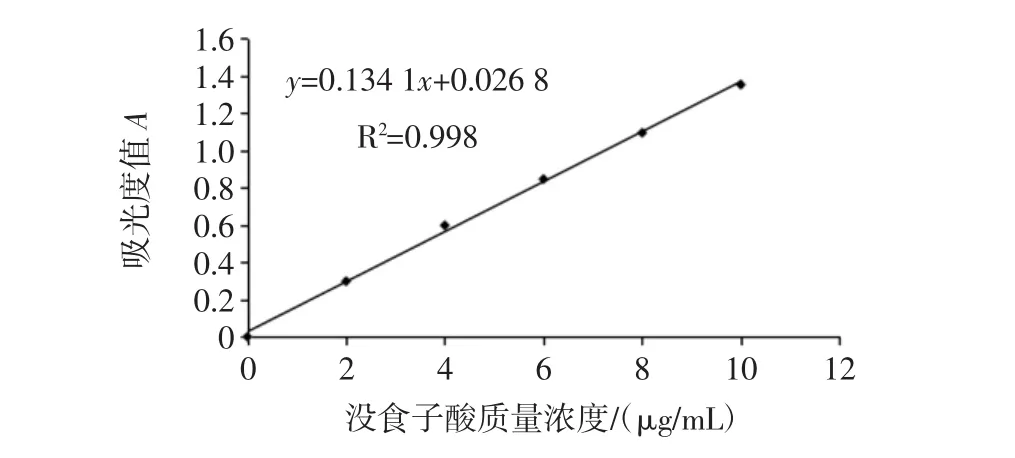
圖2 沒食子酸標準曲線Fig.2 Standard curve of gallic acid
得到曲線方程為:y=0.134 1x+0.026 8,根據曲線方程計算得提取液中燕麥總酚的含量為0.586 mg/mL。
2.3 燕麥黃酮標準曲線
以蘆丁質量濃度為橫坐標,相應吸光度值為縱坐標,繪制標準曲線,如圖3。
得到曲線方程為:y=0.028 6x+0.013 6,根據曲線方程計算得提取液中燕麥總黃酮的含量為0.537 mg/mL。
2.4 燕麥β-葡聚糖的抑菌效果
2.4.1 濾紙片法測定燕麥β-葡聚糖的抑菌效果
將經過系列濃度梯度燕麥β-葡聚糖提取液浸泡后的濾紙片置于含菌培養基上,測定其抑菌圈,記錄數據見表1。

圖3 蘆丁標準曲線Fig.3 Standard curve of rutin

表1 濾紙片法測定燕麥β-葡聚糖的抑菌效果Table 1 The antibacterial effects of oat β-glucan determined by filter paper method
由表1數據可知,燕麥β-葡聚糖提取物對4種供試菌抑制作用不同,抑菌作用順序為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉。當燕麥β-葡聚糖濃度為0.36 mg/mL時對大腸埃希氏菌和枯草芽孢桿菌具有明顯抑菌作用,但對產酯酵母和黑曲霉抑菌作用不顯著,抑菌圈大小均隨燕麥β-葡聚糖濃度的增大而增大,說明燕麥β-葡聚糖的濃度對其抑菌作用存在影響。
2.4.2 牛津杯法測定燕麥β-葡聚糖的抑菌效果
采用牛津杯法測定燕麥β-葡聚糖提取液對4種供試菌的抑菌活性,測定抑菌圈,得數據見表2。

表2 牛津杯法測定燕麥β-葡聚糖的抑菌效果Table 2 The antibacterial effects of oat β-glucan determined by Oxford cup method
由表2中數據可知,該方法顯示燕麥β-葡聚糖提取物對4種供試菌均有一定抑制作用,抑菌作用大小順序與濾紙片法測得一致,為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉。當燕麥β-葡聚糖濃度為0.12 mg/mL時對大腸埃希氏菌和枯草芽孢桿菌具有明顯抑菌作用,比濾紙片法作用較明顯。對產酯酵母和黑曲霉抑菌作用與空白相比在濃度為0.36 mg/mL才表現出顯著差異,但抑菌圈大小也隨燕麥β-葡聚糖濃度的增大而增大,該結論與濾紙片法一致。
蘇亞平[23]研究表明酵母β-葡聚糖對大腸桿菌、金黃色葡萄球菌、沙門氏菌等有明顯抑制效果。唐艷紅等[24]研究報道燕麥β-葡聚糖對大腸埃希氏菌、啤酒酵母均有顯著抑制作用,最低抑菌濃度為2%,但對黑曲霉抑制作用不明顯。Khan等[25]研究了酵母β-葡聚糖的抗菌活性,提出酵母β-葡聚糖的抑菌作用機理可能是由于低分子量的酵母β-D-葡聚糖進入細胞,擾亂微生物的新陳代謝,從而導致微生物細胞裂解死亡。該試驗采用濾紙片法及牛津杯法測定燕麥β-葡聚糖的抑菌活性,發現燕麥β-葡聚糖對4種供試菌有較弱抑菌作用,所得抑菌作用順序為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉。數據顯示燕麥β-葡聚糖對大腸埃希氏菌、枯草芽孢桿菌的抑制作用在濃度較高時才凸顯,這可能與燕麥β-葡聚糖作用液濃度太低或者成分純度有關,后期可考慮提高葡聚糖作用濃度及純度來進行抑菌探究。
2.5 燕麥多酚的抑菌效果
2.5.1 濾紙片法測定燕麥多酚的抑菌效果
濾紙片法測定燕麥多酚的抑菌效果見表3。

表3 濾紙片法測定燕麥多酚的抑菌效果Table 3 The antibacterial effects of oat polyphenols determined by filter paper method
表3中數據顯示,燕麥多酚提取物對4種供試菌均有一定抑制作用,抑菌作用順序為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉。其中對大腸埃希氏菌及枯草芽孢桿菌作用較明顯,在燕麥多酚提取物濃度為0.12 mg/mL和0.24 mg/mL時抑菌圈大小與空白對照組對比即表現出顯著差異。對產酯酵母及黑曲霉的抑菌效果較差,在濃度為0.36 mg/mL和0.48 mg/mL時其抑菌圈才表現出顯著差異,抑菌圈大小隨燕麥多酚濃度的增大而增大。
2.5.2 牛津杯法測定燕麥多酚的抑菌效果
采用牛津杯法測定燕麥多酚提取液對4種供試菌的抑菌活性,測定抑菌圈,得到數據見表4。

表4 牛津杯法測定燕麥多酚的抑菌效果Table 4 The antibacterial effects of oat polyphenols determined by Oxford cup method
表4中數據顯示燕麥多酚提取物對4種供試菌均有一定抑制作用,抑菌作用大小順序與濾紙片法測得一致,為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉。當燕麥多酚濃度為0.06 mg/mL時對大腸埃希氏菌和枯草芽孢桿菌的抑菌作用與空白相比就表現出極顯著差異,抑菌圈大小相對于濾紙片法也偏大。對產酯酵母和黑曲霉抑菌作用與空白相比在濃度為0.24 mg/mL和0.36 mg/mL才表現出顯著差異,抑菌圈大小也隨燕麥多酚濃度的增大而增大,與濾紙片法結論一致。
郝教敏等[26]研究發現燕麥多酚可抑制豬肉中微生物的快速繁殖,且添加量越大,抑菌效果越好。多酚具有的抑菌活性,是由于多酚能夠破壞菌體的細胞壁,使堿性磷酸酶滲出,增加細胞膜通透性,從而導致金屬離子、蛋白質的滲漏而使細胞代謝紊亂;另外多酚還可與蛋白質結合,使蛋白質變性或抑制酶活力進而破壞代謝過程[27]。數據顯示燕麥多酚提取物具有較強抑菌活性,且提取物對4種供試菌的抑菌圈大小隨著提取物濃度的增加而增大,抑菌作用順序為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉。
2.6 燕麥黃酮的抑菌效果
2.6.1 濾紙片法測定燕麥黃酮的抑菌效果
濾紙片法測定燕麥黃酮的抑菌效果見表5。

表5 濾紙片法測定燕麥黃酮的抑菌效果Table 5 The antibacterial effects of oat flavonoids determined by filter paper method
由表5數據可知,燕麥黃酮提取物對4種供試菌抑菌效果存在差異,其抑菌作用順序為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉。其中對大腸埃希氏菌和枯草芽孢桿菌的抑菌效果比較明顯,對大腸埃希氏菌的抑菌作用在提取物濃度為0.12 mg/mL時抑菌圈大小與空白對照即存在顯著差異,而對枯草芽孢桿菌在提取物濃度為0.36 mg/mL時抑菌作用才凸顯,對產酯酵母和黑曲霉得抑菌效果較弱,在濃度為0.48 mg/mL才表現出微弱抑菌效果,其整體抑菌作用仍隨著燕麥黃酮提取物濃度的增大而增強。
2.6.2 牛津杯法測定燕麥黃酮的抑菌效果
采用牛津杯法測定燕麥黃酮提取液對4種供試菌的抑菌活性,測定抑菌圈,得到數據見表6。

表6 牛津杯法測定燕麥黃酮的抑菌效果/mmTable 6 The Antibacterial effects of oat flavonoids determined by Oxford cup method/mm
表6中數據顯示燕麥黃酮提取物對4種供試菌均有抑制作用,抑菌作用大小順序與濾紙片法測得一致,為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉。當燕麥黃酮濃度分別為0.06 mg/mL和0.12 mg/mL時對大腸埃希氏菌和枯草芽孢桿菌的抑菌作用與空白相比就表現出極顯著差異,抑菌圈與濾紙片法相比較大。對產酯酵母和黑曲霉抑菌作用與空白相比在濃度為0.24 mg/mL才表現出顯著差異,抑菌圈大小也隨燕麥多酚濃度的增大而增大,與濾紙片法結論一致。
黃酮類化合物是多酚化合物中的一種,鐘珍等[28]發現菱角殼黃酮提取物對金黃色葡萄球菌和假單胞菌有較強的抑菌作用,對熱殺索絲菌相對較弱,對大腸桿菌、乳酸菌及酵母菌均無抑菌作用。本試驗采用濾紙片法及牛津杯法探究燕麥黃酮的抑菌效果,數據顯示燕麥黃酮對大腸埃希氏菌、枯草芽孢桿菌、產酯酵母以及黑曲霉4種供試菌均有抑制作用,作用大小順序為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉,且其抑制作用隨其濃度增大而增強。
3 結論
鑒于多糖組成及結構的相似性,試驗采用濾紙片法和牛津杯法對燕麥β-葡聚糖對大腸埃希氏菌、枯草芽孢桿菌、產酯酵母以及黑曲霉4種供試菌的抑菌效果進行探索。本文利用濾紙片法和牛津杯法對燕麥β-葡聚糖、多酚及黃酮對大腸埃希氏菌、枯草芽孢桿菌、產酯酵母及黑曲霉的抑菌活性進行探索。研究結果表明燕麥中不同提取物對4種供試菌的抑菌作用有所差別,其中燕麥β-葡聚糖對4種供試菌的抑菌作用較弱,燕麥多酚及黃酮提取物的抑菌活性相對較強,且相同作用濃度條件下的燕麥多酚提取物的抑菌作用最強,黃酮次之,β-葡聚糖最差,抑菌作用順序為大腸埃希氏菌>枯草芽孢桿菌>產酯酵母>黑曲霉,但3種提取物對4種供試菌的抑菌圈大小都隨著提取物濃度的增加而增大。目前對燕麥多酚、黃酮及β-葡聚糖的抑菌相關研究較少,研究顯示燕麥多酚、黃酮及β-葡聚糖存在一定抑菌活性,這表明燕麥β-葡聚糖、多酚及黃酮作為天然防腐劑在食品工業中具有潛在應用前景,但對其抑菌機理還有待進一步研究。

