微流控芯片技術在血細胞變形和流動性分析研究中的應用進展
戚曉菁, 李學進
(浙江大學航空航天學院工程力學系 流體工程研究所, 杭州 310027)
0 引 言
微流控芯片(Microfluidics)又稱芯片實驗室(Lab-on-a-chip),是把生物、化學及醫學等領域涉及的樣品制備、反應、分離、檢測等多種技術單元靈活組合、規模集成并完成操控分析的一種微技術平臺[1]。由于微流控芯片具有小型化、微量化、定量化及集成化等諸多優勢,因此已被廣泛應用于生物醫學和環境科學等研究領域[2-4]。特別地,由于微流控芯片具有設計靈活的特點,通過多通道陣列組合可提供復雜的微通道網絡結構(如直線型、彎曲蛇形、多邊形、折疊形),可用于模擬生理和病理環境復雜的微血管環境[5-6]。因此,利用微流控芯片技術研究健康與疾病中血細胞在微血管內的流動和變形性能引起了研究人員的廣泛關注。
血細胞又稱“血球”,是存在于血液中的細胞,能隨血液的流動遍及全身[7]。血細胞通常分為3類:紅細胞、白細胞和血小板。紅細胞呈雙凹圓盤狀,直徑約為7~8 μm,有一定的彈性和可塑性,主要功能是運送氧;白細胞體積比紅細胞大,能作變形運動,具有機體防御和免疫調節功能;血小板呈圓盤形,當受到機械或化學刺激時,則伸出突起,呈不規則形,其主要功能是凝血和止血以及修補破損的血管。機體的生理和病理變化往往會引起血細胞數量或質量(功能)的改變,進而引起貧血、發熱、感染、出血和血管栓塞等臨床癥狀。例如,在微血管系統中,紅細胞在組織的氧合作用中發揮著重要作用。當紅細胞流過狹窄毛細血管時,由于存在剪切應力,紅細胞會在毛細血管中發生壓縮變形,進而促進紅細胞與周邊組織的氧氣交換[8]。而在病理狀態下,紅細胞變形性能的下降阻礙了細胞通過微血管的轉運。
血液是一種具有相當黏性的流體,其在血管內的流動行為有著明顯的黏性流動特性[9]:在靠近血管壁處血液流動滿足斯托克斯流特征,而在遠離血管壁的區域則又呈現明顯的泊肅葉流特征(圖1(a))。因此,血液在血管內流動時,紅細胞在慣性升力和細胞-血管壁相互作用下會發生變形并遷移至血管中間區域。我們知道,紅細胞幾乎占據了40%~45%的血液體積,因此,血管中紅細胞的遷移及運動行為主導了血流動力學并致使白細胞和血小板向血管壁附近區域遷移(圖1(b))。利用血流這一特殊的動力學特征,人們發展了多種微流控芯片裝置,用于分離和采集特定類型的血細胞,并在臨床診斷和個性化治療等方面發揮了重要的作用(圖1(c))。本文將結合國內外最新研究進展,以健康和疾病中的血細胞為例,從單細胞變形、流動、黏附等性能表征及多細胞分離和遷移動力學等方面簡單歸納目前微流控芯片技術在血細胞力學分析和表征方面的應用進展。

圖1 血細胞在血管內流動的動力學特征及微流控仿生模型設計
1 微流控芯片在血細胞變形和流動性能研究中的應用
1.1 血細胞在毛細微管道內的流動和變形
需氧代謝是人體維持生命活動的基本條件,血液的運輸功能主要依靠紅細胞來完成。在血液循環過程中(特別是在微循環過程中),紅細胞必須具有良好的變形性能才能順利地通過口徑比它小的毛細血管網和血竇孔隙[7]。然而,在病理條件下,紅細胞變形性能降低,高切黏度增高,從而增加了血液的外周阻力,影響到血液循環以及組織和器官的血液供應。因此,研究紅細胞的變形性能,對理解基本的血液循環及血液疾病的臨床表現均具有重要意義。基于此,人們發展了單通道和多通道等不同類型的微流控芯片裝置,用于探索紅細胞在毛細管內的流動行為和變形性能。單通道微流控芯片指在一個芯片上僅含有一個微通道,結構相對簡單,可準確檢測單個血細胞在毛細管道內的流動及變形性能;多通道微流控芯片也稱為集成微通道芯片,其在一塊芯片上包含有多個微通道,這樣便可以在同一芯片上同時并行處理多個樣品,具有高通量和高靈敏度的特點,從而提高了微流控芯片通量及檢測效率。此外,多通道微流控芯片的多維網格結構可模擬復雜的血管分支網絡和血流微循環環境,可用來研究微血管堵塞及血栓形成過程。由于多通道芯片結構復雜、控制參量多,因此對實驗操作及控制條件(如壓力梯度、來流速度等)提出了更嚴格的要求。本文重點綜述這方面的一些研究工作。
1.1.1 單通道微流控芯片
單通道微流控芯片可在高靈敏度下研究紅細胞在毛細血管內的流動,并直接觀察到細胞、亞細胞水平的動態和不連續過程,從而幫助人們更好地認識幾種紅細胞疾病。例如,李巨及其合作者設計了一種單通道微流控芯片來研究紅細胞隨毛細血流的流動特征(圖2)[10]。他們發現當紅細胞擠入狹窄的毛細管道時(微通道尺寸只有4 μm),細胞會發生很大的變形(圖2(c)),但一旦穿過后則很快恢復其最初的圓盤狀結構(圖2(d))。同時,他們基于亞細胞層面的紅細胞模型結果分析,認為細胞骨架重組可能是這種大變形的原因。Quinn等利用類似的微流控芯片裝置,對紅細胞在毛細血管內的流動規律進行了定量探索[11]。通過調節通道出入口壓力梯度控制流體流速,他們分析了不同壓降下紅細胞通過毛細管的流動速度,發現細胞流動速度隨壓力梯度近乎呈線性變化。由此可見,基于單細胞微流控芯片的實驗和亞細胞層面的模型分析可以幫助人們理解紅細胞在毛細血管內的流動規律。
人們也通過電學測量的手段研究毛細管內流動紅細胞的變形性能[12-13]。我們知道,流過毛細管的紅細胞經歷了瞬時形狀演變,而其特征形狀的恢復時間,可以作為紅細胞變形性能的標志之一。在恒定剪切力下,紅細胞流過與其自身尺寸相近的毛細管時,會發生擠壓變形。通過實驗發現,紅細胞變形的嚴重程度與沿微流體通道施加的電流的信號強度成比例[12]。基于此,人們可以通過紅細胞的特征伸長指數推斷其變形性能。
紅細胞血液病是血液系統發病率較高的疾病。近年來的研究表明紅細胞的膜結構及變形性能與很多血液疾病的發生和發展都密切相關。目前,人們通過微流控芯片可測定病變紅細胞的變形性能,從而獲得有關血液疾病臨床狀態以及藥物療效的一些關鍵信息[14-16]。例如,Shelby等設計了一種單通道微流控芯片來測定惡性瘧原蟲感染的紅細胞(后文簡稱“瘧疾感染紅細胞”)的變形性能變化[14]。他們從患者血液中獲取不同感染程度的紅細胞,并將其放在黏性流體中稀釋,然后使其通過不同尺寸的狹窄矩形毛細微管道(圖3)。這些感染的紅細胞有不同的形狀和剛柔性,進而影響其在微通道內的流動行為。他們發現感染初期的環狀體(Ring)紅細胞可正常通過毛細微管道(圖3(a1)~(a4)),而處于滋養體(Trophozoite)階段的紅細胞可通過較寬尺寸(6和8 μm)的微管道,但無法順利通過更狹窄(2和4 μm)的微管道。但是,處在裂殖體(Schizont)階段的紅細胞變形性能明顯減弱,僅能通過8 μm的毛細管(圖3(b1)),而無法通過6 μm及以下的毛細管(圖3(b2)~(b4))。
Guo等設計了一種輕便的微流控芯片裝置來研究瘧疾感染紅細胞變形性能的變化[15]。這種微流控裝置借助一系列緊壓的“漏斗形收縮”使得紅細胞變形通過(圖4(a)~(b)),然后根據測定的推動細胞流過“漏斗形收縮”的壓力大小分析感染紅細胞的變形性能。結果表明,在惡性瘧原蟲感染紅細胞的各個階段實時精確測定感染紅細胞的變形性能是可能的(圖4(c))。
1.1.2 多通道微流控芯片
利用微流控芯片裝置進行血細胞性能分析時,由于單個血細胞的尺寸很小,因此往往只能對微量的血液樣本進行檢測。在多數情況下,感染或者病變血細胞在微量血液樣本中含量極少。因此,如何從微量血樣中對含量極少的感染紅細胞進行分析檢測是一個亟待解決的問題。為此,人們設計了多通道微流控芯片,可在高通量和高靈敏度下對血細胞進行直接的力學分析和變形性能測量。同時,微流控芯片的多維網絡結構可連通成網, 可以模擬復雜的幾何形態和更逼真的血流微循環環境。目前,多通道微流控芯片已被用于研究健康與疾病中血細胞的變形、聚集及微血栓形成等方面。根據本課題組及合作者在此領域的實驗積累,介紹以下3個方面的研究進展。
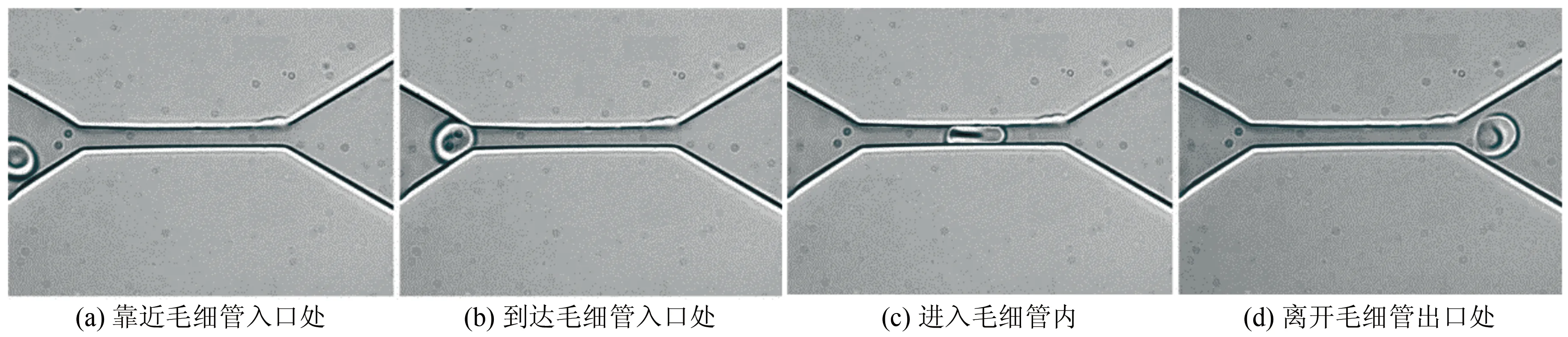
圖2 基于單通道微流控裝置研究健康紅細胞在毛細管內的流動和變形[10]。(a)~(d)顯示紅細胞在流過毛細管不同區域時的變形
Fig.2Invitromicrofluidic model for investigating the translocation process of a healthy human red blood cell (RBC) through a microcapillary[10]. The series of images (a)~(d) show the shape of the RBC as it is squeezed through the narrow microchannel
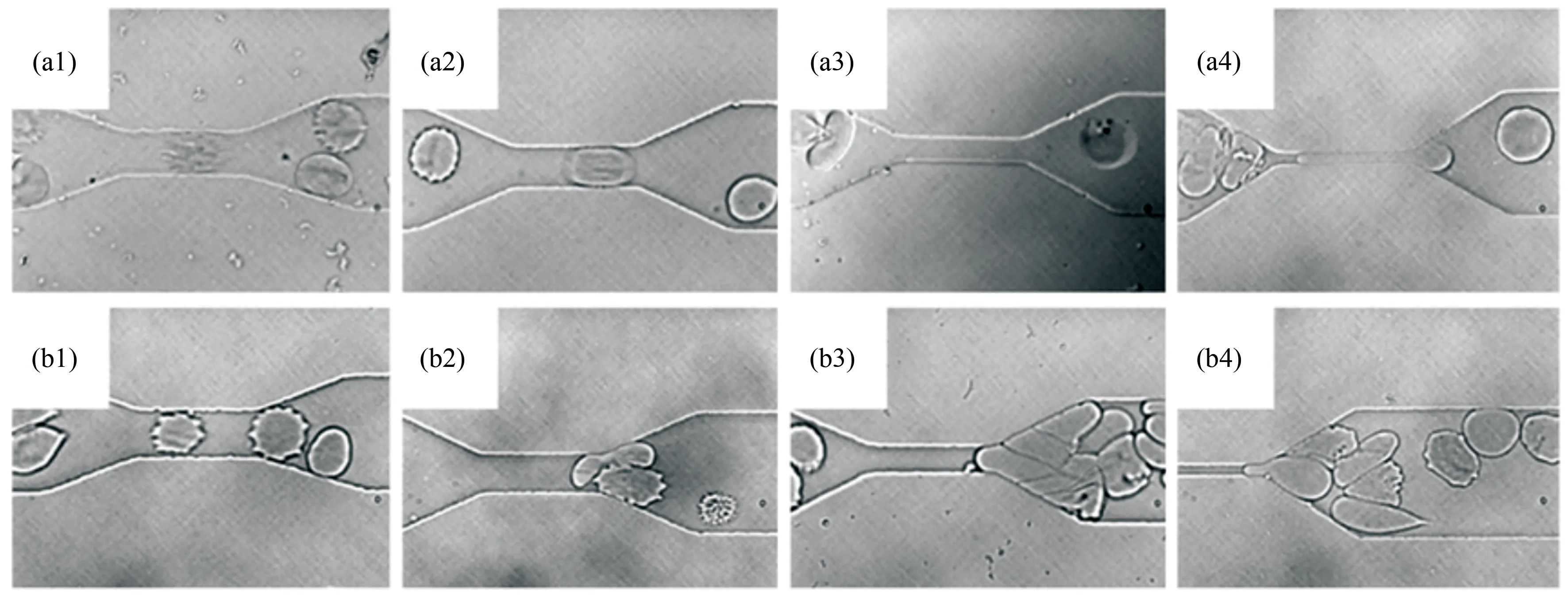
圖3 基于單通道微流控裝置研究瘧疾感染紅細胞在不同尺寸的毛細管內的流動及堵塞行為[14]。自左至右毛細管的寬度分別為8、6、4及2 μm。感染初期的環狀體紅細胞可順利通過毛細管道((a1)~(a4));感染末期處于裂殖體階段的紅細胞僅能通過8 μm的毛細管道(b1),但無法通過6 μm及以下的毛細管并導致微通道的堵塞((b2)~(b4))
Fig.3 Micrographs of malaria-infected RBCs traversal across microfluidic channels. Ring-stage infected RBCs can pass through all constricted microchannels ((a1)~(a4)); schizont-stage infected RBCs block all but the 8 μm microchannel ((b1)~(b4))
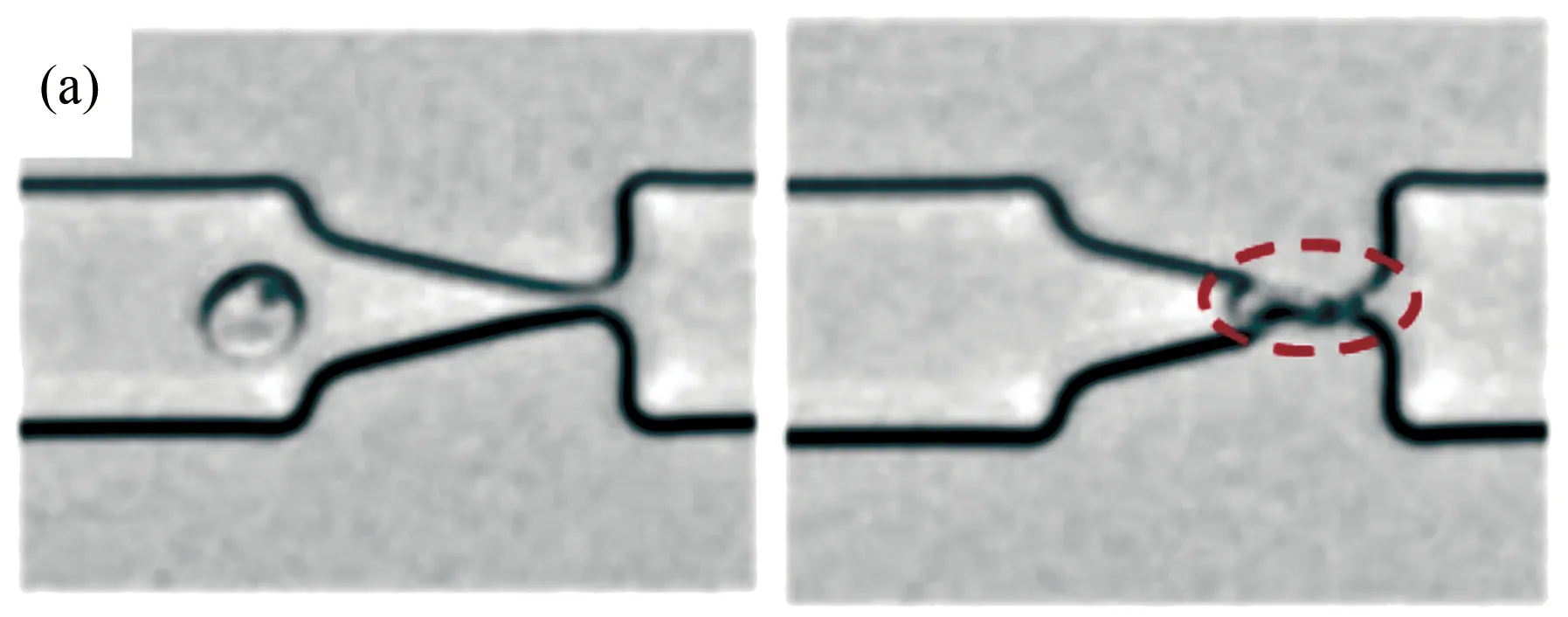

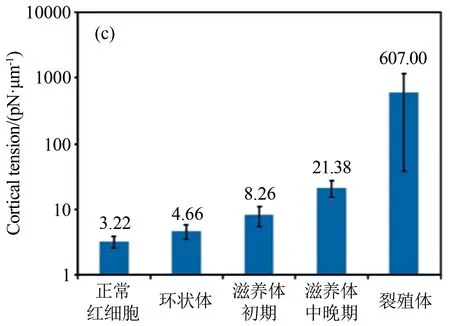
圖4 基于單通道“漏斗形收縮”微流控裝置研究瘧疾感染紅細胞的流動及變形行為[15]。(a) 感染初期的環狀體紅細胞在較小的壓力梯度下可通過漏斗形收縮微管道;(b) 感染末期處于裂殖體階段的紅細胞則需要較大的壓力梯度才能通過微細管;(c) 基于實驗結果統計得到的不同感染階段的紅細胞膜皮質張力
Fig.4 Analysis of the flow behavior and deformability of malaria-infected RBCs in microfluidic channels with multiple funnel-shaped constrictions. (a) A ring-stage infected RBC could transit rapidly through the funnel constriction at a low pressure; (b) A schizont-stage infected RBC, which is hardly deformed, requires a high pressure to drive through the constriction; (c) Histogram of the measured cortical tension of uninfected and malaria-infected RBCs
(1) 基于多通道微流控裝置研究瘧疾感染紅細胞在毛細管內的流動行為。Bow等設計了一種多通道微流控裝置,可從僅含有極少量瘧疾感染紅細胞的血樣中對感染紅細胞進行直接的變形性能檢測[17]。他們設計的微流控裝置上有多組并排的、寬度僅為3 μm的微管道陣列(圖5(a))。當紅細胞在微流道內流動時,必須通過變形以流過微管道陣列(圖5(b),箭頭所示)。相比健康紅細胞而言,瘧疾感染紅細胞更難擠入狹窄微通道,且在微流道內流動速度更慢,說明受感染的紅細胞變形性能有明顯的降低。同時,他們發現微管道入口的形狀(收縮式入口及發散式入口)也會對紅細胞的流動行為有明顯的影響。相比于發散式入口微管道結果,受感染的紅細胞更容易進入收縮式入口微管道,且其在微流道內的流速也有明顯的增加。因此,借助該微流控芯片裝置可以更好地分析受感染的紅細胞的流動行為,并幫助醫學工作者更好地診斷疾病。

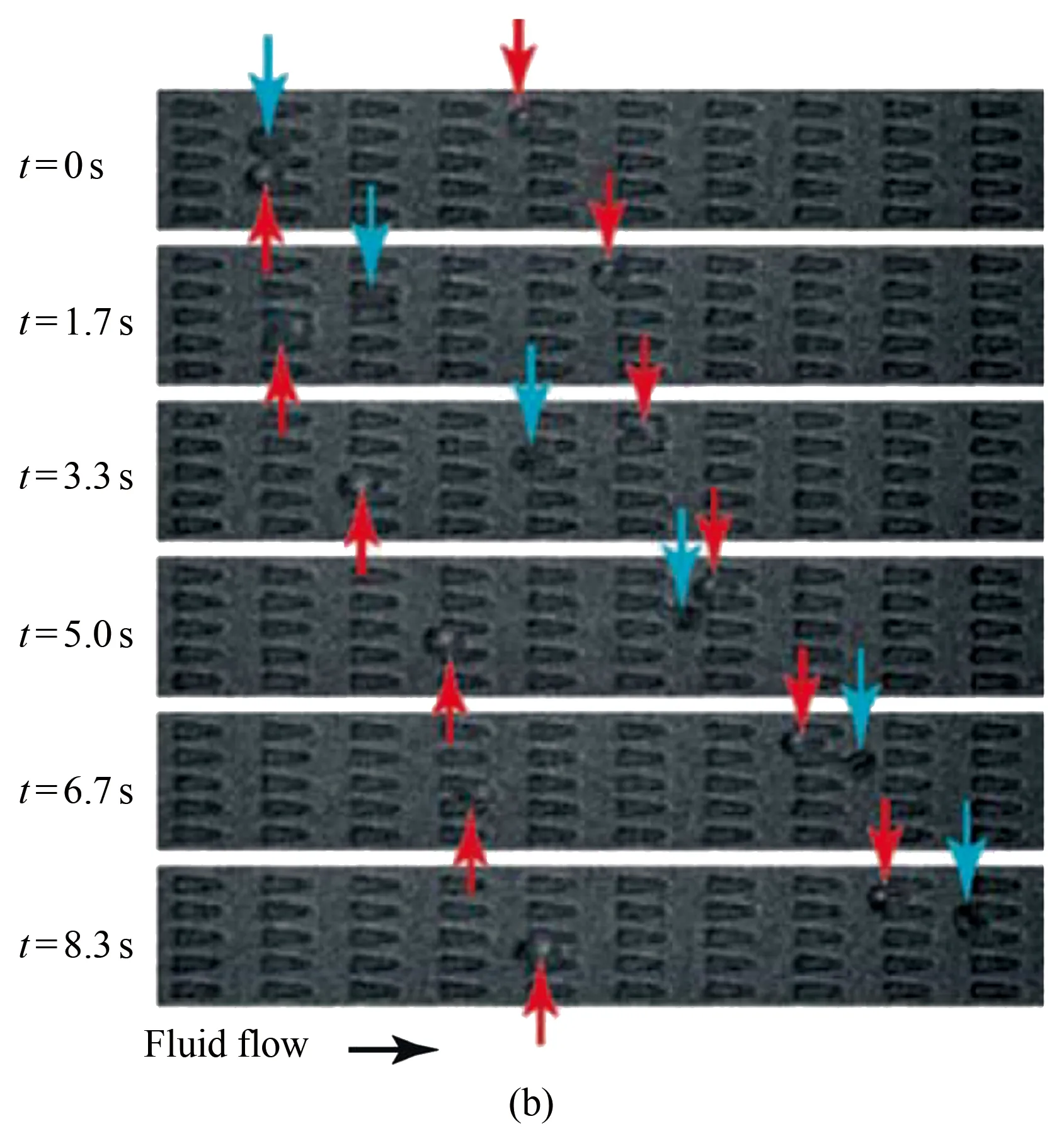
圖5 基于多通道微流控裝置研究受瘧疾感染紅細胞在毛細管內的流動行為[17]。(a) 微流道裝置示意圖。微流道內有多組并排的寬度僅為3 μm的微管道陣列,紅細胞流過微管道陣列時需變形才能通過; (b) 通過實驗獲得的健康紅細胞(藍色箭頭所示)和瘧疾感染紅細胞(紅色箭頭所示)在多通道毛細管內的流動現象
Fig.5 Microfluidic platform for studying the flow behavior of malaria-infected RBCs in the microchannel[17]. (a) Schematic diagram of the device design; the spacing between pillars is 3 μm and the depth of the device is 4.2 μm; (b) Micrographs of uninfected (blue arrows) and malaria-infected (red arrows) RBCs in the microchannel
(2) 基于多通道微流控裝置研究鐮狀細胞貧血癥下紅細胞的鐮變過程及其對細胞變形和流動的影響。鐮狀細胞貧血癥是一種常見的遺傳性血液疾病,也是人類發現的第一個分子疾病[19]。其臨床表現為慢性溶血性貧血、易感染和再發性疼痛危象以致局部缺血從而導致器官組織損害[20]。為了探索紅細胞的鐮變過程及其導致的毛細血管堵塞現象,研究人員需要對紅細胞所處微環境的氧氣濃度進行調控并模擬鐮變紅細胞在毛細血管內的流動和堵塞情況。然而,從實驗角度來看,利用常規實驗儀器實現這樣的細胞微環境有較高難度。Du等利用互聯多通道微流控裝置克服了這一局限[18, 21]。該裝置允許研究人員調控氧氣水平和脫氧程度,進而控制紅細胞的鐮變過程并分析紅細胞從發生鐮變到誘發鐮狀細胞危象的整個過程(圖6(a)和(c))。他們發現,當氧氣濃度非常低或處于缺氧狀態時,紅細胞發生鐮變,不但在外形上由圓盤狀變成鐮刀狀(圖6(b)),其變形性能也有明顯異常:鐮狀紅細胞變形性能差,進而在微管道陣列中發生堵塞(圖6(d))。同時,他們發現紅細胞鐮變的初期是可逆的,給予氧可逆轉細胞鐮變過程。所以,一旦把鐮變紅細胞置于有氧環境時,紅細胞可迅速恢復圓盤狀結構且可通過變形流過微管道[21]。
此外,鐮變紅細胞還可使血液黏滯性增加,血流緩慢,加之變形性能差,易堵塞毛細血管和小靜脈血管,從而引起局部缺氧和炎癥反應導致相應部位產生疼痛危象[20]。為了探索鐮變紅細胞如何與血管相互作用引發血管栓塞,Papageorgiou等人利用互聯多通道微流控芯片裝置研究了鐮狀紅細胞黏附毛細管道壁的動力學過程[22-23]。實驗結果表明,鐮變初期的紅細胞在毛細管中可顯著地黏附于管道壁,缺氧會進一步增強這些紅細胞的黏附,但是對鐮變末期的紅細胞無明顯影響;同時,他們發現鐮狀網織紅細胞表現出獨特的黏附動力學行為:鐮狀網織紅細胞可以從細胞表面向外生長的鐮狀纖維處產生新的黏附位點,進而促進細胞黏附。該互聯多通道微流體模型的實驗結果證實了鐮變初期的紅細胞在微環境中導致血管栓塞形成的重要作用。該芯片的設計接近體內微血管通道,可作為一種易于使用的體外模型,用來探索毛細微通道中病變紅細胞的黏附及流動行為。
(3) 血液疾病微血管阻塞及血栓模型。微血栓是微循環的血管中由于血細胞或纖維蛋白互相粘結而成的一種均質無結構的微小血栓。由于微血栓尺寸小,所以在一般的病理檢查(包括X光、B超、心電圖等)時難以發現,其在體內的形成過程更難以檢測。近年來,人們借助微流控芯片技術嘗試研究微血管阻塞及微血栓形成過程[5, 24]。例如,Tsai等設計了一種微流控器件來模擬變狹窄的小動脈血管,可以在生理和病理血流下分析微血管堵塞及血栓形成的過程[25]。該微流控器件內含有多組互通且分叉的微管道(最小尺寸為30 μm),以模擬毛細血管后小靜脈和動脈形成的復雜血管網絡(圖7)。利用該微流控芯片可模擬包括血液-內皮細胞黏附、多細胞聚集等力學因素導致的血流動力學環境的變化,以及模擬包含腫瘤壞死因子a (TNF-a)、突觸融合蛋白2 (STX2)等在內的多種生化因素促使微血管血栓形成的過程。借助該微流控芯片,他們還定量研究了羥基脲(Hydroxyurea)藥物對鐮狀細胞貧血癥引發的微血管堵塞的影響,發現該藥物可降低微血管栓塞的幾率,從而為解釋該藥在臨床上的藥效作用提供了細胞水平的依據。該研究表明,基于微流控芯片的微血管堵塞及血栓模型是連接體外實驗和體內實驗的一座橋梁,為血液疾病微血管栓塞的病理研究及相關藥物篩選提供了條件。

圖6 基于多通道微流控裝置研究鐮狀細胞貧血癥下紅細胞的流動和變形性能[18]。(a) 通過調控氧氣水平和脫氧程度控制紅細胞的鐮變和可逆轉鐮變過程;(b) 當處于缺氧狀態時,紅細胞發生鐮變后導致其形狀發生變化(黃色箭頭所示);(c) 微流道裝置示意圖。微流道內有多組并排的寬度僅為4 μm的微通道陣列,紅細胞需變形才能通過;(d) 在有氧(上圖)和脫氧條件(下圖)下,觀察紅細胞在毛細管道內的流動及堵塞現象
Fig.6 Microfluidic platform for studying sickle cell behavior under transient hypoxic conditions[18]. (a) Schematic diagram of microfluidic device; (b) Visual determination of cell sickling events from morphological changes in RBC membrane; (c) Schematic diagram of microfluidic device; the microfluidic channel contains periodic obstacles forming 15-μm-long, 4-μm-wide and 5-μm-high microgates; (d) Individual RBC behavior under oxygenated (Oxy, upper) and deoxygenated (DeOxy, lower) states[18]
圖7 基于多通道微流控裝置模擬微血管堵塞及血栓形成過程[25]。(a) 微流控芯片裝置圖;(b) 微流控芯片中多通路微管道網絡示意圖,其中最中間一排的微管道寬度只有30 μm;(c) 微流控芯片上“內皮細胞化”微血管分叉結構;(d) 血細胞-內皮細胞黏附及多細胞聚集導致的微血管堵塞現象
Fig.7Invitromicrofluidic microvasculature model for modeling of the microvascular occlusion and thrombosis that occur in hematologic disease[25]. (a)~(b) Illustration of the device design; (c) Characterization of the “endothelialized” microvasculature on the chip; (d) The observation of microchannel occlusion due to a combination of increased adhesion and cell stiffness
1.2 血細胞分離和采集
血細胞分離和采集是從全血中把某種特定類型的血細胞(如紅細胞、白細胞和血小板等)分離、純化并進行采集,在生物學和醫學研究以及血液疾病臨床診斷和治療中具有非常重要的作用[26-27]。通過微流控芯片裝置可以對少量血樣快速、高效地檢測并分離出不同種類的血細胞。目前,以微流控芯片為研究平臺的血細胞分離采集方法主要有2種:(1) 以細胞微結構和物理/力學特性為基礎的細胞被動分離[28-29];(2) 通過在微流控通道中施加外加力場驅動細胞分離[30-31]。
1.2.1 以血細胞微結構和物理/力學特性為基礎的細胞分離
流體流動時,在黏彈性效應和慣性效應作用下,大顆粒將向靠近側壁的橫向位置遷移。類似地,當血液在血管中流動時,尺寸較小的柔性紅細胞將遷移至血管中間區域,而尺寸較大的剛性白細胞及腫瘤細胞將向血管壁周圍遷移。利用這一特殊的血流動力學特征,一些課題組設計了微流控芯片用于分離并采集不同類型的血細胞。例如, Liu等基于細胞物理特性和流體黏彈性效應設計了一種微流控芯片,不同大小的細胞在微流道內流動至不同的通道:紅細胞匯聚在中間通道,而腫瘤細胞在兩側通道內富集[28],成功實現了循環腫瘤細胞和紅細胞的完全分離。此外,他們通過改變作用于囊泡的流體力,成功實現了外泌體從胞外囊泡的分離采集[32]。類似地,Zhang等利用該方法實現了紅細胞與血漿的加速分離[33]。Hou等設計了一種可以控制液體流動的微流控芯片,通過不同的管道設計與流速調節改變微流道內的流體力學特征,進而利用血細胞在大小、形狀及剛柔力學特性的不同,從微量血液樣品中分離出了特定的血細胞,包括瘧疾感染的紅細胞[34]、循環腫瘤細胞[35]及不同種類的白細胞[36-37],最終達到了檢測的目的。


圖8 基于慣性效應和黏彈性效應設計的微流控裝置用于特定類型血細胞的分離采集[34-35]。(a) 微流道內瘧疾感染紅細胞和健康紅細胞的分離[34];(b) 微流道內循環腫瘤細胞、白細胞和紅細胞的分離[35]
Fig.8 Schematic illustration of cell separation in microfluidic channels based on cell size and deformability[34-35]. (a) Separation of malaria-infected RBCs and uninfected RBCs in microfluidic channel[34];(b) Separation of RBCs, white blood cells (WBCs) and tumor cells in microfluidic channel[35]
1.2.2 通過在微流控通道中施加外加力場驅動的細胞分離
通過在微流控通道中施加外加力場驅動細胞分離的方式主要包括介電電泳力驅動、磁場作用力驅動、超聲波驅動等3種。
(1) 介電電泳力驅動。介電電泳技術描述的是位于非均勻電場的中性微粒由于介電極化的作用而產生的平移運動。當處于非均勻電場中時,血細胞產生極化現象,其表面會產生偶極矩,進而在介電電泳力的作用下,向更強的電場強度方向移動(陽性介電電泳)或者更弱的電場強度方向移動(陰性介電電泳)。由于血細胞所受介電電泳力的大小取決于血細胞的大小和形狀、以及懸浮媒介的介電性質和黏度特性等因素,因此在微流控芯片上進行介電電泳可實現血細胞的分離[38-39]。介電電泳細胞分離技術具有無需標記、無需表面修飾和特異性高的特點,因此, 以微流控芯片介電電泳為基礎的分離采集技術在血細胞分離領域已被廣泛應用。例如,Nascimento等利用微流控介電電泳實現了受寄生蟲感染的紅細胞與健康紅細胞的分離采集[40]。當紅細胞受到寄生蟲感染后,其細胞膜微結構和表面抗原會發生一定程度的變化,同時,細胞膜通透性也會有一定程度的增強,導致感染紅細胞和健康紅細胞在介電場中所受介電電泳力的方向和大小都有不同,進而遷移至不同的微通道,實現分離采集的目的。
(2) 磁場作用力驅動。對目標血細胞用微型磁珠進行磁性標記,被磁性標記的血細胞流經磁場區域時,磁場作用力使目標血細胞偏離原來的運動軌道。不同大小和磁化率的血細胞流經梯度磁場時所受磁場作用力不同從而實現分離采集。例如,Karabacak等利用慣性效應及磁場效應設計了一種微流控芯片裝置,成功實現了對純循環腫瘤細胞的分離富集[30]。這套微流控裝置前半部分的微通道內布滿了傾斜的微柱陣列,尺寸小的紅細胞/血小板和尺寸大的白細胞/癌細胞在微柱陣列中受到慣性升力不同而分離至不同的微通道(圖9(a))。接下來,白細胞和癌細胞的懸浮液經過中間微通道流經磁場區域,在磁場作用力和流體驅動力的共同驅動下流向不同的收集通道,從而將低濃度的癌細胞從白細胞中分離出來(圖9(a))。Zhao等利用磁流體對不同類型細胞的作用力不同設計了2種微流控裝置(圖9(b)),實現了循環腫瘤細胞和白細胞/紅細胞的分離[41]。另外,利用磁流體方法可測量紅細胞在磁性介質中的懸浮情況,進而評估紅細胞的變形性能。例如,Tasoglu等將紅細胞浸入溶液里,然后注入夾在2個磁體中間的毛細管中[42]。磁力從毛細管底部到頂部垂直減小,因此紅細胞的最終平衡位置由細胞的密度確定。這種方法可以區分并分離健康和被感染的紅細胞。

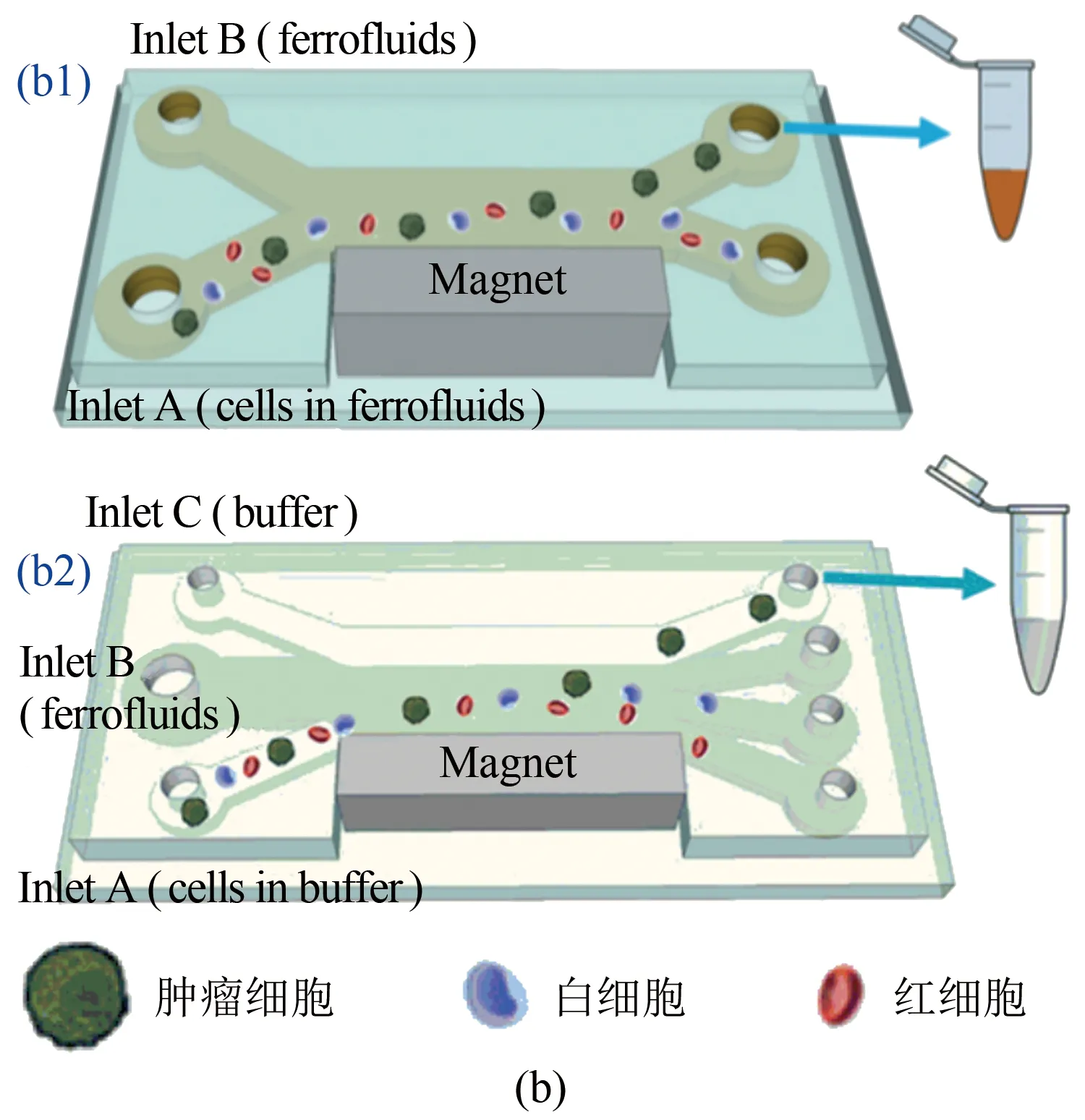
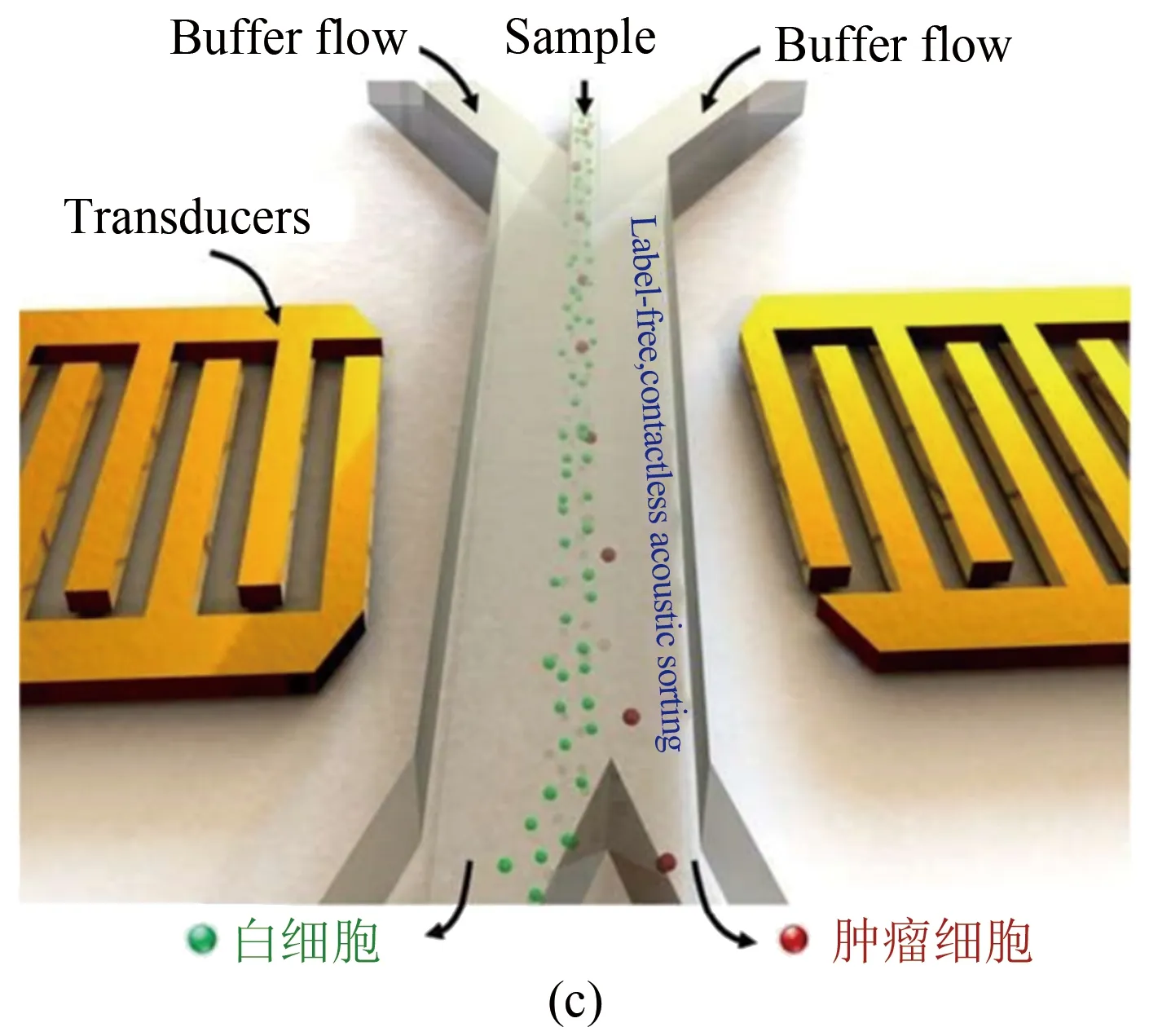

圖9 微流控通道中細胞分離示意圖。(a)~(b) 基于慣性升力和磁場效應從微量血液樣品中實現腫瘤細胞和血細胞的分離采集[30, 41];(c)~(d) 通過超聲波微流控裝置從血細胞混合液中分離腫瘤細胞[43-45]
Fig 9 Schematic illustration of cell separation in microfluidic channel. (a)~(b) Separation of blood cells and tumor cells in ferrofluids[30, 41];(c)~(d) acoustic separation of tumor cells from blood samples[43-45]
(3) 超聲波驅動。對通過微通道的流體施加一定角度的聲波,其產生的壓力可推動懸浮在液體中的顆粒移動。與正常的血細胞相比,聲波對癌細胞的推力更大,故可將腫瘤細胞推到單獨的微通道。例如,Ding等人設計了一個外加表面聲波的微流控裝置實現了循環腫瘤細胞的分離捕獲[44]。這套微流控裝置的兩端裝有2個產生聲波的傳感器(圖9(c))。當兩股聲波相遇時,產生的壓力能推動細胞移動。他們利用此方法從乳腺癌患者的血液中成功檢測到極為罕見的腫瘤細胞[45]。Collins等使用高頻聚焦表面聲波垂直作用于流體,進而推動流體流動并在微通道中產生流體渦流[43]。他們利用流體渦流形成的渦旋實現了多種不同尺寸顆粒的分離捕獲,并從紅細胞和癌細胞混合液中成功捕獲了乳腺癌細胞(圖9(d))。基于微流控超聲波驅動的細胞分選具有無需配體、無需標記和生物兼容的特點,同時,由于每個細胞僅在不到1 s的時間內經歷聲波,因此,與其他細胞分離捕獲技術相比,該技術顯得更為溫和,對分離血細胞損傷的風險大大降低。
1.3 血細胞機械疲勞損傷
軟物質材料會在長期的循環應變作用下發生損傷和斷裂,也就是機械疲勞。類似的,在生物細胞中,例如紅細胞,在循環應力的作用下也會產生機械疲勞。Du及其合作者基于介電電泳技術設計了一種包含振幅調制電極的微流控芯片,研究了循環機械應變下單個紅細胞的機械疲勞損傷行為[46-47]。實驗結果表明,在一定的循環載荷下,紅細胞會產生機械疲勞效應;同時,在相同的累積加載時間和相同的最大載荷下,動態循環載荷比靜態載荷對紅細胞膜的損傷更大[48]。此外,他們發現不同的載荷形態(如方波載荷、擬正弦波載荷等)對紅細胞膜損傷的影響程度也有所不同:與擬正弦波載荷實驗結果相比,循環方波載荷對紅細胞膜機械變形影響更為顯著。他們還發現機械疲勞效應會導致磁滯和能量耗散,持續的機械疲勞對血細胞的結構完整性和生物學功能有著不利影響。這樣的疲勞測試平臺可用來定量表征血液循環過程中單個血細胞累積的細胞膜損傷,幫助人們了解血細胞的應力波動對其生物力學特性的影響。
2 總結及展望
紅細胞變形性能對血流性質有重大影響,它是決定高切率下血液黏率的關鍵因素。許多血液病變是由于紅細胞變形性能低下導致的。例如,瘧疾感染紅細胞和貧血癥下鐮狀紅細胞的變形性能會減弱,不利于紅細胞通過狹窄毛細血管[49-50];遺傳性球形紅細胞增多癥下球形紅細胞由于體表比增加進而使紅細胞很難變形[51-52]。目前,人們已發展一些實驗技術來研究病變紅細胞的變形性能及生物力學響應,然而,在單細胞水平研究紅細胞的變形和流動特征仍面臨很大挑戰。近些年來迅速發展的微流控芯片技術憑借其特有的優勢為健康與疾病中的紅細胞力學性能研究提供了一個很好的平臺。隨著微流控芯片技術的不斷發展,如何模擬更復雜的幾何形態和更逼真的血流微環境,把血細胞形狀的動態變化和各種疾病的病理變化及臨床表現聯系起來,將是未來工作的一個重點和難點。
同時,基于微流控芯片技術的器官芯片(Organ-on-a-chip)近幾年來發展迅速,已經實現了體外模擬多種活體細胞、組織及器官微環境[53]。為適應人類器官及血管的復雜性,未來的研究需要建立更加復雜的多器官微流控芯片(Multi-organ-on-a-chip)系統,將不同器官芯片模型應用到類似人體的血液循環環境中。目前熱門的3D生物打印技術具有精確的控制能力和個性化特點,使得“定制”人體組織器官成為可能。通過在芯片上打印特定帶血管的器官,可以更好地模擬細胞、血管及組織微環境并建立患者特異化(Patient-Specific)的血管及器官模型,進而從細胞-組織-器官等不同層面多尺度探索相關疾病的發生機制,并進行更加系統的藥物毒性檢測和藥效評估。

