阿侖膦酸鈉通過調控NF-κB和MAPK信號通路改善大鼠骨質疏松的發展
沈云玲,魏 靜,徐小宇
0 引言
隨著人口老齡化的增長,骨質疏松癥(Osteoporosis,OP)已成為重要的公共衛生問題,影響著數百萬人的日常活動和生活質量,為患者帶來了嚴重的經濟負擔[1]。因此,深入研究骨質疏松癥的發生機制和防治措施對于提高患者的生活質量和降低死亡率具有重要意義。
骨重塑是調節骨結構和功能的主要代謝過程,主要與破骨細胞介導的骨吸收過程和成骨細胞介導的骨形成過程相關[2]。異常情況下,破骨細胞介導的骨吸收活性增強將導致骨代謝性疾病的發生,如骨質疏松癥[3]。核因子(NF)-κB作為一種重要的細胞內轉錄因子,其對于成骨細胞和破骨細胞的分化形成具有重要意義[4]。除此之外,絲裂原活化蛋白激酶(MAPK)信號通路是細胞內的重要信號轉導通路,參與介導細胞的生長、分化及發育等多種過程,其通過調控成骨細胞和破骨細胞的分化及增殖參與骨質疏松癥的發生和發展[5]。阿侖膦酸鈉是一種骨吸收抑制劑,其能夠通過誘導破骨細胞凋亡抑制骨吸收過程,廣泛應用于骨質疏松癥的治療,但是其抗骨質疏松癥的作用機制尚不明確[6]。因此,本研究采用骨質疏松大鼠模型探討了阿侖膦酸鈉對骨質疏松癥的作用及相關分子機制。
1 材料和方法
1.1 實驗材料 p-p65、p65、p-p50、p50、p-JNK、p-p38、p-ERK及GAPDH抗體(CST,美國);HRP標記山羊抗兔IG(Abcam,中國);RIPA蛋白裂解液(中)、蛋白酶抑制劑、磷酸酶抑制劑(碧云天,中國);阿侖膦酸鈉片(揚子江藥業集團,中國);氨芐青霉素(威仕特,加拿大);蘇木精-伊紅染色液(碧云天,中國);鈣、磷、E2、IL-6及IL-1β大鼠ELISA試劑盒(聯科,中國)。
1.2 動物分組及給藥 所有動物實驗均通過動物倫理委員會的同意和批準,將50只雌性SD大鼠[(250±5)g]隨機分為假手術組、模型組及阿侖膦酸鈉組(ALN-25 μg/kg、ALN-50 μg/kg和ALN-100 μg/kg),每組10只,術后8周開始灌胃給藥ALN,每天1次,連續8周,假手術組和模型組均灌胃給予等體積的生理鹽水。
1.3 骨質疏松大鼠模型的建立 采用雙側卵巢切除法建立骨質疏松大鼠模型,造模前,大鼠禁食12 h,在第0周,腹腔注射戊巴比妥鈉(50 mg/kg)麻醉,從大鼠背部脊柱兩側,分離并切除雙側卵巢;假手術組僅切除卵巢附近的脂肪組織,術后縫合傷口,計手術當周為第0周,連續肌肉注射4 d抗生素(氨芐青霉素,4×104U/d)。
1.4 骨密度(BMD)檢測 在第16周給藥結束后,腹腔注射戊巴比妥鈉(50 mg/kg)麻醉大鼠,平放于雙能X線吸收測量儀上,測量大鼠全身的骨密度(g/cm2)。
1.5 血液指標檢測 采用ELISA法檢測大鼠血清中鈣、磷、E2、IL-6及IL-1β的分泌水平,在第16周給藥結束后,大鼠眼球取血,用1.5 ml EP管收集,4 ℃靜置30 min,3 000 r/min離心10 min,吸取上清立即檢測或置于-80 ℃保存。
1.6 HE病理染色 在第16周給藥結束后,大鼠脫頸椎處死,分離收集實驗大鼠的股骨組織,置于4%多聚甲醛固定24 h,然后用EDTA脫鈣液(10%,pH 8.0)脫鈣15 d,每3天更換1次,石蠟包埋,切成4 μm薄片,蘇木精-伊紅染色,觀察病理變化。
1.7 Micro-CT 分離大鼠的股骨組織,固定于4%多聚甲醛中,并且使用Micro-PET/CT掃描儀(Inveon,Siemens,Berlin,Germany)分析遠端股骨,掃描儀的分辨率為10 μm,管電壓為50 kV,管電流為400 μA。
1.8 蛋白印跡免疫分析(Western blot) 大鼠脫頸椎處死,分離收集實驗大鼠的股骨組織,稱取約50 mg,采用Western blot檢測大鼠股骨組織中p-p65、p65、p-p50、p50、p-JNK、p-p38、p-ERK的蛋白表達水平。根據說明書操作提取組織總蛋白,采用BCA法(碧云天,中國)對蛋白進行定量,加入Loading buffer(4×)于100 ℃煮沸5 min,然后進行SDS-PAGE電泳來達到分離蛋白的目的,電泳條件:80 V,30 min;120 V,60 min。隨后采用100 V,90 min,將電泳分離后的蛋白轉移至聚偏佛乙烯(PVDF)膜(Millipore,美國),用5%脫脂奶粉封閉60 min,TBST洗滌5次,5 min/次,用一抗(p-p65、p65、p-p50、p50、p-JNK、p-p38、p-ERK及GAPDH,按1∶1 000稀釋)4 ℃孵育過夜,TBST洗滌5次,5 min/次,用二抗(HRP標記山羊抗兔IG,按1∶10 000稀釋)孵育90 min,TBST洗滌5次,5 min/次。用ECL化學發光法(Millipore,MA)顯影檢測,Image J分析灰度值,GAPDH用作內參對照。
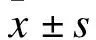
2 結果
2.1 阿侖膦酸鈉對骨質疏松大鼠骨密度(BMD)的影響 骨密度檢測結果表明,與假手術組相比,模型組大鼠的骨密度值顯著降低(P<0.01);與模型組相比,25、50、100 μg/kg劑量的阿侖膦酸鈉組大鼠的骨密度值顯著增加(P<0.05)。表明本研究成功建立了骨質疏松大鼠模型,阿侖膦酸鈉對骨質疏松癥具有一定的緩解作用。見圖1。
圖1 阿侖膦酸鈉對骨質疏松大鼠骨密度的影響
2.2 阿侖膦酸鈉對骨質疏松大鼠骨代謝相關血液學指標的影響 采用ELISA法檢測骨質疏松大鼠骨代謝相關的血液學指標變化,結果表明,與假手術組相比,模型組大鼠血清中鈣、磷的水平顯著下調(P<0.05);灌胃給予阿侖膦酸鈉呈劑量依賴性上調骨質疏松大鼠血清中鈣、磷的水平(P<0.01或P<0.05)。見圖2A。與假手術組相比,模型組大鼠血清中E2的水平顯著下調(P<0.01),IL-1β及IL-6的水平顯著上調(P<0.01);與模型組相比,灌胃給予阿侖膦酸鈉呈劑量依賴性上調骨質疏松大鼠血清中E2的水平(P<0.05),下調IL-1β、IL-6的水平(P<0.05)。見圖2B。
2.3 阿侖膦酸鈉對骨質疏松大鼠股骨結構變化的影響 采用HE染色和Micro-CT檢測骨質疏松大鼠股骨結構的變化。HE染色結果表明,與對照組相比,模型組大鼠的股骨結構出現骨丟失;與模型組相比,灌胃給予阿侖膦酸鈉呈劑量依賴性改善骨質疏松大鼠的股骨結構(圖3A)。Micro-CT結果表明,與對照組相比,模型組大鼠股骨組織中骨小梁出現缺失;與模型組相比,灌胃給予阿侖膦酸鈉呈劑量依賴性改善骨質疏松大鼠股骨的骨小梁結構(圖3B)。

圖2 阿侖膦酸鈉對骨質疏松大鼠骨代謝相關血液學指標的影響
注:A.骨質疏松大鼠血清中鈣、磷的水平;B.骨質疏松大鼠血清中E2、IL-1β、IL-6的水平。與模型組比較,*P<0.05,**P<0.01;與假手術組比較,##P<0.01
2.4 阿侖膦酸鈉對骨質疏松大鼠股骨組織中NF-κB信號通路活化的影響 采用Western blot法檢測骨質疏松大鼠股骨組織中NF-κB通路相關分子的蛋白表達水平,結果表明,與假手術組相比,模型組大鼠股骨組織中p-p50/p50、p-p65/p65的表達水平上調(P<0.01);與模型組相比,給予阿侖膦酸鈉呈劑量依賴性下調骨質疏松大鼠股骨組織中p-p50/p50、p-p65/p65的表達水平(P<0.05)。見圖4。
2.5 阿侖膦酸鈉對骨質疏松大鼠股骨組織中MAPK信號通路活化的影響 采用Western blot法檢測骨質疏松大鼠股骨組織中MAPK信號通路相關分子的蛋白表達水平。結果表明,與假手術組相比,模型組大鼠股骨組織中p-JNK、p-p38及p-ERK的表達水平顯著上調(P<0.01);與模型組相比,給予阿侖膦酸鈉呈劑量依賴性下調骨質疏松大鼠股骨組織中p-JNK、p-p38及p-ERK的表達水平(P<0.05)。見圖5。
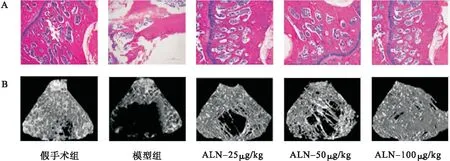
圖3 阿侖膦酸鈉對骨質疏松大鼠股骨結構變化的影響
圖4 阿侖膦酸鈉對骨質疏松大鼠股骨組織中NF-κB信號通路的影響
3 討論
骨質疏松癥是一種常見的骨代謝性疾病,發病率和致殘率較高,影響著全世界數百萬人的生活質量[7]。阿侖膦酸鈉是一種骨吸收抑制劑,應用于骨質疏松癥的治療。研究表明,高劑量的阿侖膦酸鈉能夠誘導破骨細胞的凋亡,從而產生抗骨質疏松的作用[6],但是阿侖膦酸鈉抗骨質疏松的具體作用機制仍不明確。因此,本研究采用骨質疏松大鼠模型,探索阿侖膦酸鈉是否通過NF-κB和MAPK通路產生抗骨質疏松作用。
骨重塑是一個動態的骨代謝過程,在成年人骨骼的調節過程中起著至關重要的作用,其主要由破骨細胞介導的骨吸收過程和成骨細胞介導的骨形成過程維持,當平衡傾向于骨吸收過程時,將會導致骨流失,最終導致骨代謝相關疾病的發生,如骨質疏松癥[5,8-9]。研究表明,骨質疏松大鼠血清中鈣、磷水平與骨質疏松癥的嚴重程度密切相關,除此之外,骨質疏松大鼠血清中雌激素(E2)水平會顯著下調[10-12]。本研究結果表明,模型組大鼠血清中鈣、磷及E2水平顯著下降,與上述報道結果一致。同時,本研究結果表明,給予阿侖膦酸鈉能夠上調骨質疏松大鼠血清的鈣、磷及E2水平。IL-1β和IL-6作為重要的細胞炎癥因子,在破骨細胞介導的骨吸收過程中起著重要的作用。研究表明,骨質疏松癥大鼠血清中IL-1β和IL-6水平顯著上調[13],這與本研究結果一致。同時,本研究結果表明,阿侖膦酸鈉能夠顯著下調骨質疏松大鼠血清中IL-1β和IL-6的水平,表明阿侖膦酸鈉能夠通過改善骨代謝相關血液學指標緩解骨質疏松癥的發展。
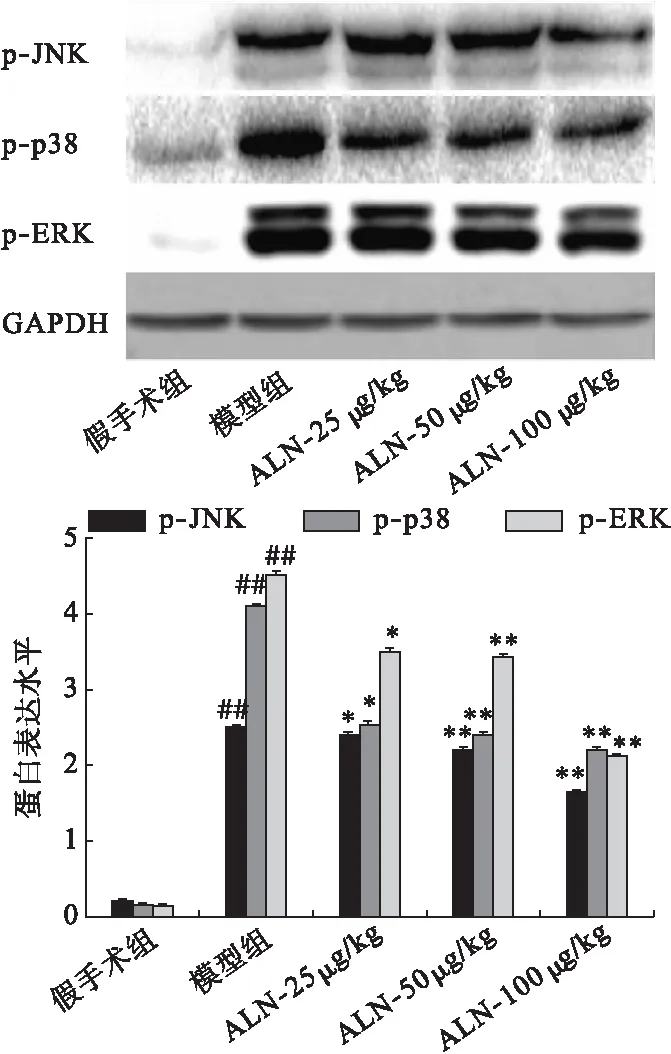
圖5 阿侖膦酸鈉對骨質疏松大鼠股骨組織中MAPK信號通路的影響
為了進一步探索阿侖膦酸鈉的抗骨質疏松作用,本研究采用HE染色和Micro-CT觀察股骨結構的變化。HE染色結果表明,模型組大鼠的股骨結構出現骨丟失,給予阿侖膦酸鈉能夠改善骨質疏松大鼠的股骨結構,防止骨丟失。Micro-CT結果表明,模型組大鼠股骨組織中骨小梁出現大面積缺失,灌胃給予阿侖膦酸鈉呈劑量依賴性改善骨小梁骨丟失,上述結果表明,阿侖膦酸鈉能夠改善骨質疏松大鼠的骨結構。
NF-κB信號通路對于破骨細胞的形成和活化至關重要,在骨質疏松癥的發展過程中具有關鍵性作用[14]。正常情況下,p65或p50與IκBα形成共聚體存在于細胞質中,當受到細胞外信號的刺激(如RNAKL、LPS),IκBα發生磷酸化并降解,p65或p50進入細胞核,促進破骨細胞形成和活化相關信號分子的轉錄,促進破骨細胞的形成和活化[15]。本研究結果表明,灌胃給予阿侖膦酸鈉能夠抑制骨質疏松大鼠股骨組織中p-p65/p65和p-p50/p50的表達,進而抑制NF-κB信號通路。此外,MAPK信號通路是生物體內重要的信號轉導通路,其亞族主要包括JNK、ERK及p38,參與介導細胞的生長、分化及發育等多種過程[16]。研究表明,MAPK信號通路對于破骨細胞的形成和活化具有重要作用,并且其也能夠通過影響NF-κB信號通路介導骨質疏松癥的發展[17-18]。本研究結果表明,灌胃給予阿侖膦酸鈉能夠下調骨質疏松大鼠股骨組織中磷酸化JNK、ERK及p38的表達,進而抑制MAPK信號通路活化,上述結果表明,阿侖膦酸鈉能夠抑制骨質疏松大鼠股骨組織中NF-κB和MAPK信號通路的活化。
綜上所述,阿侖膦酸鈉灌胃給予骨質疏松大鼠,能夠通過調控NF-κB和MAPK信號通路的活化來緩解骨質疏松癥的發展。因此,本研究為阿侖膦酸鈉的抗骨質疏松作用機制研究提供了一定的參考方向。

