豬瘟病毒E2蛋白主要抗原區(qū)高效表達(dá)及間接ELISA抗體檢測方法的建立和應(yīng)用
陳九,潘麗,馬中元,崔燕*
(1. 甘肅農(nóng)業(yè)大學(xué),甘肅 蘭州 730000; 2. 中國農(nóng)業(yè)科學(xué)院蘭州獸醫(yī)研究所,甘肅 蘭州 730000)
豬瘟病毒(classical swine fever virus)可感染所有品種不同年齡的豬和野豬[1]。豬瘟發(fā)病特征是實質(zhì)器官出血、壞死與梗死;慢性發(fā)病常見纖維素性壞死性腸炎,曾被稱為豬霍亂(hog cholera)[2-4]。豬瘟傳播快、病死率高,在世界范圍流行,是動物健康和生豬養(yǎng)殖業(yè)需要面對的巨大威脅,是豬最重要的病毒性傳染病之一[5]。
豬瘟病毒是黃病毒科瘟病毒屬成員,為單股正鏈RNA病毒,基因組大小約為12.3 kb,包含1個大的開放閱讀框(ORF),側(cè)翼是2個非翻譯區(qū)(NTR)[6-8]。ORF編碼大約3 900個氨基酸的多聚蛋白,由病毒和宿主細(xì)胞蛋白酶協(xié)同翻譯和加工形成12種蛋白,核衣殼蛋白C和3種包膜糖蛋白E0、E1和E2構(gòu)成病毒核酸外的蛋白質(zhì)保護(hù)結(jié)構(gòu),此外還編碼了8種非結(jié)構(gòu)(NS)蛋白[9-10]。C、E0、E1、E2基因長度分別為297、681、585、1 119 nt,其中E2序列最長[11]。E2蛋白可分為A、B、C、D 4個抗原區(qū),位于E2蛋白N端氨基酸殘基690~866,是E2抗原性最強的部分[12]。A抗原區(qū)又分了3個亞區(qū)A1、A2、A3,A1亞區(qū)和B、C抗原區(qū)是中和抗原表位區(qū)[13]。豬自然感染豬瘟后,產(chǎn)生針對 E2蛋白的中和抗體,時間快,含量多,持續(xù)時間長。因此E2蛋白是豬瘟新型疫苗開發(fā)和臨床檢測的首選蛋白[14]。
大腸桿菌表達(dá)蛋白質(zhì)的技術(shù)成熟、成本低、培養(yǎng)周期短、抗污染能力強,并且容易擴大生產(chǎn),方便研究成果迅速轉(zhuǎn)化產(chǎn)生實際價值。但大腸桿菌表達(dá)外源蛋白有時會出現(xiàn)表達(dá)量低甚至不表達(dá)的情況,這很有可能是因為這些外源基因使用的密碼子是大腸桿菌非偏愛的密碼子[15]。
本試驗對E2蛋白主要抗原區(qū)稀有密碼子進(jìn)行同義替換以望提高表達(dá)量,并將重組蛋白作為抗原建立豬瘟病毒間接ELISA抗體檢測方法。
1 材料與方法
1.1 質(zhì)粒與感受態(tài)細(xì)胞
含有E2主要抗原區(qū)基因的重組質(zhì)粒pET-30a(+)由南京金斯瑞生物科技有限公司合成,大腸桿菌BL21(DE3)菌種來自寶生物工程 (大連) 有限公司。
1.2 主要試劑及血清
兔抗豬IgG-HRP、蛋白質(zhì)定量檢測試劑盒購自天根生物技術(shù)有限公司;Ni-NTA柱購自GeneScript公司;豬瘟病毒、豬圓環(huán)病毒、豬藍(lán)耳病病毒、偽狂犬病病毒、豬細(xì)小病毒、豬流行性腹瀉病毒、口蹄疫病毒(O型)的抗體陽性血清來自蘭州獸醫(yī)研究所,由標(biāo)準(zhǔn)疫苗規(guī)范接種仔豬獲得;陰性血清取自未接種疫苗的仔豬;其他試劑全為分析純。
1.3 E2主要抗原區(qū)的密碼子優(yōu)化
根據(jù)研究顯示,E2基因在表達(dá)時密碼子選擇有較高的偏愛性[16]。E2基因與大腸桿菌使用頻率差異較大的密碼子有33個,其中最突出的是GCG、AGA、AGG與CGC;E2基因中共有34個稀有密碼子,其中存在AGGAGG、AGGAGA、CCCATA、AGAATA、CCCAGG、AGACCC、CTAATA這樣稀有密碼子成對出現(xiàn)的情況。在NCBI網(wǎng)站查閱豬瘟病毒全部序列(NC_002657.1),選擇E2蛋白主要抗原區(qū)序列,根據(jù)大腸桿菌密碼子偏好性對其進(jìn)行稀有密碼子同義替換和優(yōu)化,主要方法是從豬瘟病毒全基因序列中獲取 E2蛋白N端抗原區(qū)對應(yīng)的編碼序列,使用專業(yè)的計算機程序進(jìn)行稀有密碼子優(yōu)化,優(yōu)化后的序列由南京金斯瑞生物科技有限公司進(jìn)行合成并直接插入pET-30a(+),重組質(zhì)粒命名為pET-30a-E2。
1.4 E2原核表達(dá)及純化
將pET-30a-E2轉(zhuǎn)化宿主菌BL21 (DE3),涂布于含卡那霉素的LB平板選擇培養(yǎng),挑取單個白色菌落放入培養(yǎng)管,加入少量LB液體培養(yǎng)基于37 ℃培養(yǎng)2 h,將培養(yǎng)物按照1∶1 000比例接種在含有50 mg/L卡那霉素的LB液體培養(yǎng)基中于37 ℃、220 r/min擴增培養(yǎng),直至OD600達(dá)到0.6~0.8,加入終濃度為1 mmol/L的IPTG進(jìn)行誘導(dǎo)表達(dá),繼續(xù)培養(yǎng)6 h。
收集菌液以8 000 r/min離心5 min,棄去上清液收集菌體沉淀,菌體用PBS(pH=7) 緩沖液混合均勻,置于冰上用超聲波破碎菌體,于4℃以10 000 r/min離心15 min,收集上清液和沉淀進(jìn)行SDS-PAGE確定目的蛋白,包涵體用8 mol/L尿素溶解,離心收集上清液,微孔濾膜過濾去除雜質(zhì),按照說明書使用Ni-NTA柱進(jìn)行過柱純化重組蛋白。
1.5 重組蛋白Western blot測試抗原性
目的蛋白溶解在變性劑中,使用分步透析法[17]于4 ℃逐步去除變性劑根據(jù)說明書使用蛋白質(zhì)定量檢測試劑盒對溶液進(jìn)行蛋白含量檢測;純化后的蛋白進(jìn)行Western blot試驗檢測與豬瘟病毒血清抗體的結(jié)合能力。
1.6 優(yōu)化間接ELISA反應(yīng)條件
將純化的重組蛋白用作包被抗原,進(jìn)行方陣滴定確定合適的抗原包被量以及血清稀釋度等,用pH=9.6的碳酸鹽緩沖液稀釋重組蛋白以25、50、100和200 ng/孔包被于酶標(biāo)板,于4 ℃過夜,5 g/L的牛血清白蛋白試劑作為封閉液進(jìn)行封閉,PBST洗滌3次,血清以1∶10、1∶20、1∶40、1∶80稀釋,每孔100 μL轉(zhuǎn)移至酶標(biāo)板,于37 ℃孵育30 min,PBST洗滌3次,加入100 μL適合稀釋度的兔抗豬IgG-HRP,于37 ℃孵育30 min,PBST洗滌3次,加入TMB底物,于37 ℃顯色10 min,加50 μL終止液測量OD450值。確定檢測的條件后,檢測已知狀態(tài)的血清樣品,再使用MedCalc軟件繪制血清檢測特征曲線(receiver operating characteristic,ROC),對統(tǒng)計數(shù)據(jù)進(jìn)行圖像化便于直觀感受和分析,選擇正確率較高的臨界值確定為豬瘟病毒間接ELISA抗體檢測方法的臨床檢測臨界值。
1.7 間接ELISA重復(fù)性檢測
使用建立的間接ELISA方法在同一檢測板和不同檢測板進(jìn)行8次進(jìn)行重復(fù)檢測,統(tǒng)計批內(nèi)變異系數(shù)和批間變異系數(shù),測試間接ELISA的重復(fù)性。
1.8 間接ELISA特異性檢測
使用建立的間接ELISA方法對多種常見豬病毒抗體陽性血清進(jìn)行檢測,包括豬圓環(huán)病毒、豬藍(lán)耳病病毒、偽狂犬病病毒、豬細(xì)小病毒、豬流行性腹瀉病毒、口蹄疫病毒、豬瘟病毒的抗體陽性血清。為了使檢測數(shù)據(jù)更具有適用性,統(tǒng)計時用“平均值±標(biāo)準(zhǔn)差”表示,以此測試間接ELISA的特異性。
1.9 間接ELISA臨床檢測
使用建立的間接ELISA檢測566份臨床血清,與愛德仕生產(chǎn)的豬瘟阻斷ELISA試劑盒進(jìn)行比較,統(tǒng)計符合率。
2 結(jié)果與分析
2.1 E2基因主要抗原區(qū)序列優(yōu)化
原始序列對大腸桿菌的密碼子適應(yīng)指數(shù)為0.37,優(yōu)化后的密碼子適應(yīng)指數(shù)為0.83;原始序列CG含量為49.81%,優(yōu)化后CG含量為50.95%;優(yōu)化后的核酸序列使用DNAMAN軟件與原序列進(jìn)行對比,相似度為72.92%,氨基酸序列不變。密碼子優(yōu)化后原序列中大腸桿菌使用頻率低于10%的密碼子全部被替換,序列中密碼子偏好性普遍上升(見圖1、圖2)。
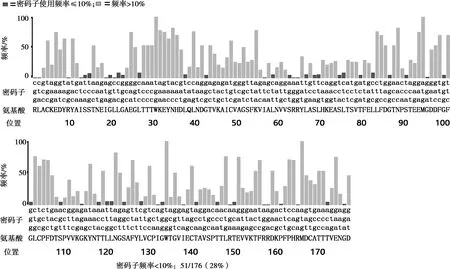
圖 1 密碼子優(yōu)化前
2.2 重組蛋白的表達(dá)
重組蛋白的分子量約為30 ku,預(yù)期位置出現(xiàn)明顯的條帶,目的蛋白被成功誘導(dǎo)表達(dá),占總蛋白的41%,表達(dá)產(chǎn)物主要分布在細(xì)菌的包涵體沉淀中(見圖3)。
2.3 重組蛋白的純化
將表達(dá)產(chǎn)物經(jīng)Ni-NTA親和純化柱純化,SDS-PAGE(見圖4)顯示只出現(xiàn)1條與目的蛋白分子質(zhì)量一致的條帶,證明重組蛋白已經(jīng)被純化。
2.4 重組蛋白Western blot試驗
復(fù)性后的重組蛋白與豬瘟病毒陽性血清進(jìn)行Western blot試驗(見圖5)。重組蛋白能與豬瘟病毒抗體發(fā)生特異性反應(yīng),在相應(yīng)位置出現(xiàn)明顯條帶,表明重組蛋白與豬瘟病毒抗體結(jié)合能力強,可以用于檢測豬瘟病毒抗體。
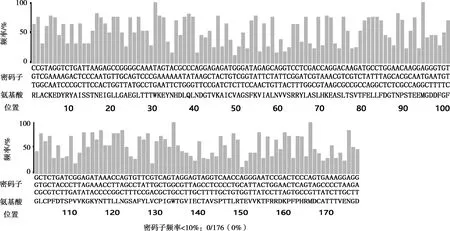
圖 2 密碼子優(yōu)化后

M.蛋白 Marker;1~2. 上清;3~4. 包涵體
圖3 E2重組蛋白的可溶性SDS-PAGE分析

M.蛋白 Marker;1. E2純化蛋白
圖4 E2重組蛋白純化SDS-PAGE分析

M.蛋白 Marker; 1~2.E2蛋白
圖5 E2重組蛋白的Western blot檢測
2.5 重組蛋白濃度檢測
根據(jù)說明書使用蛋白定量檢測試劑盒進(jìn)行重組蛋白濃度檢測,顯示純化復(fù)性后溶液中蛋白質(zhì)的含量約為1.5 mg/mL,純化過程損失部分重組蛋白。
2.6 間接ELISA條件的優(yōu)化
使用方陣滴定法確定最適抗原包被量和血清稀釋度(見表1)。選擇陽性血清OD450接近1且P/N較大的條件即抗原包被量為100 ng/孔,血清稀釋度為1∶40。使用不同稀釋度的酶標(biāo)二抗進(jìn)行血清樣品檢測,統(tǒng)計P/N值(見表2)。選擇P/N值比較高的1∶20 000作為酶標(biāo)二抗的工作濃度。
表1 選擇最適抗原包被量和血清稀釋度
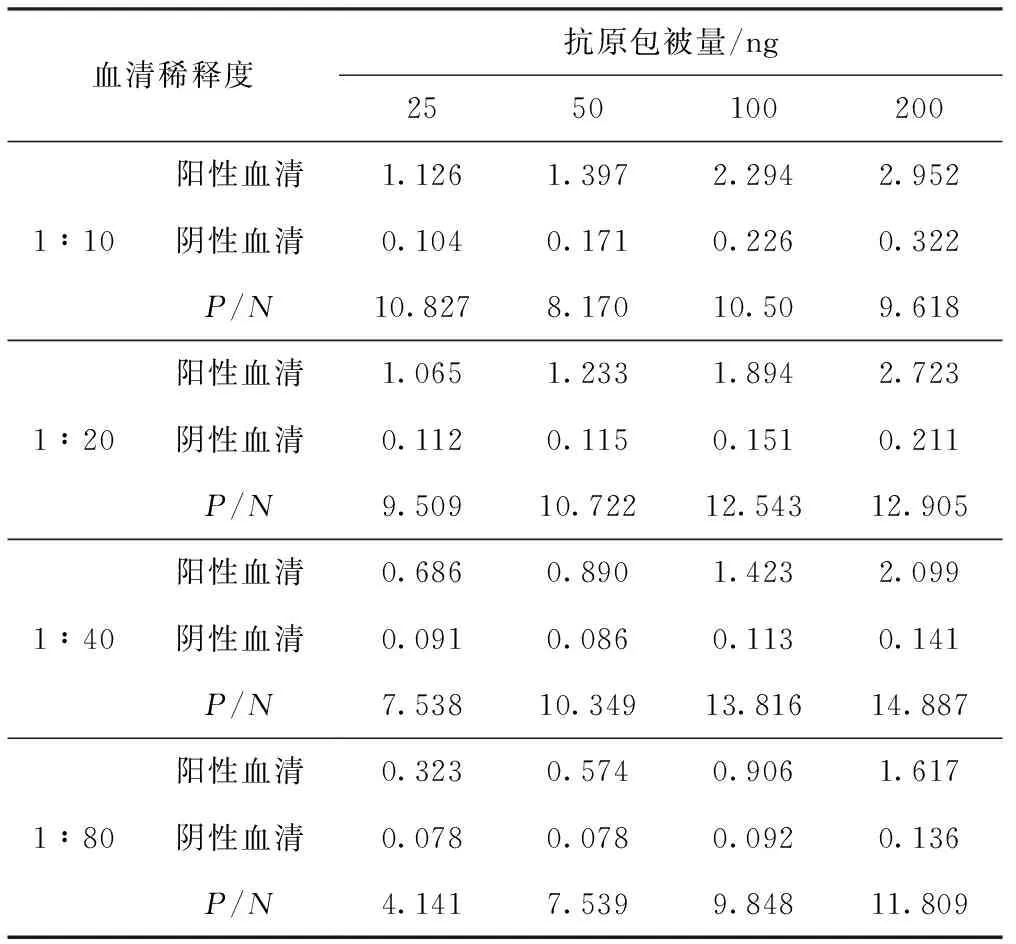
血清稀釋度抗原包被量/ng25501002001∶10陽性血清1.1261.3972.2942.952陰性血清0.1040.1710.2260.322P/N10.8278.17010.509.6181∶20陽性血清1.0651.2331.8942.723陰性血清0.1120.1150.1510.211P/N9.50910.72212.54312.9051∶40陽性血清0.6860.8901.4232.099陰性血清0.0910.0860.1130.141P/N7.53810.34913.81614.8871∶80陽性血清0.3230.5740.9061.617陰性血清0.0780.0780.0920.136P/N4.1417.5399.84811.809
表2 不同稀釋度的酶標(biāo)二抗P/N值
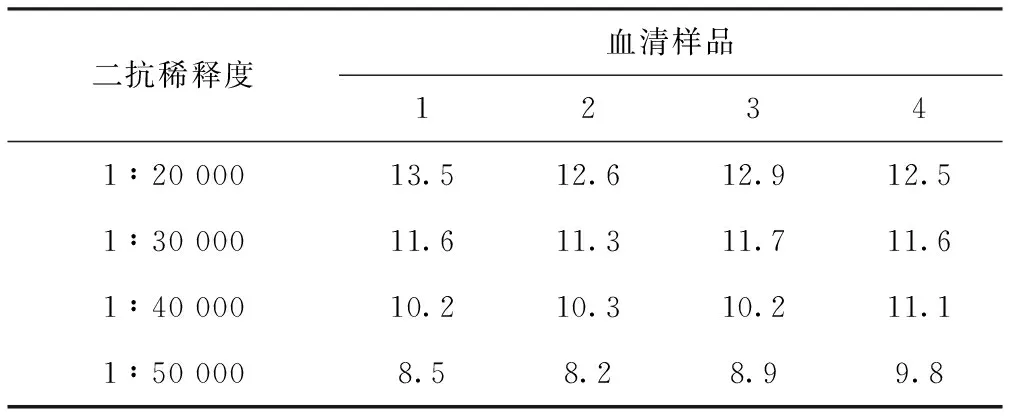
二抗稀釋度血清樣品12341∶20 00013.512.612.912.51∶30 00011.611.311.711.61∶40 00010.210.310.211.11∶50 0008.58.28.99.8
2.7 間接ELISA的臨界值確定
確定間接ELISA反應(yīng)條件之后,用間接ELISA檢測164份陰性血清和402份陽性血清,統(tǒng)計檢測數(shù)據(jù),制作血清檢測數(shù)據(jù)統(tǒng)計(見圖6),并繪制ROC曲線(見圖7)進(jìn)行數(shù)據(jù)分析。當(dāng)OD450取值大于0.23則百分之百陽性,當(dāng)OD450取值小于0.13則百分之百陰性,在兩者之間存在少量交叉。綜合數(shù)據(jù)確定間接ELISA臨床檢測最佳臨界值為OD450=0.18,此時約登指數(shù)為0.866 4。

圖6 血清檢測數(shù)據(jù)統(tǒng)計

圖7 血清檢測ROC曲線確定臨界值
2.8 間接ELISA重復(fù)性試驗
使用建立的間接ELISA方法在同一檢測板和不同檢測板上進(jìn)行8次重復(fù)檢測,結(jié)果顯示批內(nèi)變異系數(shù)為3.72%,批間變異系數(shù)為4.75%。重復(fù)檢測變異系數(shù)均低于5%,說明建立的間接ELISA有良好的穩(wěn)定性。
2.9 間接ELISA特異性測試
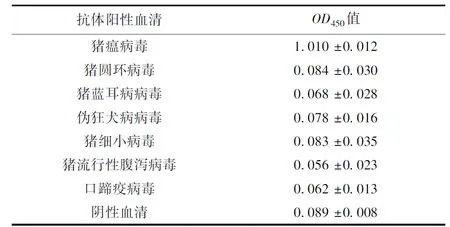
使用建立的間接ELISA檢測多種常見豬病毒抗體陽性血清,陰性血清作為對照,統(tǒng)計檢測結(jié)果(見表3)。除豬瘟病毒陽性血清,其他血清OD450值均沒有到達(dá)間接ELISA臨界值甚至遠(yuǎn)低于臨界值,這表明建立的豬瘟病毒間接ELISA抗體檢測方法與上述常見豬病毒抗體無交叉反應(yīng),特異性強有實用價值。
表3 間接ELISA特異性試驗
2.10 間接ELISA臨床檢測
使用建立的豬瘟病毒間接ELISA抗體檢測方法和愛德仕豬瘟阻斷ELISA試劑盒對566份來自養(yǎng)殖站的臨床血清樣品進(jìn)行檢測,比較2種方法的符合性(見表4)。豬瘟病毒間接ELISA抗體檢測方法的樣本陽性率為65.37%,IDEXX試劑盒檢測樣本陽性率為71.02%,與愛德仕的陽性符合率為90.80%,陰性符合率為93.29%,總符合率為91.52%。本試驗建立的間接ELISA與愛德仕生產(chǎn)的檢測試劑盒符合率高。
表4 臨床血清樣品檢測結(jié)果

檢測方法愛德仕 ELISA+-合計間接ELISA+36511376-37153190合計402164566
注:“+”表示檢測結(jié)果陽性;“-”表示檢測結(jié)果陰性。
3 討論
控制豬瘟的策略主要包括不接種疫苗的撲殺政策和系統(tǒng)性疫苗接種預(yù)防措施[18]。執(zhí)行不接種疫苗政策的高密度養(yǎng)殖地區(qū)一旦豬瘟暴發(fā)會造成巨大的經(jīng)濟(jì)損失[19]。中國目前執(zhí)行的豬瘟強制免疫措施要求豬群在一年中任何時間都要保持免疫率在90%以上[20]。為了控制和消除豬瘟,需要快速準(zhǔn)確的實驗室診斷方法。全病毒抗原的生產(chǎn)難度高,但通過重組DNA技術(shù)獲得豬瘟病毒E2蛋白可以替代全病毒抗原[21]。大腸桿菌表達(dá)系統(tǒng)已成為生產(chǎn)重組蛋白的有力系統(tǒng),由Studier等[22]研究的T7啟動子驅(qū)動系統(tǒng)仍是最成功的系統(tǒng)之一。本試驗選擇帶有強啟動子T7和His標(biāo)簽蛋白的pET-30a(+)作為基因載體,宿主菌選擇與之相配合的BL21(DE3),建立一個高表達(dá)的原核系統(tǒng)條件。
有證據(jù)顯示物種間的密碼子使用偏好并不相同,據(jù)Zhang等[23]的研究,大腸桿菌至少有8個稀有密碼子,稀有密碼子與表達(dá)量呈負(fù)相關(guān)關(guān)系,如果稀有密碼子串聯(lián)成簇出現(xiàn)則對表達(dá)的抑制作用更加顯著。豬瘟病毒對原核表達(dá)系統(tǒng)的密碼子適應(yīng)指數(shù)偏低,E2基因中存在多個大腸桿菌稀有密碼子,并且存在稀有密碼子串聯(lián)出現(xiàn)的情況;利用計算機程序?qū)2主要抗原區(qū)序列進(jìn)行稀有密碼子同義替換,不改變對應(yīng)的氨基酸不影響蛋白質(zhì)結(jié)構(gòu)和活性[24]。生物密碼子使用偏好的差異導(dǎo)致了異源基因表達(dá)的各種問題,但可以通過合理的基因設(shè)計和合成克服。全基因表達(dá)對宿主菌負(fù)擔(dān)較大,本試驗只表達(dá)E2蛋白主要抗原區(qū)保留免疫原性[25]。在相關(guān)報道中不乏有人實現(xiàn)部分或全長序列的表達(dá)但表達(dá)量普遍偏低。本試驗成功表達(dá)E2主要抗原區(qū),表達(dá)量占菌體總蛋白的41%,比張永國等[26]研究的表達(dá)量高10%,獲得的重組蛋白含量是Wong等[27]的40倍,基本實現(xiàn)高表達(dá)。
E2蛋白在原核表達(dá)中以積聚體存在形成包涵體,有利于大腸桿菌大量表達(dá)外源蛋白,這雖然不是自然構(gòu)象,但只需要通過細(xì)菌破碎離心就能進(jìn)行收集達(dá)到初步純化的效果,而且有證據(jù)表明大腸桿菌表達(dá)系統(tǒng)表達(dá)的截短E2蛋白不會改變抗原特性,不影響與對應(yīng)抗體的特異性結(jié)合[27]。
很多豬瘟病毒抗體檢測技術(shù)以全病毒為基礎(chǔ),但豬瘟病毒難以培養(yǎng)純化且有散毒風(fēng)險。本試驗構(gòu)建的間接ELISA使用純化重組蛋白作為抗原提高了檢測質(zhì)量,可以通過光度定量對單個批次的抗原進(jìn)行標(biāo)準(zhǔn)化,還可以排除雜蛋白引起的可能的非特異性反應(yīng)。與僅檢測所使用指示抗體單一結(jié)合位點的抗體阻斷ELISA不同,間接ELISA檢測與包被抗原結(jié)合的所有抗體。在正向間接血凝試驗 (IHA)、間接ELISA、Dot-ELISA、膠體金免疫層析試紙條 (GICA) 4種檢測豬瘟病毒抗體的方法中,間接ELISA具有最高的靈敏性;與阻斷ELISA相比,間接ELISA操作更迅速、制備更簡單。有研究者通過大量的田間試驗數(shù)據(jù)研究后認(rèn)為,在目前中國的豬瘟強制免疫政策下,豬瘟病毒間接ELISA抗體試劑盒更適合中國國情[28-29]。由于E2蛋白在豬瘟病毒中高度保守的抗原結(jié)構(gòu)域,因此任何豬瘟病毒毒株(包括新出現(xiàn)的)所產(chǎn)生的抗體都有可能與其結(jié)合而被檢測到,這更有利于流行病學(xué)調(diào)查。本試驗構(gòu)建的間接ELISA通過ROC曲線判斷臨界值,相比使用平均值作為臨界值則ROC曲線不易受極端值的影響,更能反映數(shù)據(jù)的特異性和敏感性,提高檢測準(zhǔn)確性。另外本試驗建立的間接ELISA與進(jìn)口阻斷ELISA試劑盒相比在陽性符合率、陰性符合率、總符合率方面均超過90%,在國內(nèi)類似研究中處于較好水平。這可能與包被蛋白的抗原性和判斷標(biāo)準(zhǔn)的選擇有關(guān)[30]。
本試驗重組E2蛋白由大腸桿菌生產(chǎn),因此可能缺乏自然狀態(tài)下的糖基化等修飾。雖有研究認(rèn)為其對抗原性影響不大但還是存在差異,有可能影響正確指數(shù),而且間接ELISA包被抗原的純凈度對檢測效果有非常重要的影響。因此對重組蛋白的純化要求比較高,間接ELISA的高靈敏性對血清樣品的質(zhì)量要求也較高,取得樣品后要避免污染和及時檢測,避免樣品發(fā)生溶血導(dǎo)致非特異反應(yīng)。由于牛病毒性腹瀉病毒與豬瘟病毒的相似性以及自然狀態(tài)下的血清學(xué)交叉反應(yīng),雖然本試驗截取了E2蛋白抗原性最強的部分表達(dá)以削弱牛病毒性腹瀉病毒抗體對豬瘟病毒抗體檢測的影響,而且在標(biāo)準(zhǔn)化封閉養(yǎng)殖場豬感染牛病毒性腹瀉病毒的可能性很小,但在臨床懷疑存在牛病毒性腹瀉病毒時建議搭配RT-PCR檢測進(jìn)一步確診。
綜上,本試驗優(yōu)化了E2主要抗原區(qū)密碼子提高了表達(dá)量,重組蛋白與豬瘟抗體特異性結(jié)合強,構(gòu)建的豬瘟病毒間接ELISA抗體檢測方法與愛德仕生產(chǎn)的試劑盒總符合率達(dá)到91.52%,臨床檢測結(jié)果理想,可以進(jìn)一步開發(fā)應(yīng)用。

