低溫馴化下斑馬魚LINE1的表達檢測*
陶筱帆 謝婷婷 李小霞 羅軍濤 白雅靜,2 韓兵社,2,3 張俊芳,2,3
低溫馴化下斑馬魚的表達檢測*
陶筱帆1謝婷婷1李小霞1羅軍濤1白雅靜1,2韓兵社1,2,3張俊芳1,2,3①
(1. 上海海洋大學 水產種質資源發掘與利用教育部重點實驗室 上海 201306;2. 上海海洋大學 水產科學國家級實驗教學示范中心 上海 201306;3. 上海海洋大學 中國科學技術部海洋生物科學國際聯合研究中心 上海 201306)
長散布核元件-1(Long spread nuclear element-1,)是跳躍基因。前期比較基因組研究發現,南極魚經歷漫長的低溫適應進化后,與南極圈外的同亞目魚類相比較,在基因水平上的擴增效率高達8~300倍,但的擴增與魚類抵御寒冷之間的關系尚未明了。本實驗對斑馬魚()胚胎成纖維細胞ZF4進行了不同時間梯度的低溫處理(18℃、5 d和18℃、30 d),同時對斑馬魚成魚也進行了不同時間的低溫處理(10℃, 3 h、6 h、1 d、3 d、5 d)。采用RT-qPCR檢測了的mRNA水平,并克隆了斑馬魚基因啟動子區,利用Luciferase雙熒光報告系統,在ZF4細胞中驗證5¢UTR在低溫壓力下的生物活性。結果顯示,短時間低溫處理下,ZF4細胞中mRNA水平有所降低,而在長時間低溫處理中,的mRNA水平顯著升高。在成魚中,短時間低溫處理下,mRNA水平降低;長期低溫處理下,mRNA水平顯著升高。在ZF4細胞中發現,5¢UTR具有生物活性。在低溫處理(18℃,3 d)下,報告基因信號減弱,間接表明啟動子活性減弱。研究結果表明,低溫壓力會影響在魚類中的表達。本研究為進一步探究在魚類適應低溫環境中的作用機制奠定了基礎。
;低溫;斑馬魚;ZF4細胞;啟動子
真核生物基因組中存在大量的轉座子元件,包含、和。迄今為止,3種逆轉座子依舊具有活性:、和元素。逆轉座子包含5¢UTR、2個開放閱讀框及具有PolyA尾的3¢UTR (Dombroski, 1991)。屬跳躍基因,占人類基因組約17%,為自主轉座,通過RNA中間體自我傳播;而和為非自主轉座(Lander, 2001)。它們利用“復制–粘貼”機制,通過RNA中間體在整個基因組中繁殖,這一過程稱為逆轉錄(Lu, 2016)。逆轉座子的轉座導致基因組改變,多數時候給基因組帶來負面影響,如:改變基因組結構、影響基因表達、改變基因調控方式等(Gilbert, 2005; Tubio, 2014)。因此,宿主基因會通過啟動子區域甲基化或者小RNA干擾等機制來抑制轉座(Kinomoto, 2007; Levin, 2011)。但研究表明,轉座元件與基因組是互益的(Faulkner, 2009),逆轉座子的轉座可導致新基因產生,這對于物種多樣性和物種進化具有積極意義(Hamon, 2011; Volff, 2000)。
魚類作為變溫動物,水溫變化在很大程度上影響其生理及行為(Perry, 2005)。南極大陸經歷了漫長降溫,水溫常年處于0℃以下(Gordon, 2003),南極圈內與南極圈外同亞目魚類相比較逆轉座子的擴增倍率在8倍以上,有些甚至高達300倍(Chen, 2008)。這些基因可能參與了魚類適應寒冷的過程,在漫長的歷史進化中變化。同時,研究發現,在面對環境壓力時,逆轉座子的逆轉座活性會受到環境因素影響(Butelli, 2012)。因此,推測寒冷可能會導致魚類逆轉座子擴增,并且可能與魚類適應寒冷環境相關。
斑馬魚()體型纖細,成體長為3~4 cm,對水質要求不高。孵出后約4個月達到性成熟,成熟魚每隔幾天可產卵一次,卵子體外受精,體外發育,胚胎發育速度快,胚體透明、子代多、遺傳背景清楚,容易進行實驗操作,易于在實驗室內繁殖飼養,與人類基因87%相似(Watanabe, 2016),作為一種模式生物應用于生物學中(Howe, 2013; Sollars,2003)。斑馬魚ZF4細胞來自孵化后1 d的斑馬魚胚胎(Driever, 1993),被廣泛用于生物學實驗中(Hu, 2015)。為研究低溫對的影響,本研究檢測了斑馬魚ZF4細胞18℃培養5 d和30 d、10℃培養3 h、6 h、1 d、3 d、5 dmRNA水平以及通過報告基因監測基因5¢UTR在18℃ 3 d的活性變化,為研究寒冷環境下魚類基因組中的表達變化奠定基礎。
1 材料與方法
1.1 ZF4細胞和斑馬魚
斑馬魚胚胎成纖維細胞ZF4購買于ATCC (American Type Culture Collection)。斑馬魚由實驗室斑馬魚魚房飼養,恒溫循環水系統,水溫為27℃~ 28℃,pH為6.8~7.8,用豐年蟲()飼養。
1.2 主要試劑和儀器
胎牛血清和胰蛋白酶、DMEM︰F12液體培養基購于Gibco公司;T4連接酶和限制性內切酶購于NewEngland;SYBR Green購于羅氏公司;Lipofectamine3000購于英濰捷基貿易有限公司;RT-qPCR反轉錄試劑盒購于寶生物工程(大連)有限公司;雙熒光報告系統試劑盒購于Promega公司,引物由上海生工生物工程有限公司合成(表1)。
表1 PCR擴增引物
主要儀器:細胞低溫培養箱(Galaxy170R, eppendorf)、LightCycler 480Ⅱ(羅氏);酶標儀(Bio-Rad公司);NanoDrop2000賽默飛世爾科技(中國)有限公司。
1.3 實時熒光定量PCR
應用IDT引物設計軟件(http://sg.idtdna.com/ sessionTimeout.aspx)設計RT-qPCR引物(,, 表1)。采用Trizol方法提取斑馬魚細胞和肌肉組織的RNA,使用TaKaRa反轉錄試劑盒(貨號: RR047A)進行反轉錄實驗,以反轉錄的cDNA為模板,進行SYBR Green熒光定量PCR實驗。PCR條件:95℃預變性3 min;95℃變性30 s,58℃退火30 s,72℃延伸30 s,共35個循環;72℃延伸5 min。每個樣品3個生物學重復,相對表達量的計算方法用2–ΔΔCt計算,β-actin作為內參。
1.4 載體構建及報告基因檢測
提取斑馬魚細胞基因組DNA,以基因組DNA為模板,上下游引物(,, 表1)分別引入酶切位點Ⅰ和Ⅰ,利用PCR擴增基因5¢UTR,Ⅰ、Ⅰ酶切后用T4連接酶連接至載體PGL4.10中,將重組質粒轉化到大腸桿菌內。
選擇生長狀態良好的ZF4細胞接種于6孔板中,次日細胞完全貼壁后棄除培養基,按Lipofectamine3000說明書進行轉染。
采用Dual-Luciferase Reporter Assay System進行雙熒光報告基因活性檢測,按說明書進行測定。
1.5 統計分析方法
統計學分析應用GraphPad Prism 5 (GraphPad software, 美國)軟件分析。的表達數據和雙熒光檢測數據均來自3次獨立重復實驗,采用Student’s-test方法分析統計學差異,<0.05表示具有顯著性差異。
2 結果與分析
2.1 斑馬魚胚胎成纖維細胞(ZF4)和斑馬魚成魚在低溫處理下LINE1的表達變化
有研究表明,長期生活在低溫環境的南極魚基因組與南極圈外同亞目魚類的基因組相比較,轉座家族發生了8~300倍的擴增(Chen, 2008)。本研究選取的2個基因和進行實時熒光定量PCR。在斑馬魚成魚中,10℃為斑馬魚低溫生存的臨界溫度,因此,選取10℃作為魚類低溫處理溫度。與在常溫(28℃)飼養的成魚相比,在10℃低溫處理3 h和6 h的成魚肌肉組織中的mRNA水平(圖1A)有所下調,而在10℃低溫處理1 d、3 d、5 d的成魚肌肉組織中mRNA水平顯著上調,在成魚中的mRNA水平(圖1B)與的mRNA有相同趨勢;在ZF4細胞中,選取18℃作為低溫環境(Han, 2016),與常溫(28℃)細胞對比,在18℃低溫處理5 d的細胞中的mRNA水平有所下調,而在18℃低溫處理30 d的細胞的mRNA水平顯著上調(圖1C)。
2.2 重組質粒構建與檢測
實驗室前期研究發現,低溫環境會引起CpG位點甲基化的改變(Han, 2016)。猜測低溫環境會影響5¢UTR區域啟動子的活性,以斑馬魚基因組DNA為模板,將2個基因的5¢UTR區域進行PCR擴增(圖2)。
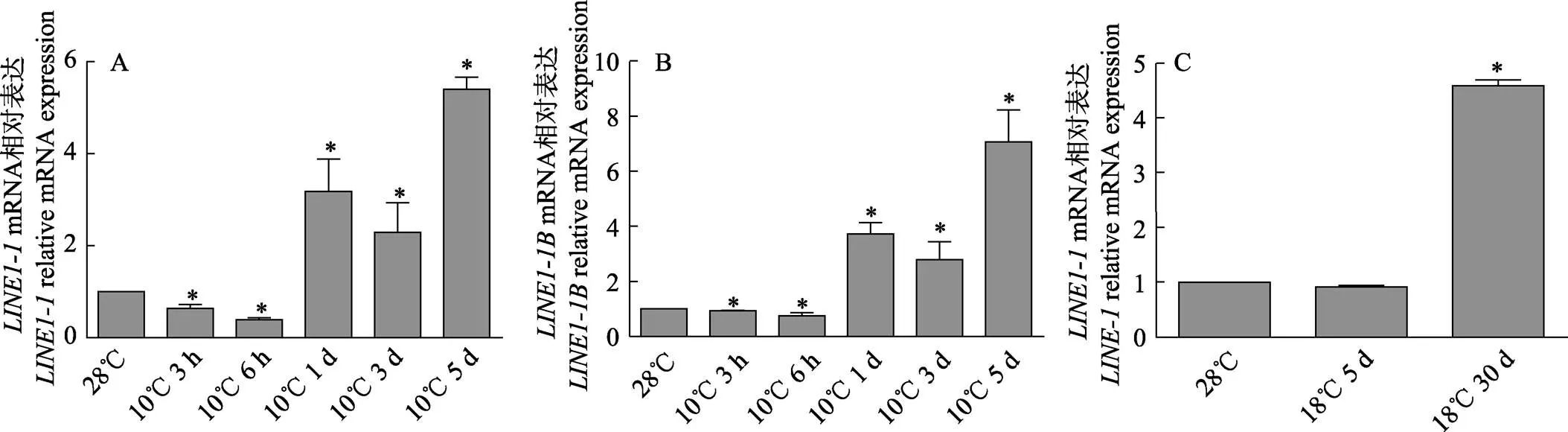
圖1 斑馬魚低溫處理下LINE1表達的變化(*: P<0.05.下同)
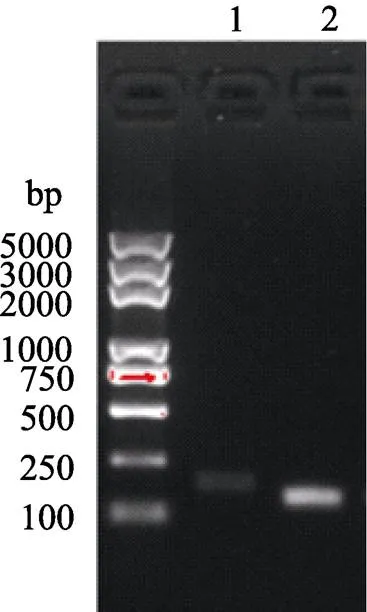
圖2 PCR產物瓊脂糖凝膠電泳結果
1:-promoter; 2:-promoter
載體PGL4.10-basic與PCR擴增片段經過Ⅰ和Ⅰ雙酶切后,在T4 DNA連接酶的作用下,將PCR擴增產物插入PGL4.10-basic載體中(圖3),將重組質粒送上海生工生物工程有限公司測序,測序結果與PCR擴增的基因序列相同,重組質粒構建成功。
2.3 雙熒光報告系統檢測結果
通過檢測相對熒光素酶活性,間接檢測5¢UTR區域啟動子活性,5¢UTR區域啟動子活性越高,熒光素酶活性發光值越高。海腎熒光素作為檢測系統內參,當5¢UTR區域啟動子沒有生物學活性時,不能檢測到熒光素酶活性發光值。將構建的重組質粒轉染進常溫(28℃)培養ZF4細胞中,結果顯示,與陰性對照PGL4.10-basic相比,重組質粒均能檢測到熒光素酶活性發光值,而PGL4.10-basic不能檢測到熒光素酶發光值,表明5¢UTR具有啟動子活性(圖4A)。將重組質粒與PGL4.10-basic和PGL3- promoter轉染到18℃低溫處理3 d的ZF4細胞中,PGL4.10-basic為陰性對照,PGL3-promoter為陽性對照,結果顯示,與常溫(28℃)細胞相比,重組質粒在低溫處理下熒光素酶活性發光值均有不同程度的下降,表明短期低溫處理會影響基因5¢UTR區域啟動子活性(圖4B)。
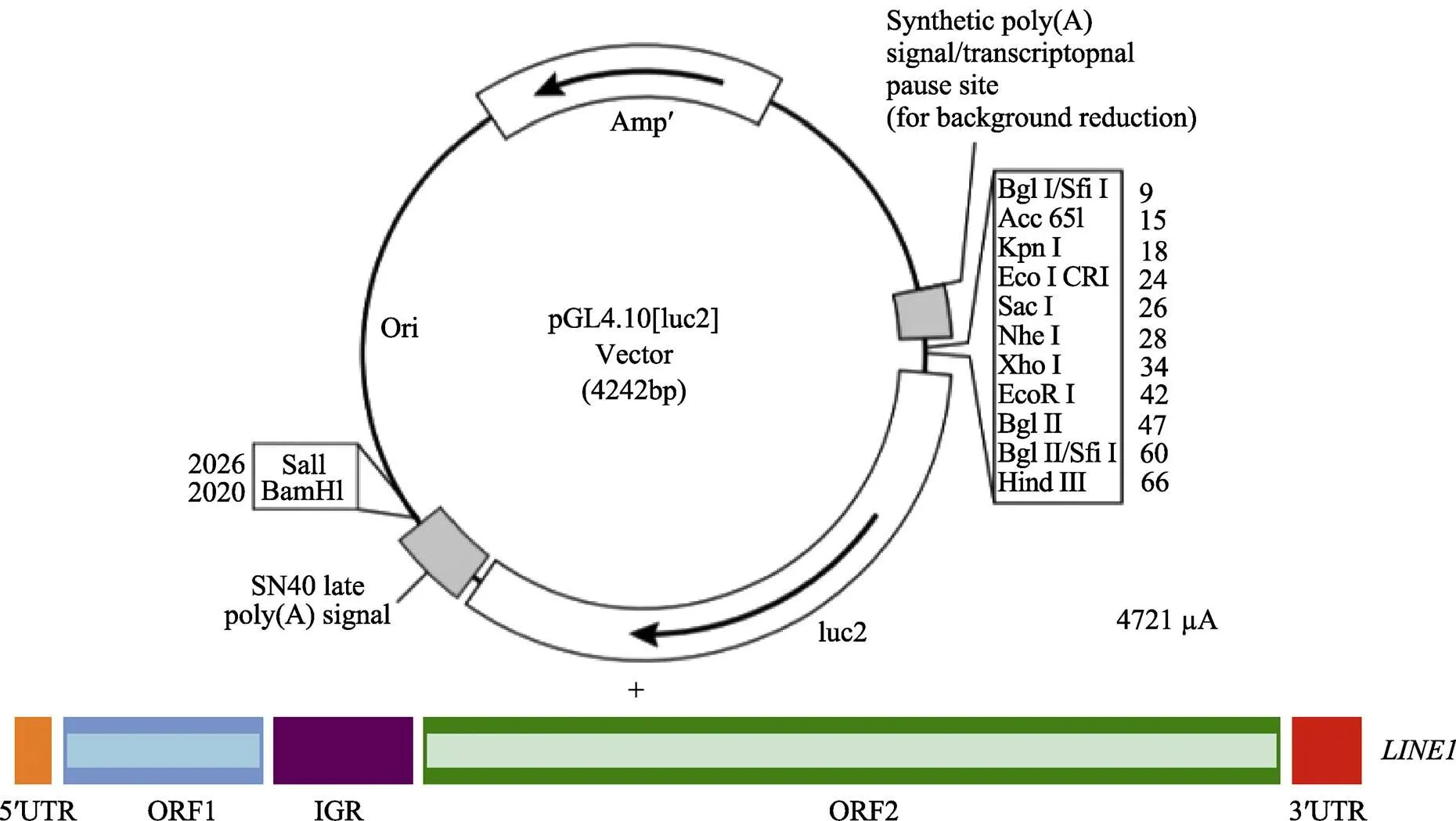
圖3 PGL4.10-LINE1 5¢UTR質粒構建

圖4 重組質粒PGL4.10-LINE1-promoter轉染斑馬魚細胞后雙熒光素酶相對活性分析
3 討論
屬于最豐富的一類自主轉座因子。盡管多數被抑制活性,但依舊有很少一部分的具有活性,的插入雖與疾病相關,但同樣影響基因組的進化(Beck, 2011)。當面對環境因素刺激時,基因組進行自身進化誘導轉座子轉座(McClintock, 1984),使生物對環境變化做出適應性改變。在之前研究中發現,南極圈內物種與南極圈外物種轉座子擴增效率存在巨大差異。在西西里血橙中,寒冷誘導逆轉座子的擴增(Butelli, 2012)。這提示的擴增可能與生物體對長期寒冷環境的適應相關。為了研究逆轉座子在長期低溫環境下的大量擴增是否與生物體對寒冷環境的適應相關,將ZF4細胞培養在18℃5 d,發現ZF4細胞生長明顯停滯,而后20 d左右逐漸恢復生長狀態,盡管相比28℃依舊緩慢。本研究發現,短期低溫處理誘導斑馬魚成魚及斑馬魚ZF4細胞的mRNA水平下調,長期低溫處理誘導斑馬魚成魚及斑馬魚ZF4細胞的mRNA水平顯著上調,推測對生物體適應外界低溫環境壓力可能有積極作用。生物體在寒冷環境下轉座子轉座水平升高,可能增加生物體基因型的多樣性,使其對環境壓力產生適應性進化。
在自然界中遵循著優勝劣汰的法則,從生物的進化開始,生物體內有益于適應環境、使生物體更好生存下去的基因會保留,垃圾基因會逐漸被淘汰,那么在長期寒冷環境中,L1的顯著擴增是否是生物體為了適應寒冷環境而選擇的一種生物途徑?在之前研究中發現,啟動子甲基化水平在低溫環境下有所改變:18℃低溫處理ZF4細胞5 d,啟動子甲基化水平升高,而低溫處理30 d時,甲基化水平降低(Han, 2016)。生物體會通過甲基化水平來調節表達水平,與甲基化水平呈負相關關系(Hata,1997),因此,甲基化水平升高時,被抑制,mRNA水平呈下降趨勢;當甲基化水平降低時,激活,mRNA水平呈上升趨勢。據此推測,低溫環境會通過影響5¢UTR區域啟動子活性,進而影響的擴增。構建重組質粒發現,低溫確實能引起5¢UTR區域啟動子活性改變,推測這種調節可能是生物體應對外界低溫環境壓力的方式之一,L1對生物體適應外界低溫環境壓力可能有積極作用。生物體在寒冷環境下轉座子轉座水平升高,可能增加生物體基因型的多樣性,使其對環境壓力產生適應性進化。
總之,本研究通過對斑馬魚細胞以及斑馬魚成魚不同時間的低溫處理,研究的表達變化,為更好了解在魚類寒冷適應中的作用機制奠定了基礎。
Beck CR, Garcia-Perez JL, Badge RM,. LINE-1 elements in structural variation and disease. Annual Review of Genomics and Human Genetics, 2011, 12: 187–215
Butelli E, Licciardello C, Zhang Y,. Retrotransposons control fruit-specific, cold-dependent accumulation of anthocyanins in blood oranges. Plant Cell, 2012, 24(3): 1242–1255
Chen Z, Cheng CH, Zhang J,. Transcriptomic and genomic evolution under constant cold in Antarctic notothenioid fish. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(35): 12944–12949
Dombroski BA, Mathias SL, Nanthakumar E,. Isolation of an active human transposable element. Science, 1991, 254(5039): 1805–1808
Driever W, Rangini Z. Characterization of a cell line derived from zebrafish () embryos. In vitro Cellular & Developmental Biology. Animal, 1993, 29(9): 749–754
Faulkner GJ, Carninci P. Altruistic functions for selfish DNA. Cell Cycle (Georgetown, Tex.), 2009, 8(18): 2895–2900
Gilbert N, Lutz S, Morrish TA,. Multiple fates of L1 retrotransposition intermediates in cultured human cells. Molecular and Cellular Biology, 2005, 25(17): 7780–7795
Gordon AL. Oceanography: The brawniest retroflection. Nature, 2003, 421(6926): 904–905
Hamon P, Duroy PO, Dubreuil-Tranchant C,. Two novel Ty1-copia retrotransposons isolated from coffee trees can effectively reveal evolutionary relationships in the Coffea genus (Rubiaceae). Molecular Genetics and Genomics: MGG, 2011, 285(6): 447–460
Han B, Li W, Chen Z,. Variation of DNA methylome of zebrafish cells under cold pressure. PLoS One, 2016, 11(8): e0160358
Hata K, Sakaki Y. Identification of critical CpG sites for repression of L1 transcription by DNA methylation. Gene, 1997, 189(2): 227–234
Howe K, Clark MD, Torroja CF,. The zebrafish reference genome sequence and its relationship to the human genome. Nature, 2013, 496(7446): 498–503
Hu P, Liu M, Zhang D,. Global identification of the genetic networks and cis-regulatory elements of the cold response in zebrafish. Nucleic Acids Research, 2015, 43(19): 9198–213
Kinomoto M, Kanno T, Shimura M,. All APOBEC3 family proteins differentially inhibit LINE-1 retrotransposition. Nucleic Acids Research, 2007, 35(9): 2955–2964
Lander ES, Linton LM, Birren B,. Initial sequencing and analysis of the human genome. Nature, 2001, 409(6822): 860–921
Levin HL, Moran JV. Dynamic interactions between transposable elements and their hosts. Nature Reviews. Genetics, 2011, 12(9): 615–627
Lu XJ, Xue HY, Qi XL,. LINE-1 in cancer: Multifaceted functions and potential clinical implications. Genetics in Medicine, 2016, 18(5): 431–439
McClintock B. The significance of responses of the genome to challenge. Science, 1984, 226(4676): 792–801
Perry AL, Low PJ, Ellis JR,. Climate change and distributionshifts in marine fishes. Science, 2005, 308(5730): 1912–1915
Sollars V, Lu X, Xiao L,. Evidence for an epigenetic mechanism by which Hsp90 acts as a capacitor for morphological evolution. Nature Genetics, 2003, 33(1): 70–74
Tubio JMC, Li Y, Ju YS,. Mobile DNA in cancer. Extensive transduction of nonrepetitive DNA mediated by L1 retrotransposition in cancer genomes. Science, 2014, 345(6196): 1251343
Volff JN, Korting C, Schartl M. Multiple lineages of the non- LTR retrotransposon Rex1 with varying success in invading fish genomes. Molecular Biology and Evolution, 2000, 17(11): 1673–1684
Watanabe E, Mano S, Nomoto M,. HSP90 stabilizes auxin-responsive phenotypes by masking a mutation in the auxin receptor TIR1. Plant & Cell Physiology, 2016, 57(11): 2245–2254
Expression of) During Cold Acclimation
TAO Xiaofan1, XIE Tingting1, LI Xiaoxia1, LUO Juntao1, BAI Yajing1,2, HAN Bingshe1,2,3, ZHANG Junfang1,2,3①
(1. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306; 2. National Demonstration Center for Experimental Fisheries Science Education, Ministry of Science and Technology, Shanghai Ocean University, Shanghai 201306; 3. International Research Center for Marine Biosciences, Shanghai Ocean University, Shanghai 201306)
The long-spread nuclear element-1 () retrotransposon is a mobile element in genome. Previous comparative genomic studies found that Antarctic Notothenioid fish underwent a long low-temperature adaptation evolution, and compared with Notothenioid fish outside the Antarctic circle,genes were duplicated by 8~300 fold.The link between this augmentation and the resistance of fish to cold is not known. In this study, zebrafish () embryonic fibroblasts ZF4 were exposed to a low temperature (18℃) for 5 days and 30 days, and adult zebrafish were exposed to a low temperature (10℃) for 3 h, 6 h, 1 d, 3 d, and 5 d. The mRNA expression ofwas examined using RT-qPCR. The promoter regions of zebrafishgene were cloned and the biological activity of5'UTR at low temperature were verified in ZF4 cells by using the dual-luciferase reporter system. The following results were obtained: (1) In ZF4 cells,mRNA expression was decreased by short-term low temperature treatment, but was significantly increased by long-term low temperature treatment. (2) In adult fish,mRNA expression was decreased by short-term low temperature treatment, but was significantly increased in long-term low temperature treatment. (3) The5'UTR was found to be biologically active in ZF4 cells. (4) It was found that during low temperature treatment (18℃, 3 d), the reporter gene signal was weakened, which indirectly indicated that thepromoter activity was weakened. The results showed that low temperature stress affectedexpression in fish, which presents a foundation for further study on the mechanism of action of
; Low temperature;; ZF4 cells; Promoter
Q74
A
2095-9869(2020)03-0088-06
10.19663/j.issn2095-9869.20190226001
張俊芳,教授,E-mail: jfzhang@shou.edu.cn
2019-02-26,
2019-03-14
* 國家自然科學基金項目(31372516; 81770165)、上海市教育委員會“東方學者”計劃和上海市人才發展資金項目(201457)共同資助 [This work was supported by National Natural Science Foundation of China (31372516; 81770165), and Project of Shanghai Education Commission “Oriental Scholars” Program, and Shanghai Talent Development Fund Project (201457)]. 陶筱帆,E-mail: 512099587@qq.com
http://www.yykxjz.cn/
陶筱帆, 謝婷婷, 李小霞, 羅軍濤, 白雅靜, 韓兵社, 張俊芳. 低溫馴化下斑馬魚的表達檢測. 漁業科學進展, 2020, 41(3): 88–93
Tao XF, Xie TT, Li XX, Luo JT, Bai YJ, Han BS, Zhang JF. Expression ofin zebrafish () during cold acclimation. Progress in Fishery Sciences, 2020, 41(3): 88–93
ZHANG Junfang, E-mail: jfzhang@shou.edu.cn
(編輯 馮小花)

