外科手術治療植入起搏器后心內巨大曲霉菌贅生物1例
高潔,韓宗茂,黑飛龍,2
(1.鄭州大學人民醫院 a.麻醉科;b.心血管內科,河南 鄭州 450003;2.中國醫學科學院阜外醫院 體外循環科,北京 100037)
感染性心內膜炎(infective endocarditis,IE)是指由細菌、真菌或其他微生物直接感染而造成的心瓣膜或心室壁內膜的炎癥[1]。起搏器相關的感染性心內膜炎是永久起搏器植入術后嚴重的并發癥之一,發生率為0.13%~19.9%[2],死亡率為7%~11%[3],常見的感染部位包括囊袋內電池、電極導線和心內膜等[4]。起搏器相關的感染性心內膜炎致病菌主要為葡萄球菌,其次是鏈球菌,真菌罕見[5-7]。起搏器植入術后的真菌性心內膜炎,主要是念珠菌感染,未見曲霉菌感染性心內膜炎相關報道。本研究報道1例起搏器植入術后曲霉菌感染性心內膜炎病例。
1 病例介紹
患者男,68歲,間斷高熱伴寒戰1個月,胸悶1 d。18 a前因竇性心動過緩植入右心室單極起搏器,10 a前因電池耗竭,更換起搏器,未取出原有起搏電極。術前胸片示:右側心腔內兩根起搏電極(見圖1)。術前心臟彩超示:右心房等回聲團,大小40 mm×28 mm,附著于起搏器電極,活動大,舒張期脫入三尖瓣口,收縮期回入右房(見圖2)。術前胸部CT示:右下肺動脈分支血管腔內低密度影,雙肺下葉后底段節段不張。血培養陰性。診斷:心臟起搏器植入后并感染性心內膜炎及右心贅生物形成。術前起搏器程控回示竇性心律,心率每分鐘70次。2020年1月在全麻體外循環下行“右心贅生物清除+三尖瓣成形+心內起搏裝置取出+臨時起搏導線安置術”。胸骨正中切口入路,建立體外循環,經上腔靜脈插短直角引流管。轉流,降溫,阻斷主動脈后,灌注冷凝血心臟停跳液,切開右心房,近上腔靜脈開口處剪斷起搏器導線,心臟停跳。心內探查:右心房內探及暗紅色不規則團塊狀贅生物,大小約為30 mm×41 mm,將2根起搏電極包裹其內,并累及右心房后壁、三尖瓣隔瓣瓣尖及前瓣腱索,質軟,活動度大,可通過三尖瓣隔瓣與后瓣交界脫入右心室(見圖3)。隔瓣與后瓣交界處形成一直徑10 mm的缺損。電極頂端釘入右心室游離壁。小心清除心內贅生物及起搏電極(見圖4),右房壁累及處以電刀局部燒灼,三尖瓣瓣尖及腱索處贅生物以小圓刀徹底刮除,切除部分受損嚴重的膈瓣,膈瓣與后瓣交界缺損處以5-0 prolene滑線連續縫合。壓迫主肺動脈以碘伏及冰鹽水沖洗心腔,注水試驗,三尖瓣關閉良好,復溫,開放主動脈后,心臟自動復跳,為竇性心律,每分鐘80次。心肌阻斷51 min,體外循環輔助40 min。經右側鎖骨下切口取出起搏器及殘余。置入心表臨時起搏器。術后病理及術中標本細菌培養均回示曲霉菌感染(見圖5),隨給予伏立康唑治療(每次400 mg,每12 h服用1次,24 h后改為每次200 mg,每12 h服用1次,連續口服4周),治療期間定期監測血藥濃度。患者恢復順利,經胸超聲心動圖顯示心臟及瓣膜功能無異常,復查血培養陰性,達到出院標準。囑患者1個月后復查超聲心動圖、血培養等相關檢查,并于院外長期口服伏立康唑治療,療程2 a以上,每6個月復查1次。
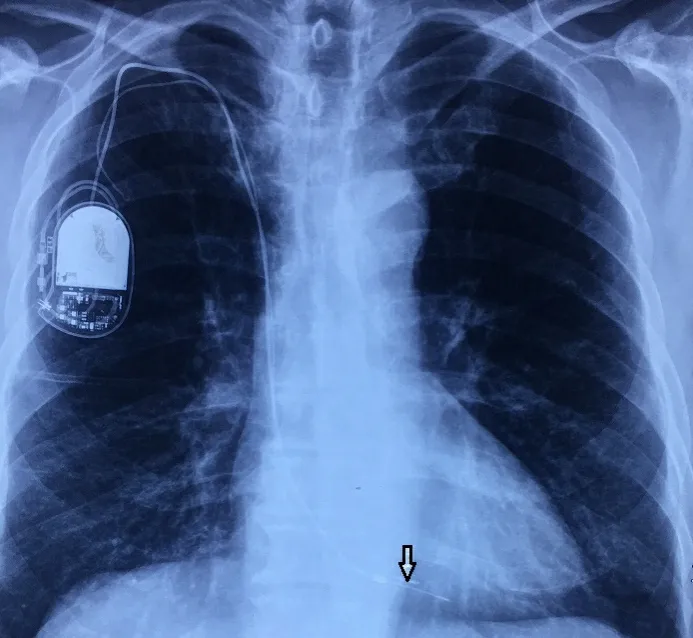
箭頭所指處為右心室起搏內電極。
圖1 術前胸部正位X線圖像
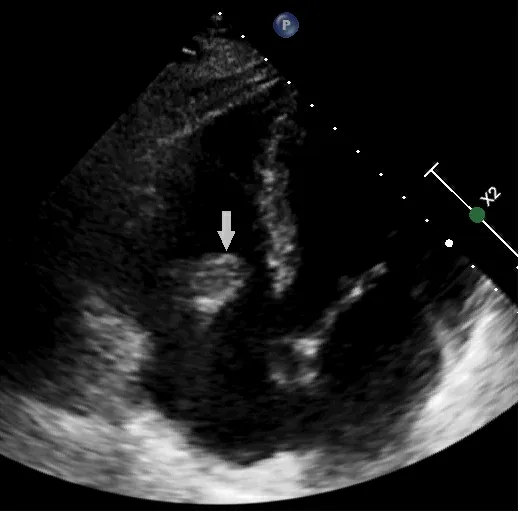
箭頭所指處為右心房內贅生物。
圖2 術前心臟彩超
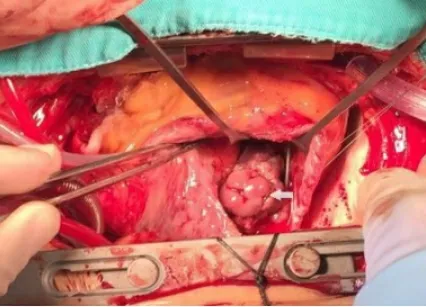
箭頭所指處為右心房內贅生物。
圖3 術中切開右心房
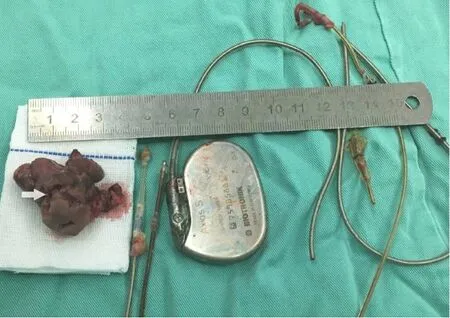
箭頭所指處為右心房內贅生物。
圖4 切除的心內贅生物及起搏器裝置
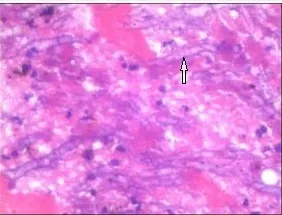
箭頭所指為曲霉菌絲。
圖5 術后心內贅生物病理學切片(HE染色,高倍顯微鏡×400倍)
2 討論
隨著近10 a來我國人口老齡化問題日益凸顯,老年退行性心臟瓣膜病患者逐年增加,器械植入術作為一種直接有效的治療方式被廣泛應用于疾病的治療中,但同時也導致了器械植入術后患感染性心內膜炎的患者同樣呈顯著增加趨勢[8]。
起搏器相關的感染性心內膜炎與普通感染性心內膜炎相比有以下3個特點。(1)臨床表現復雜多樣,最常見的表現為發熱(多伴寒顫),其次為心臟雜音及腦、肺或脾栓塞等[9]。但有研究顯示,僅有少數患者出現典型癥狀,如皮膚瘀點瘀斑、Osler結節、栓塞等發生率僅為18.6%~20.3%,多數患者僅表現出上述1種或幾種臨床表現,老年患者及免疫抑制患者尤甚[10],故早期診斷相對困難[11]。(2)超聲心動圖對其檢出率較低。超聲心動圖易受外界因素影響,如起搏導線干擾或合并嚴重心臟瓣膜鈣化等,都可能導致超聲下贅生物顯影不清。研究顯示經胸超聲心動圖和經食道超聲心動圖對感染性心內膜炎的診斷靈敏度分別為40%~63%和90%~100%[1]。放射性核素成像結合CT也可為感染性心內膜炎提供有效的確診依據[12]。如遇癥狀不典型的患者,應嘗試多種影像學檢查方式。(3)存在罕見致病菌。血培養陽性病例中以葡萄球菌和鏈球菌多見,國內外也有糞腸球菌、白念珠菌、鮑曼不動桿菌、副溶血性鏈球菌等報道[13]。致病菌的多樣性為抗生素的選擇帶來一定困難。
起搏器相關感染性心內膜炎的確診推薦使用改良的Duke診斷標準[14],結合患者的臨床表現、既往病史、微生物學指標、影像學檢查等進行診斷。治療方面,原則上確診后均應行抗感染治療,對于高風險人群,如合并血流動力學不穩定、心力衰竭、瓣膜功能障礙、反流或栓塞等,應在排除手術禁忌證后立即行手術治療[12]。
本病例對臨床工作有以下啟示。(1)起搏器安裝術后,特別是再次更換起搏器而未取出原有電極的情況下,患者若出現持續發熱、肺內游走斑片影,應高度懷疑感染性心內膜炎,盡早做血培養、心臟彩超及胸部增強CT等檢查以明確診斷。血培養陰性不能完全排除感染性心內膜炎[15],本例患者術前血培養即為陰性。(2)永久起搏器并發心內膜炎的有效治療方法是完整去除起搏裝置,心內有贅生物者,不宜通過介入方式去除心內電極,易導致贅生物脫落而引起肺栓塞和肺部感染[16]。本例患者為在體外循環下,完整取出起搏電極及贅生物。(3)右心房壁贅生物累及處的處理方法:本例患者清創后以電刀行局部燒灼,以防心內膜炎復發。(4)本例患者三尖瓣腱索及瓣膜上贅生物與正常組織間有一光整界面,術中小心剝離,保留了腱索及大部分瓣膜,成功修復了三尖瓣,避免了三尖瓣置換手術。有報道稱感染性心內膜炎患者中,三尖瓣成型術后感染性心內膜炎的復發率顯著低于三尖瓣置換(0比21%)[17]。(5)本例患者先經開胸體外循環取出心內電極及贅生物后,再經右側鎖骨下切口完整取出起搏器及殘余電極,減少了心內切口污染及皮下創面的滲血。灌注心臟停跳液后,立即剪斷右房內電極線,心臟即刻停搏。仔細觀察電極斷端,確保無金屬絲露出,以免從體表拔出殘余電極時,金屬絲劃破上腔靜脈及鎖骨下靜脈。
本例患者為臨床表現不典型的起搏器植入術后感染性心內膜炎患者。對于器械植入術后患者,若出現反復發熱、寒戰等癥狀,應及時行血培養及影像學檢查等,單一陰性結果不能完全排除感染性心內膜炎的可能。明確診斷后應早期行外科手術,明確病原菌后應早期對癥抗感染治療,抗生素的選擇應遵循廣譜、聯合、規律、全程的原則,才能使起搏器植入術后感染性心內膜炎治愈率提高。

