老年2型糖尿病周圍神經病變患者的血清鐵蛋白、同型半胱氨酸和維生素B12水平
朱婷,陳玉娟,岳欣閣,楊再剛
(鄭州大學第一附屬醫院 老年內分泌科,河南 鄭州 450052)
糖尿病是由多個致病基因和易感基因在環境因素的協同作用下導致的機體內分泌代謝紊亂,從而引起胰島素分泌缺乏和(或)胰島功能缺陷,以慢性血糖升高為主要特征。目前糖尿病被分為1型、2型、特殊類型以及妊娠糖尿病,其中2型糖尿病(type 2 diabetes mellitus,T2DM)占95%以上。糖尿病可以單獨或同時累及全身各個重要器官。糖尿病周圍神經病變(diabetic periphral neuropathy,DPN)作為糖尿病的常見并發癥之一,其臨床癥狀不典型,起病隱匿,病因復雜,常被延誤診斷。機體某些生物指標的改變與DPN的發生發展密切相關。同型半胱氨酸(homocysteine,Hcy)通過誘導炎癥因子的釋放以促進局部氧化應激損傷,活化N-甲基-D-天冬氨酸受體亞型(NMDA)間接增強鈣內流,從而破壞神經細胞的完整性[1]。維生素B12(Vitamin B12,VitB12)作為人體必需的維生素之一,可以通過降低Hcy水平起到保護神經細胞膜及血管內皮的作用,從而發揮保護神經組織的作用[2]。已有研究顯示,血清鐵蛋白升高與DPN的發生發展密切相關[3]。該指標可能是糖尿病慢性并發癥發生發展的獨立危險因素。以上3種指標均參與神經病變的發生過程。本研究通過探討老年T2DM周圍神經病變患者中血清鐵蛋白、VitB12、Hcy之間的關系,進一步探討三者在DPN發病中的相關機制及臨床意義。
1 資料與方法
1.1 一般資料選取2019年3—9月鄭州大學第一附屬醫院老年內分泌科收治的99例T2DM患者。將51例單純T2DM患者納入DM組:男34例,女17例,年齡60~78歲,平均(62.86±1.41)歲。將合并周圍神經病變的48例T2DM患者納入DPN組:男30例,女18例,年齡60~84歲,平均(68.12±0.93)歲。選取同時期于鄭州大學第一附屬醫院進行體檢的健康者45例,納入NC組,包括男22例,女23例,年齡57~74歲,平均(60.75±0.63)歲。采用WHO標準(1999)診斷DPN:(1)出現麻、疼、涼等感覺、運動神經病變;(2)跟、膝腱、踝反射減弱或消失;(3)肌電圖顯示感覺、運動神經傳導速度減慢,誘發電位波幅降低、潛伏期延長;(4)排除其他神經病變[4]。采用1999年WHO糖尿病診斷標準診斷T2DM:典型糖尿病癥狀加上隨機靜脈血漿葡萄糖水平≥11.1 mmol·L-1或空腹血漿葡萄糖(fasting plasma glucose,FPG)水平≥7.0 mmol·L-1或葡萄糖負荷后2 h血糖水平≥11.1 mmol·L-1,無糖尿病癥狀者需改日重復確認1次。排除糖尿病各種急慢性并發癥及心、肝、腎功能衰竭等情況。
1.2 收集指標性別、年齡、病程、糖化血紅蛋白(HbA1c)、血清鐵蛋白、Hcy、VitB12。在入組患者禁食8 h后,于次日晨采集空腹靜脈血4 mL,離心分離血清,采用電化學發光法測血清鐵蛋白,采用速率法檢測Hcy水平,采用高效液相色譜法測量糖化血紅蛋白,采用免疫微粒子化學發光法檢測VitB12。
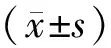
2 結果
2.1 一般資料和生化指標DM組病程與DPN組比較,差異無統計學意義(P>0.05)。3組年齡、HbA1c、鐵蛋白、Hcy、VitB12比較,差異有統計學意義(均P<0.05)。DM組和DPN組年齡、HbA1c、鐵蛋白及Hcy水平均高于NC組,DM組和DPN組VitB12水平低于NC組,差異有統計學意義(均P<0.05)。DPN組HbA1c、鐵蛋白及Hcy水平均高于DM組,VitB12水平低于DM組,差異有統計學意義(均P<0.05)。DPN組年齡與DM組比較,差異無統計學意義(P>0.05)。見表1。
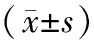
表1 3組一般資料及生化指標比較
注:與NC組比較,aP<0.05;與DM組比較,bP<0.05;HbA1c—糖化血紅蛋白;Hcy—同型半胱氨酸;VitB12—維生素B12。
2.2 鐵蛋白、Hcy、VitB12與各臨床指標的相關性鐵蛋白與HbA1c、Hcy呈正相關(均P<0.05);Hcy與年齡、HbA1c、鐵蛋白呈正相關(均P<0.05),與VitB12呈負相關(P<0.05);VitB12與年齡、HbA1c、Hcy呈負相關(均P<0.05);鐵蛋白、Hcy及VitB12均與病程無關(均P>0.05)。見表2。

表2 鐵蛋白、Hcy、VitB12與各臨床指標的相關性
注:HbA1c—糖化血紅蛋白;Hcy—同型半胱氨酸;VitB12—維生素B12。
3 討論
糖尿病神經病變是糖尿病常見的并發癥,DPN是其表現形式之一。研究表明,DPN發生發展與長期的高血糖狀態及由此導致的代謝障礙、神經營養因子缺乏、微循環異常、氧化應激自由基增多等因素有關[5]。
糖尿病患者多處于高血糖狀態, 體內會產生大量酮酸,嚴重破壞線粒體膜傳遞鏈,影響還原型煙酰腺嘌呤二核苷酸磷酸(NADPH)氧化酶活動,導致線粒體膨脹,使得內質網增生,釋放大量活性氧簇,最終可誘發DPN[6]。臨床上常應用HbA1c水平反映糖尿病患者近階段血糖情況。本研究發現NC組、DM組、DPN組HbA1c水平依次升高。這表明HbA1c在周圍神經損傷中發揮作用,與喻昆林等[7]研究結果一致。紅細胞的生命周期約為120 d,期間當血紅蛋白生成后可與糖類經非酶促反應合成HbA1c,合成速率與糖濃度成正比,合成過程緩慢且相對不可逆,與糖尿病發生發展關系非常密切。因此,HbA1c水平的高低直接影響糖尿病各種慢性并發癥的發生發展。當HbA1c持續處于高水平時,說明患者持續處于高糖狀態,而高血糖的記憶效應可能與周圍神經損傷密切相關[3]。
近年研究發現Hcy是神經病變的獨立危險因素之一[8-9]。老年T2DM患者Hcy水平又受到血清VitB12水平的影響。本研究中DPN組VitB12水平較NC組和DM組低,Hcy水平較NC組和DM組高,這與England等[10]研究一致。這表明VitB12、Hcy異常提示多發神經病變的危險性增加。本研究分析發現,Hcy與VitB12水平呈負相關。有研究提示低水平的VitB12可能會升高組織中的Hcy[11]。VitB12作為甲硫氨酸合成酶的輔酶,能促使甲基丙二酸轉化為琥珀酸而參與三羧酸循環,從而在保持有髓鞘的神經纖維的完整性中發揮了重要作用。當VitB12缺乏時,導致外周神經髓鞘受損從而出現神經病變。VitB12可間接使Hcy轉化為蛋氨酸。一旦VitB12缺乏,甲基丙二酰輔酶A轉化為琥珀酰輔酶A的反應過程受阻,致使Hcy水平升高,而高Hcy血癥對血管內皮的毒性作用可導致微循環缺血,影響周圍神經血供,從而引發周圍神經病變[7]。Ahmed等[12]對20例DPN患者應用甲鈷胺治療后,患者的振動感知閾值得到了顯著改善,提示甲鈷胺有助于治療亞臨床自主神經病變和DPN。
鐵作為機體內最重要的脂質過氧化反應促進劑,可以催化自由基生成,促進脂質氧化和動脈粥樣硬化的發生與發展,導致神經組織缺血、缺氧;氧自由基可進一步在游離鐵的作用下形成氧化性更強的羥自由基或超鐵氧離子,直接損傷神經組織[3]。鐵蛋白作為人體中鐵負荷的有效指標,通過以上機制參與DPN的發生、發展。在本研究中NC組、DM組、DPN組間鐵蛋白水平依次升高。T2DM患者血清鐵蛋白高于正常人[13]。DPN患者伴有高Hcy血癥[14]。本研究發現,鐵蛋白與Hcy呈正相關。這表明DPN患者鐵蛋白水平越高,Hcy水平也越高。血清鐵蛋白和Hcy與氧化應激密切相關。高血糖、高血清鐵蛋白誘導下的氧化應激形成大量的脂質過氧化物,對神經細胞產生毒性,加劇神經組織炎癥反應,破壞神經組織的結構和功能,導致神經再生修復障礙,參與DPN的發生、發展[5]。
綜上所述,老年T2DM并周圍神經病變患者血清鐵蛋白、Hcy呈現高水平狀態,VitB12呈低水平狀態,且鐵蛋白與Hcy呈正相關,Hcy與VitB12呈負相關。血清鐵蛋白和VitB12可能協同影響Hcy,從而促使周圍神經病變的發生、發展。

